玄参与烟草间作对土壤细菌群落结构的影响
张东艳,王军,杨水平,张雪,刘京,赵建,何大敏,杨红军,莫静静,苟剑渝,赵新梅,蒋卫,丁伟,陈大霞
玄参与烟草间作对土壤细菌群落结构的影响
张东艳1,2,王军2,杨水平1*,张雪3*,刘京2,赵建2,何大敏1,杨红军1,莫静静2,苟剑渝2,赵新梅1,蒋卫2,丁伟1,陈大霞3
(1.西南大学资源环境学院,重庆400715;2.贵州省烟草公司遵义市公司,贵州 遵义563000;3.重庆市中药研究院,重庆400065)
为研究玄参与烟草不同种植模式下对土壤细菌群落结构的影响,采用Illumina MiSeq技术测定土壤细菌,结果表明,玄参土壤细菌的丰富度和多样性高于植烟土壤,但未达显著水平,间作有降低植烟土壤细菌丰富度和多样性而提高玄参土壤细菌多样性的趋势。作物和种植模式在门和属水平上都影响着细菌丰度及优势菌排序,门水平上,植烟土壤中 Saccharibacteria显著高于玄参土壤,Gemmatimonadetes在玄参土壤中显著高于植烟土壤,Bacteroidetes在不同种植模式间差异显著;属水平上unclassified Xanthomonadaceae,norank Saccharibacteria,uncultured Gaiellales,norank SC-I-84等植烟土壤中显著高于玄参土壤,norank GR-WP33-30,norank JG30a-KF-32,Gemmatimonas,Candidatus_Solibacter,uncultured Nitrosomonadaceae,norank C0119,norank Subgroup_6,norank DA101_soil_group、norank BIrii41,Anaeromyxobacter,unclassified Xanthomonadales,uncultured Methylophilaceae,norank JG37-AG-20等玄参土壤中显著高于植烟土壤,而几乎没有菌属受种植模式影响达显著水平。主成分分析也表明作物较种植模式影响更大。因此,土壤细菌群落结构均受作物和种植模式影响,但作物影响更大,存在明显作物效应;间作土壤因作物而具有微生物群落二元结构。
烟草;玄参;间作;高通量测序;细菌
土壤微生物作为土壤生态系统重要的组成部分,参与了土壤有机质分解、养分转化的过程[1],是土壤养分和质量评价的重要指标[2]。细菌作为土壤微生物中重要的组成部分,其群落结构关系到土壤的可持续利用和抗压力[3-4]。不同栽培方式和作物对土壤微生物群落均会产生不同的影响[5]。马琨等[6-7]研究表明马铃薯(Solanumtuberosum)连作使土壤类型由细菌型向真菌型转化,与玉米(Zeamays)、蚕豆(Viciafaba)间作分别显著影响了微生物群落功能多样性、结构多样性。王文鹏等[8]通过探讨玉米不同种植方式下土壤微生物群落功能多样性的差异,得出种植模式影响玉米4个时期的主要土壤微生物类群,连作降低土壤微生物物种多样性,引起土壤微生物群落结构与功能的失调。不同作物对根区土壤微生物群落也具有较大影响,如豆科植物对根瘤菌具有诱导作用[9],不同品种的马铃薯之间根际微生物群落差异很大[10],不同基因型的苜蓿(Medicagosativa)之间根系细菌群落结构差异显著[11]。
中草药[12-13]和烟草(Nicotianatabacum)[14-16]都是重要经济作物,但烟草和多数中草药存在严重的连作障碍,轮、间作是消减连作障碍的有效措施[17-19]。川明参(Chuanminshenviolaceum)与烟草进行轮作表明,川明参能改善烟地土壤微生物群落结构[20]。玄参(Scrophularianingpoensis)为玄参科草本植物,具有清热凉血,滋阴降火,解毒散结的药用价值,对烟草幼苗有一定的化感增益效应[21],且在茬口上能够与烟草间作,但关于玄参与烟草间作及间作土壤微生物群落结构未有报道。本文利用Illumina MiSeq高通量测序技术,研究玄参与烟草间作土壤细菌群落结构,以期为玄参与烟草合理种植提供理论和实践指导。
1 材料与方法
1.1 试验地概况
本研究试验点设在贵州省遵义市遵义县八里村,属亚热带季风气候,年均气温14.7 ℃,年均降水量1200 mm。土壤类型为黄壤,pH 5.3,土壤肥力:有机质32.20 g/kg,全氮1.47 g/kg,碱解氮139.58 mg/kg,全磷1.82 g/kg,有效磷含量10.22 mg/kg,全钾27.00 g/kg,速效钾87.47 mg/kg。
1.2 试验设计
选取土壤条件均匀一致且前作均为玉米的地块,按照5 m×12 m划分12小区,每小区60 m2,按宽1.2 m起垄,共起10垄。设置窄行间作、宽行间作、单作3种植模式,3个重复,即:1)窄行间作——半垄玄参(2行,行距30 cm)+半垄烟草(1行,行距60 cm);2)宽行间作——1垄玄参(4行,行距30 cm)+1垄烟草(2行,行距60 cm);3)单作,分烟草单作(每垄2行)和玄参单作(每垄4行),烟窝距50 cm,玄参窝距40 cm。玄参于 2016年1月5日移栽子芽,烟草于2016年1月5日育苗,2016年4月25日移栽,田间管理按照当地习惯进行。
1.3 土样采集与分析
2016年9月2日于烟草采收末期,分别采集3种种植模式对应烟草和玄参土壤样品,烟草土样编号A,玄参B,构成作物和种植模式两因素6处理方案,6个处理分别:1A,1B,2A,2B,3A,3B。距作物主茎7~15 cm范围,按混合采样法采0~20 cm土层的土壤,每个土样由10个采样点的土壤混合,去除土样中的动植物残体等杂质,混合均匀后采用四分法取适量,迅速干冰冷冻处理,送到上海美吉生物医药科技有限公司对细菌16S rDNA基因测序,扩增引物采用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。
1.4 数据处理
首先对有效序列进行去杂、修剪、去除嵌合体序列等过滤处理,得到优化序列,通过聚类分析形成分类单元(Operational Taxonomic Units,OTUs),然后对在97%相似水平下的OTU进行生物信息统计分析。利用土壤细菌种类数(OTUs)和16S rDNA序列数(Reads)计算土壤细菌的Alpha多样性,菌群丰度指数:Ace、Chao[22],菌群多样性指数:Shannon、Simpson[23],覆盖度指数:Coverage。软件平台mothur(version v.1.30.1)用于指数分析。细菌群落结构分析是将优化序列根据数据库中的参考序列某一分类水平上进行鉴定。细菌丰度为某种细菌的16S rDNA序列数占细菌16S rDNA总序列数的百分数。
2 结果与分析
2.1 土壤细菌群落丰富度和多样性分析
通过对细菌16S rDNA的V3~V4区进行测序,6个处理分别得到25976~39100条序列。将序列抽平至25976条后,在97%的相似水平下,对所有序列进行OTU划分,然后计算菌群多样性(表1)。抽平后各样品测序覆盖率均在0.99以上,说明样品中序列未被测到的概率较低,测序量足以覆盖样品菌群组成[24]。细菌群落丰度指数Ace和Chao,其值越高表明群落物种的丰富度越高;Shannon和Simpson是对菌群多样性进行的评估,Shannon值越大,表明群落多样性越高,Simpson值越大,说明群落多样性越低。各处理的微生物丰富度和多样性指数虽无显著差异,但植烟土壤(1A、2A、3A)所含OTU(739、737、849)分别少于对应玄参土壤(1B,2B,3B)所含OTU(936、967、921),且Ace、Chao、Shannon值小于玄参土壤,Simpson值大于玄参土壤,由此说明玄参土壤微生物的丰富度和多样性高于植烟土壤。植烟土壤1A、2A、3A中,3A(单作烟)的OTU、Ace、Chao值均略大于1A、2A(1A,2A差别不大),而Shannon:3A>1A,Simpson值:3A<1A,2A和3A这两值差别不大,则说明了单作烟的微生物丰富度和多样性大于窄行间作烟1A,而宽行间作烟2A丰富度低而多样性高。玄参土壤1B,2B,3B中,丰富度指数相差不大,而多样性指数Shannon:1B>2B>3B,Simpson:1B<2B<3B,则说明间作对玄参土壤微生物丰富度影响不大,但略提高了多样性。总的来看,玄参土壤的微生物丰富度和多样性高于植烟土壤但不显著;间作略降低了植烟土壤微生物丰富度和多样性,增加了玄参土壤微生物多样性,也未达显著水平。
2.2 土壤细菌门水平群落结构分析
各处理在门水平的分布如图1。Proteobacteria(变形菌门)、Chloroflexi(绿弯菌门)、Actinobacteria(放线菌门)、Acidobacteria(酸杆菌门)、Firmicutes(厚壁菌门)、Saccharibacteria、Bacteroidetes(拟杆菌门)、Gemmatimonadetes(芽单胞菌门)、Planctomycetes(浮霉菌门)、unclassified-Bacteria、Verrucomicrobia(疣微菌门)、Cyanobacteria(蓝藻门)均为6处理的相对丰度较大的门类,其相对丰度之和均达97%以上。其中,不同作物间(烟和玄参)Saccharibacteria和Gemmatimonadetes这两个门类差异显著(P<0.05),Saccharibacteria在植烟土壤含量(3.62%,1.92%,3.11%)显著高于玄参土壤含量(0.95%,0.72%,0.67%);Gemmatimonadetes在植烟土壤含量(1.23%,2.88%,2.96%)显著低于玄参土壤含量(3.98%,4.64%,4.50%);其他门类丰度差异虽不显著,但仍发生了改变,如植烟土壤(1A,2A,3A)中的Actinobacteria和Firmicutes丰度高于对应的玄参土壤(1B,2B,3B),而Acidobacteria、Planctomycetes和Verrucomicrobia则低于对应的玄参土壤。
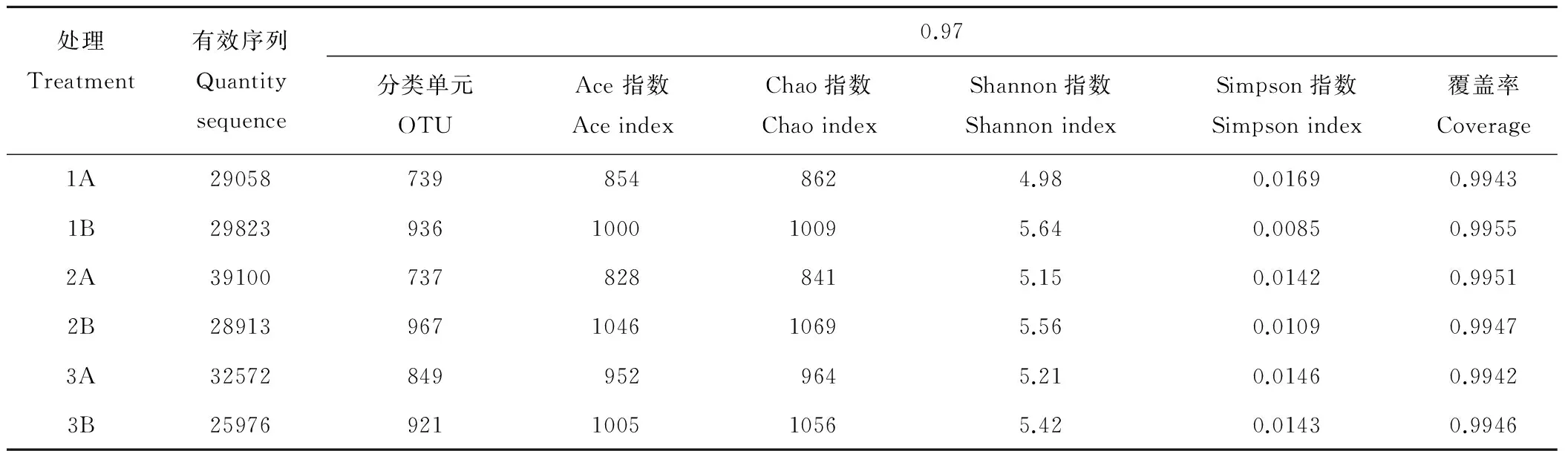
表1 不同处理土壤细菌丰富度和多样性Table 1 Richness and diversity index of bacteria in different treatments
注:0.97指OTU相似水平。
Note:0.97 refers to the similar level of OTU.

图1 土壤细菌门水平分布Fig.1 Phylum distribution of bacteria in soil
不同种植模式间Bacteroidetes差异显著(P<0.05),宽行间作(2A 4.94%,2B 4.75%)显著高于窄行间作(1A 3.41%,1B 3.92%)高于单作(3A 2.96%,3B 2.66%)。在3种种植模式的植烟土壤中,与单作烟(3A)相比,窄行间作烟(1A)的前5优势门顺序与3A相同,但在丰度上,1A的前2优势门Proteobacteria、Chloroflexi分别比3A增加5.42%、3.24%,后3优势门Actinobacteria、Acidobacteria、Firmicutes分别比3A减少1.97%、1.17%、3.43%;而宽行间作烟(2A)的优势门顺序与3A不同,前3优势门分别为Proteobacteria、Actinobacteria、Firmicutes,比3A增加7.48%、6.53%、0.76%,而Chloroflexi和Acidobacteria比3A降低9.40%、5.01%。在3种种植模式的玄参土壤中,与单作玄参(3B)相比,窄行间作玄参(1B)的前3优势门Proteobacteria、Chloroflexi、Acidobacteria与3B一致,含量上分别增加2.61%、减少5.26%、增加3.62%,Actinobacteria和Firmicutes的丰度均减少;宽行间作玄参(2B)的第2、3优势门Acidobacteria、Chloroflexi与3B相反,分别增加10.53%、降低9.45%。
2.3 土壤细菌属水平群落结构分析
各处理(1A、1B、2A、2B、3A、3B)分别检测出237、286、234、284、265、282属,玄参土壤属数量多于植烟土壤。
(1)优势属
按丰度列出各处理前20优势属,见表2,各处理优势属及丰度因作物和种植模式不同而有较大变化。共37属进入前20优势属,其中,有norank JG30-KF-AS9、Bacillus、uncultured Acidobacteriaceae_Subgroup_1、Lactococcus、Sphingomonas5属同时出现在各处理中,有7属仅出现在某单一处理中,即norank TK10、unclassified Rhodospirillales、Sorangium3属仅出现在1A中,unclassified Bacteria仅出现在2A中,Pseudolabrys、Reyranella2属仅出现在3A中,unclassified Gemmatimonadaceae仅出现在3B中。

表2 各处理前20优势属及丰度Table 2 The top 20 dominant genus and abundance in different treatments
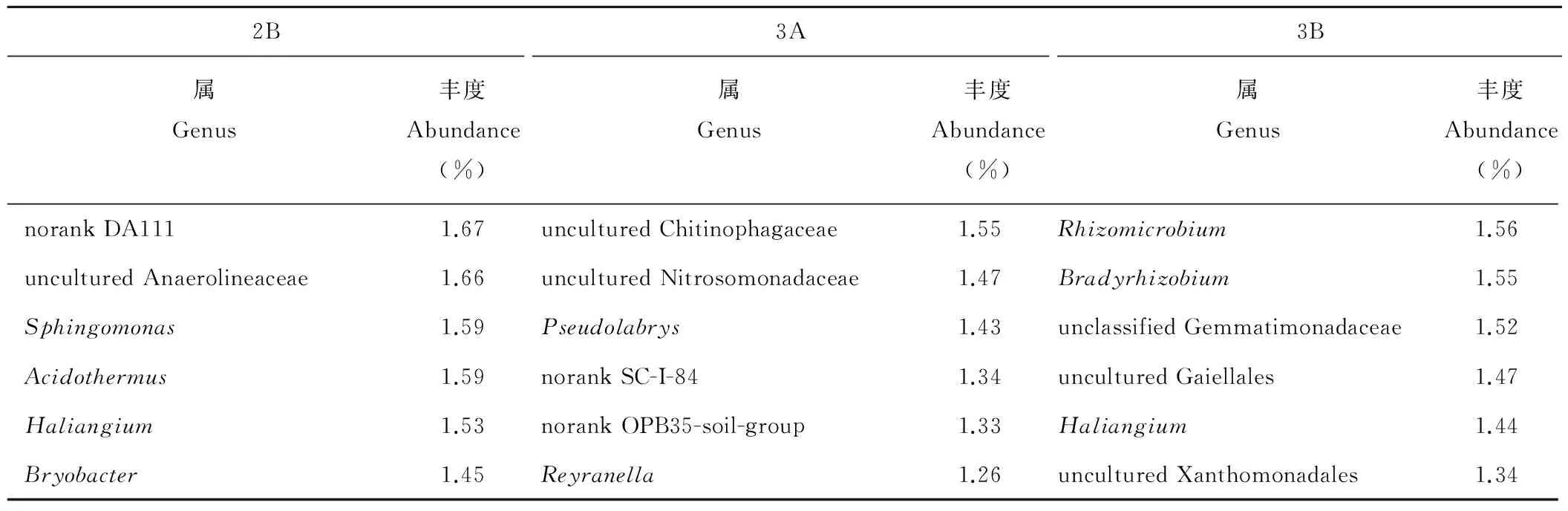
续表2 Continued Table 2
注:*,norank JG30-KF-AS9等不是真正意义上的属而是暂未分类的群,为便于分析,暂作属处理;其余以“norank”,“unclassified”冠名者同此。下同。
Note:*,norank JG30-KF-AS9 is temporary unclassified group,not really genus.For convenience of analysis,this paper regards it as genus.The rest of the “norank” and “unclassified” are also like this.The same below.
同一种植模式下的作物间的比较,窄行间作中,1A与1B共有7属,norank JG30-KF-AS9为1A的绝对优势属占到13.5%,而在1B中仅有3.61%,Acidibacter和uncultured Thermosporotrichaceae分别为第二、三优势属,却没出现在1B的前20属中;1B的第一优势属uncultured Acidobacteriaceae_Subgroup_1丰度为6.79%,而在1A中仅有2.87%,同样的作为第二、三优势属的uncultured Nitrosomonadaceae和uncultured Anaerolineaceae也没出现在1A的前20属中。宽行间作中,2A与2B共有11属,2A的前三优势属分别为Bacillus、Acidothermus、norank JG30-KF-AS9,虽都存在于2B的前20属,但丰度发生变化,变化较大的为Acidothermus,在2A中丰度为5.43%,而在2B中仅为1.59%;2B的前三优势属分别为uncultured Acidobacteriaceae_Subgroup_1、Bacillus、norank OPB35_soil_group,uncultured Acidobacteriaceae_Subgroup_1的丰度为9.76%,而在2A中仅占1.74%,第三优势属norank OPB35_soil_group未出现在2A的前20属中。单作中,3A与3B共有11属,3A的前三优势属norank JG30-KF-AS9、Bacillus、uncultured Acidobacteriaceae_Subgroup_1分别位居3B的第二、三、四属,3B的第一优势属为unclassified Ktedonobacterales占6.43%未出现在3A的前20属中。
植烟土壤的3种种植模式相比较,与单作3A相比,1A中有14属与3A相同,但丰度发生变化。1A和3A的第一优势属均为norank JG30-KF-AS9,但在1A中增加4.68%;3A的第二、三、四优势属Bacillus、uncultured Acidobacteriaceae_Subgroup_1、Sphingomonas在1A中分别减少1.71%、2.60%、3.12%;Acidibacter和Mizugakiibacter均未在3A的前20属,但在1A中丰度分别增至5.62%、4.68%。2A中有13属与3A相同,norank JG30-KF-AS9减少4.90%成为2A的第三优势属;Bacillus、Acidothermus分别增加0.69%、2.03%成为2A的第一、二优势属。在玄参的前20属中,与3B相比,1B中有17属与3B相同,其中3B的第一优势属unclassified Ktedonobacterales在1B中下降到1.49%,成为第20属;3B的第二、三优势属norank G30a-KF-32、Bacillus在1B中分别减少2.63%、2.07%;而uncultured Acidobacteriaceae_Subgroup_1、uncultured Nitrosomonadaceae在1B中分别增加1.54%、0.8%成为第一、二优势属;uncultured Anaerolineaceae没有出现在3B的前20属,却在1B中增加为第三优势属,丰度为4.07%。2B中有16属与3B相同,3B的前三属在2B中也是呈下降趋势,但下降幅度比1B小,其中Bacillus丰度虽降低,但优势顺序反而上升为2B的第二优势属;2B的第一优势属也为uncultured Acidobacteriaceae_Subgroup_1,但丰度比1B中高,达9.76%;norank OPB35_soil_group在3B中丰度为1.87%,在2B中增至5.03%成为第三优势属。
(2)作物比较效应
通过对土壤细菌序列数的比较发现,存在一些细菌,在3种种植模式下都表现出随作物一致性变化,或者植烟土壤一致性高于玄参土壤,或者玄参土壤一致性高于植烟土壤。表3列出两种作物平均相差超2倍的细菌属,经统计分析表明,这些属在作物间存在较高的差异显著性,而种植模式间差异都不显著。其中,Acidobacterium
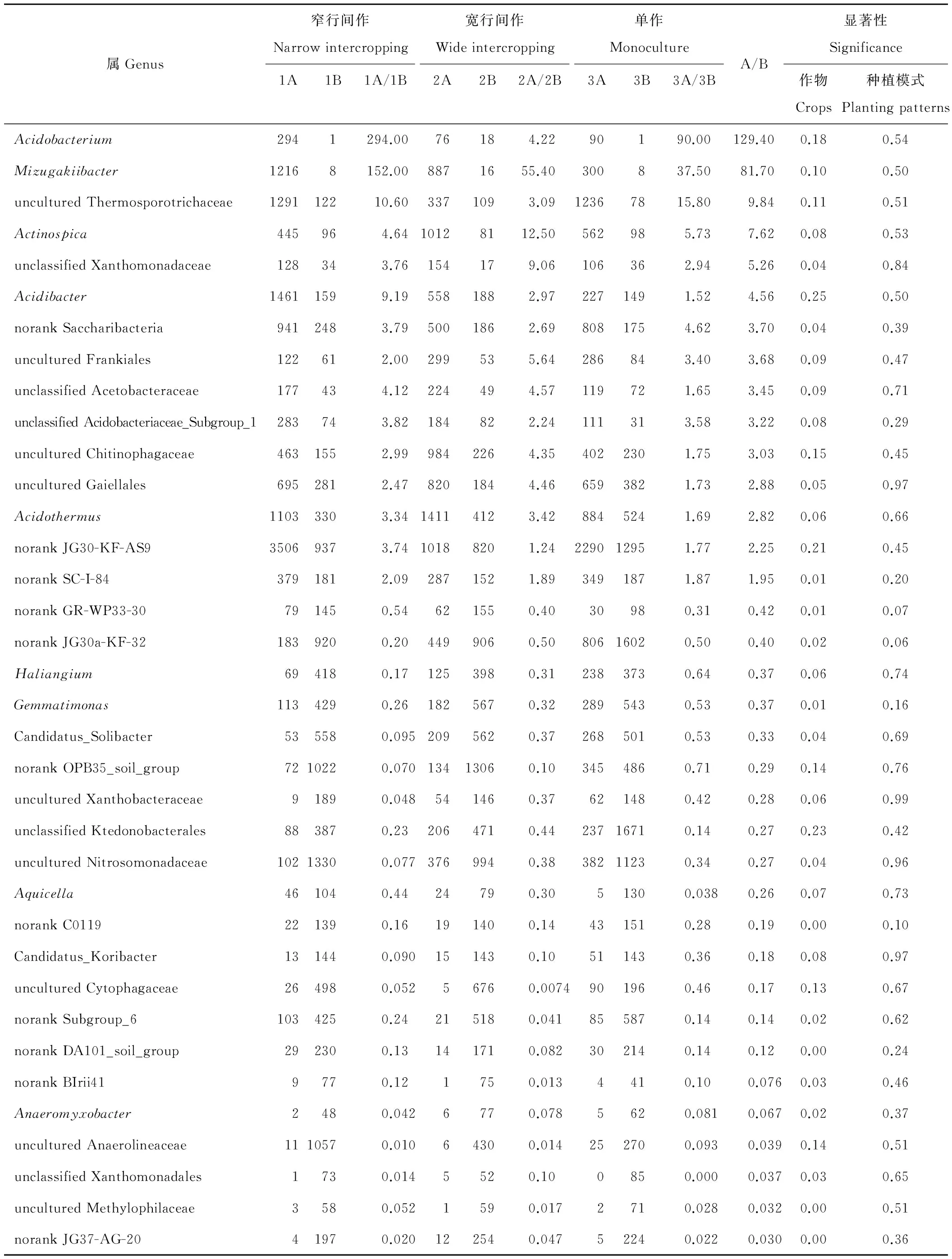
表3 烟、玄参土壤部分细菌序列数的比较Table 3 Comparison of some bacteria sequences between the tobacco soil and Scrophularia ningpoensis soil
在3种种植模式下植烟土壤分别是玄参土壤294、4.22、90倍,总体相差129.4倍;Mizugakiibacter在植烟土壤分别是玄参土壤152、55.4、37.5倍,平均81.7倍;uncultured Thermosporotrichaceae、Actinospica、unclassified Xanthomonadaceae,3种模式下植烟土壤也分别远高于玄参土壤,总体平均相差5~10倍;Acidibacter等其余10属也呈同样的变化规律。相反地,norank JG37-AG-20等21属则表现出玄参土壤一致性远高于植烟土壤的规律,尤其norank JG37-AG-20、uncultured Methylophilaceae、unclassified Xanthomonadales、uncultured Anaerolineaceae、Anaeromyxobacter、norank BIrii41,两作物间总体平均相差分别达10倍以上,norank DA101_soil_group、norank Subgroup_6、uncultured Cytophagaceae、Candidatus_Koribacter、norank C0119相差也达5~10倍。
2.4 土壤细菌群落组成主成分分析
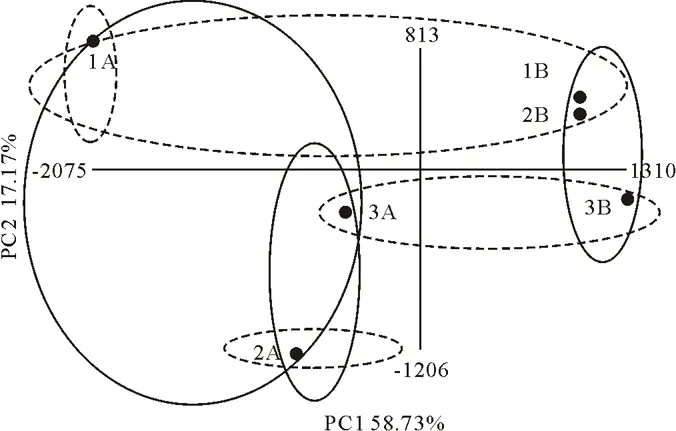
图2 细菌群落结构的主成分分析Fig.2 Principal component analysis of bacterial community structure
不同处理的土壤细菌群落结构主成分变异情况如图2。PC1和PC2表示不同群落间58.73%和17.17%的变异度。在PC1维度上,植烟土壤(1A、2A、3A)与玄参土壤(1B、2B、3B)分别被聚在一起,分布于纵轴两侧,烟、参土壤间差异显著。其中,玄参3种种植模式离散度小,而烟草中窄行间作(1A)偏离于另外两种种植模式。在PC2维度上,各点分布差异不显著,虽然如此,但仍显示出一定趋向性,即各处理间按种植模式而聚集,窄行间作(1A、1B)和单作(3A、3B)分别被聚在一起,宽行间作(2A、2B)则例外;3种模式间玄参离散度小而烟草离散度大。总的看来,作物对土壤微生物影响大达显著水平,而种植模式存在一定影响但未达到显著。
3 讨论
微生物是反映土壤生态系统变化的重要指标,其种群数量及群落多样性受土壤耕作措施和土壤环境的影响[25-26]。本研究中,两种作物之间,玄参土壤微生物丰富度和多样性在3种种植模式下一致高于植烟土壤,但都未达显著水平。3种种植模式相比,玄参土壤的微生物丰富度差异不明显,但间作有提高微生物多样性的趋势;对烟来说,间作有降低微生物丰富度和多样性的趋势。在门水平上,优势菌顺序及丰度随作物和种植模式而变化,作物对Saccharibacteria和Gemmatimonadetes影响达到显著,而种植模式对Bacteroidetes影响显著。属水平上,优势菌顺序及丰度也随作物和种植模式而变化,一些菌属表现出明显的作物效应,烟与玄参比较发现,它们在3种种植模式下随作物而一致性变化,烟、玄参间的差异呈现较高显著性,表现出受作物种类深刻影响,Acidobacterium等菌属植烟土壤一致性远高于玄参土壤,norank JG37-AG-20等更多一些属玄参土壤一致性远高于植烟土壤。而几乎没有菌属受种植模式这样的明显影响,作物的影响明显强于种植模式。主成分分析也表明,作物对土壤微生物群落结构影响达显著水平,种植模式影响不显著。
作物不同导致的细菌群落结构出现差异,当归因于根系分泌物的活动。根系分泌物对根际微生物群落结构具有选择塑造作用,不同植物的根际微生物群落结构具有独特性与代表性[27-29],从本研究看来,这种选择塑造作用远远超过根际范围。植物生长过程中通过根系向周围土壤环境分泌释放大量的各种有机物质,其数量通常情况下可达到植物光合固定碳的20%左右,有时甚至可高达30%~40%[30]。作物根系分泌物的种类和数量受多种因素影响,包括遗传和环境因素;特异性根系分泌物具有特殊生理活性,其种类和数量受遗传所主导[31]。利用GC-MS检测出两个烤烟品种K326和NC89不同提取条件下,共有根系分泌物主要成分包括17种有机酸、2种烷烃、4种酯类,以及硬脂酸酰胺、甘油和烟碱[32],其中在低分子量有机酸之一的月桂酸对植烟土壤的Cyanobacteria(蓝藻门)呈现显著的特异性影响[33]。另有研究认为,月桂酸可能就是茄科植物根系分泌物中的特异性物质之一[34]。刘艳霞等[35]检测到烟草根系分泌物中酚酸类物质主要为苯甲酸和3-苯丙酸,相对于拮抗菌,这两种成分更有利于病原菌。根际土壤中的细菌数量几乎是非根际土壤的10~100倍,硝化细菌又是细菌里比较活跃的一类功能性细菌,而李小林等[36]试验表明烟草根际土壤硝化细菌多样性小于非根际土壤,作者认为是烟草在生长后期分泌物增加,从而在一定程度上抑制了硝化细菌生长。药用植物含有大量次生代谢产物,如黄酮、蒽醌、生物碱、萜类、酚酸类等,这类小分子物质在栽培中很容易释放到环境中,进而影响土壤环境的微生物群落结构[37]。慕东艳等[38]对黑龙江省药用植物根际土壤真菌多样性的研究得出,不同种类药用植物根际土壤真菌的种类组成存在很大差异,且相同种类真菌的数量也存在较大差异,并认为这种差异性是由不同药用植物根系分泌物的不同所造成的[31]。目前,关于玄参根系分泌物的研究未有报道,其根系分泌物与烟草间的对比,以及它们如何影响微生物群落结构,需要更进一步的深入研究。
作物合理的间作能提高土壤微生物多样性[39-40]。本研究中,间作有提高玄参土壤微生物多样性,降低植烟土壤微生物丰富度和多样性的趋势。主成分分析中,3种种植模式的玄参离散度小,而烟的离散度较大,表明种植模式对玄参无明显影响,而对烟来说则需要选择更合理的种植模式。因此,在玄参与烟的间作中,还需探索更合理的间作模式,避免烟药配置的负效应。从间作土壤的整体看,同时存在玄参土壤和植烟土壤,由于明显的作物效应,因此具有微生物群落的二元结构。
4 结论
土壤细菌群落结构因烟、玄参及其种植模式而改变,烟、玄参明显地影响土壤细菌多样性、丰富度,显著改变细菌种群结构,塑造作物效应菌群。间作土壤的整体因作物而具有微生物群落二元结构。
References:
[1] Wang G H,Jin J,Xu M N,etal.Effects of plant,soil and soil management on soil microbial community diversity.Chinese Journal of Ecology,2006,25(5):550-556.王光华,金剑,徐美娜,等.植物、土壤及土壤管理对土壤微生物群落结构的影响.生态学杂志,2006,25(5):550-556.
[2] Hofman J,Dusek L,Klanova J,etal.Monitoring microbial biomass and respiration in different soils from the Czech Republic-a summary of results.Environment International,2004,30(1):19-30.
[3] Kaschuk G,Alberton O,Hungria M.Quantifying effects of different agricultural land uses on soil microbial biomass and activity in Brazilian biomes:inferences to improve soil quality.Plant and Soil,2011,338(1/2):467-481.
[4] Zhou J Z,Xia B C,Treves D S,etal.Spatial and resource factors influencing high microbial diversity in soil.Applied and Environmental Microbiology,2002,68(1):326-334.
[5] Bunemann E K,Bossio D A,Smithson P C,etal.Microbial community composition and substrate use in a highly weathered soil as affected by crop rotation and P fertilization.Soil Biology and Biochemistry,2004,36(6):889-901.
[6] Ma K,Zhang L,Du Q,etal.Effect of potato continuous cropping on soil microorganism community structure and function.Journal of Soil and Water Conservation,2010,(4):229-233.马琨,张丽,杜茜,等.马铃薯连作栽培对土壤微生物群落的影响.水土保持学报,2010,(4):229-233.
[7] Ma K,Yang G L,Ma L,etal.Effects of intercropping on soil microbial communities after long-term potato monocultrue.Acta Ecologica Sinica,2016,(10):2987-2995.马琨,杨桂丽,马玲,等.间作栽培对连作马铃薯根际土壤微生物群落的影响.生态学报,2016,(10):2987-2995.
[8] Wang W P,Mao R Z,Chen J B,etal.Analysis of functional diversity of soil microbial communities under different cultivation patterns at different growth stages of maize.Chinese Journal of Eco-Agriculture,2015,23(10):1293-1301.王文鹏,毛如志,陈建斌,等.种植方式对玉米不同生长期土壤微生物群落功能多样性的影响.中国生态农业学报,2015,23(10):1293-1301.
[9] Nie G,Chen W M,Wei G H.Genetic diversity of rhizobia isolated from shrubby and herbaceous legumes in Shenmu arid area,Shaanxi,China.Chinese Journal of Applied Ecology,2014,25(6):1674-1680.聂刚,陈卫民,韦革宏.神木地区耐旱灌木和草本豆科植物根瘤菌遗传多样性.应用生态学报,2014,25(6):1674-1680.
[10] Gschwendtner S,Esperschuetz J,Buegger F,etal.Effects of genetically modified starch metabolism in potato plants on photosynthate fluxes into the rhizosphere and on microbial degraders of root exudates.Fems Microbiology Ecology,2011,76(3):564-575.
[11] Di Giovanni G D,Watrud L S,Seidler R J,etal.Comparison of parental and transgenic alfalfa rhizosphere bacterial communities using Biolog GN metabolic fingerprinting and enterobacterial repetitive intergenic consensus sequence-PCR (ERIC-PCR).Microbial Ecology,1999,37(2):129-139.
[12] Sun X T,Li L,Long G Q,etal.The progress and prospect on consecutive monoculture problems of Panax notoginseng.Chinese Journal of Ecology,2015,34(3):885-893.孙雪婷,李磊,龙光强,等.三七连作障碍研究进展.生态学杂志,2015,34(3):885-893.
[13] Zhang M,Tan X H,Zhang Y,etal.Continuous cropping barrier in Chinese medicinal plants.Research and Practice on Chinese Medicines,2012,(1):83-85.张敏,谈献和,张瑜,等.中药材连作障碍.现代中药研究与实践,2012,(1):83-85.
[14] Su H Y,Cheng C C,Gong C R,etal.Effect of continuous cropping on chemical composition and ceutral croma components of flue-cured tobacco.Acta Agriculturae Jiangxi,2010,22(5):5-8.苏海燕,程传策,宫长荣,等.连作对烤烟化学成分和中性致香物质的影响.江西农业学报,2010,22(5):5-8.
[15] Deng Y C,Huang J G.Effect of long continuous cropping on the yields of flue-cured tobacco and nutrients in soils.Plant Nutrition and Fertilizer Science,2010,16(4):840-845.邓阳春,黄建国.长期连作对烤烟产量和土壤养分的影响.植物营养与肥料学报,2010,16(4):840-845.
[16] Zhang J G,Shen G M,Zhang J Q,etal.Advance in continuous cropping problems of tobacco.Chinese Tobacco Science,2011,(3):95-99.张继光,申国明,张久权,等.烟草连作障碍研究进展.中国烟草科学,2011,(3):95-99.
[17] Acosta-Martinez V,Upchurch D R,Schubert A M,etal.Early impacts of cotton and peanut cropping systems on selected soil chemical,physical,microbiological and biochemical properties.Biology and Fertility of Soils,2004,40(1):44-54.
[18] Chu G X,Shen Q R,Cao J L.Nitrogen fixation and N transfer from peanut to rice cultivated in aerobic soil in an intercropping system and its effect on soil N fertility.Plant and Soil,2004,263(1-2):17-27.
[19] Inal A,Gunes A,Zhang F,etal.Peanut/maize intercropping induced changes in rhizosphere and nutrient concentrations in shoots.Plant Pysiology and Biochemistry,2007,45(5):350-356.
[20] Zhang D Y,Zhao J,Yang S P,etal.Influence of tobacco-Chuanminshenviolaceumrotation on the microbe community in soil.China Journal of Chinese Materia Medica,2016,41(24):4556-4563.张东艳,赵建,杨水平,等.川明参轮作对烟地土微生物群落结构的影响.中国中药杂志,2016,41(24):4556-4563.
[21] Zhao X M,Wang J,Mo J J,etal.Allelopathic effects of leaf-stem litter water aqueous extracts of three plant species on tobacco seedlings.Acta Prataculturae Sinica,2016,25(9):37-45.赵新梅,王军,莫静静,等.三种作物茎叶枯落物水浸液对烟草幼苗生长的化感效应.草业学报,2016,25(9):37-45.
[22] Chao A.Nonparametric-Estimation of the number of classes in a population.Scandinavian Journal of Statistics,1984,11(4):265-270.
[23] Zhang W,Hu Y G,Huang G H,etal.Soil microbial diversity of artificial peashrub plantation on North Loess Plateau of China.Acta Microbiologica Sinica,2007,47(5):751-756.张薇,胡跃高,黄国和,等.西北黄土高原柠条种植区土壤微生物多样性分析.微生物学报,2007,47(5):751-756.
[24] Aldrete-Tapia A,Escobar-Ramirez M C,Tamplin M L,etal.High-throughput sequencing of microbial communities in Poro cheese,an artisanal Mexican cheese.Food Microbiology,2014,44:136-141.
[25] Ma D Y,Guo T C,Song X,etal.Effects of urea application rate on the quantity of microorganisms and activity of Enzymes in wheat rhizosphere.Acta Ecologica Sinica,2007,(12):5222-5228.马冬云,郭天财,宋晓,等.尿素施用量对小麦根际土壤微生物数量及土壤酶活性的影响.生态学报,2007,(12):5222-5228.
[26] Ren T Z.Soil bioindicators in sustainable agriculture.Scientia Agricultura Sinica,2000,33(1):68-75.任天志.持续农业中的土壤生物指标研究.中国农业科学,2000,33(1):68-75.
[27] Paterson E,Gebbing T,Abel C,etal.Rhizodeposition shapes rhizosphere microbial community structure in organic soil.New Phytologist,2007,173(3):600-610.
[28] Qu X H,Wang J G.Effect of amendments with different phenolic acids on soil microbial biomass,activity,and community diversity.Applied Soil Ecology,2008,39(2):172-179.
[29] Wu F Z,Wang X Z,Xue C Y.Effect of cinnamic acid on soil microbial characteristics in the cucumber rhizosphere.European Journal of Soil Biology,2009,45(4):356-362.
[30] Luo Y Q,Zhao X Y,Li M X.Ecological effect of plant root exudates and related affecting factors:A review.Chinese Journal of Applied Ecology,2012,23(12):3496-3504.罗永清,赵学勇,李美霞.植物根系分泌物生态效应及其影响因素研究综述.应用生态学报,2012,23(12):3496-3504.
[31] Bais H P,Weir T L,Perry L G,etal.The role of root exudates in rhizosphere interations with plants and other organisms.Annual Review of Plant Biology,2006,57:233-266.[32] Yu H Y,Shen G M,Gao X X.Determination of tobacco root exudates by GC-MS.Acta Tabacaria Sinica,2013,(4):64-72.于会泳,申国明,高欣欣.烟草根系分泌物的GC-MS检测.中国烟草学报,2013,(4):64-72.
[33] Yu H Y,Song X L,Wang S S,etal.Effects of low molecular weight organic acids on soil enzymes activities and bacterial community structure.Scientia Agricultura Sinica,2015,48(24):4936-4947.于会泳,宋晓丽,王树声,等.低分子量有机酸对植烟土壤酶活性和细菌群落结构的影响.中国农业科学,2015,48(24):4936-4947.
[34] Zhou B L,Chen Z X,Du L,etal.Allelopathy of the root exudates from different resistant eggplants to verticillium wilt (VerticilliumdahliaeKleb.).Acta Ecologica Sinica,2011,31(14):3964-3972. 周宝利,陈志霞,杜亮,等.不同抗病性茄子根系分泌物对黄萎菌的化感作用.生态学报,2011,31(14):3964-3972.
[35] Liu Y X,Li X,Cai L T,etal.Identification of phenolic acids in tobacco root exudates and their role in the growth of rhizosphere microorganisms.Journal of Plant Nutrition and Fertilizer,2016,22(2):418-428.刘艳霞,李想,蔡刘体,等.烟草根系分泌物酚酸类物质的鉴定及其对根际微生物的影响.植物营养与肥料学报,2016,22(2):418-428.
[36] Li X L,Gu Y F,Zhang X P,etal.Nitrobacteria community and diversity in the rhizosphere soil of mature tobacco.Scientia Agricultura Sinica,2011,44(12):2462-2468.李小林,辜运富,张小平,等.烟草成熟期根际硝化细菌种群的结构及其多样性.中国农业科学,2011,44(12):2462-2468.
[37] Guo L P,Huang L Q,Jiang Y X,etal.Soil deterioration during cultivation of medicinal plants and ways to prevent it.China Journal of Chinese Materia Medica,2006,(9):714-717.郭兰萍,黄璐琦,蒋有绪,等.药用植物栽培种植中的土壤环境恶化及防治策略.中国中药杂志,2006,(9):714-717.
[38] Mu D Y,Lü G Z,Sun X D,etal.Fungal diversity in rhizosphere soil of medicinal plants in Heilongjiang Province.Acta Ecologica Sinica,2013,33(1):229-237. 慕东艳,吕国忠,孙晓东,等.黑龙江省药用植物根际土壤真菌多样性.生态学报,2013,33(1):229-237.
[39] Song Y N,Marschner P,Zhang F S,etal.Effect of intercropping on crop yield and chemical and microbiological properties in rhizosphere of wheat (TriticumaestivumL.),maize (ZeamaysL.),and faba bean (ViciafabaL.).Acta Ecologica Sinica,2006,(7):2268-2274.宋亚娜,Petra Marschner,张福锁,等.小麦/蚕豆,玉米/蚕豆和小麦/玉米间作对根际细菌群落结构的影响.生态学报,2006,(7):2268-2274.
[40] Chai Q,Huang P,Huang G B.Effect of intercropping on soil microbial and enzyme activity in the rhizosphere.Acta Prataculturae Sinica,2005,14(5):105-110.柴强,黄鹏,黄高宝.间作对根际土壤微生物和酶活性的影响研究.草业学报,2005,14(5):105-110.
Influence ofScrophularianingpoensis-tobacco intercropping on bacterial community structure in soil
ZHANG Dong-Yan1,2,WANG Jun2,YANG Shui-Ping1*,ZHANG Xue3*,LIU Jing2,ZHAO Jian2,HE Da-Min1,YANG Hong-Jun1,MO Jing-Jing2,GOU Jian-Yu2,ZHAO Xin-Mei1,JIANG Wei2,DING Wei1,CHEN Da-Xia3
1.CollegeofResourcesandEnvironment,SouthwestUniversity,Chongqing400715,China;2.ZunyiSubsidiaryofGuizhouTobaccoCompany,Zunyi563000,China;3.ChongqingAcademyofChineseMateriaMedica,Chongqing400065,China
To explore the influence ofScrophularianingpoensisand tobacco planting on bacterial community structure in soil under different planting patterns,we used Illumina MiSeq technology to identify bacteria in soil.It was found that the richness and diversity of bacterial species inS.ningpoensissoil tended to be higher than in tobacco soil,but differences were not statistically significant.Crop species and planting pattern both affected the abundance and the order of dominant bacteria.At phylum level,presence of Saccharibacteria in tobacco soil was significantly higher than that inS.ningpoensissoil,whereas presence of Gemmatimonadetes inS.ningpoensissoil was significantly higher than that in tobacco soil.Bacteroidetes occurrence also varied between different planting patterns.At genus level,taxa significantly more common in tobacco soil than inS.ningpoensissoil,included unclassified Xanthomonadaceae,norank Saccharibacteria,uncultured Gaiellales,and norank SC-I-84.Meanwhile,forS.ningpoensissoil,significantly more common taxa (than in tobacco soil) included norank GR-WP33-30,norank JG30a-KF-32,Gemmatimonas,Candidatus_Solibacter,uncultured Nitrosomonadaceae,norank C0119,norank Subgroup_6,norank DA101_soil_group,norank BIrii41,Anaeromyxobacter,unclassified Xanthomonadales,uncultured Methylophilaceae,and norank JG37-AG-20.Planting pattern had almost no effect on genera detected.Principal component analysis also showed that crops had a greater influence than planting patterns.In summary,soil bacteria community structure differed between tobacco andS.ningpoensiscrops,and was also affected to a lesser extent by planting pattern.Hence,in an intercropped field the microbial community displays spatial heterogeneity determined by the crop species.
tobacco;Scrophularianingpoensis;intercropping;high-throughput sequencing;bacteria
10.11686/cyxb2016507 http://cyxb.lzu.edu.cn
张东艳,王军,杨水平,张雪,刘京,赵建,何大敏,杨红军,莫静静,苟剑渝,赵新梅,蒋卫,丁伟,陈大霞.玄参与烟草间作对土壤细菌群落结构的影响.草业学报,2017,26(6):120-130.
ZHANG Dong-Yan,WANG Jun,YANG Shui-Ping,ZHANG Xue,LIU Jing,ZHAO Jian,HE Da-Min,YANG Hong-Jun,MO Jing-Jing,GOU Jian-Yu,ZHAO Xin-Mei,JIANG Wei,DING Wei,CHEN Da-Xia.Influence ofScrophularianingpoensis-tobacco intercropping on bacterial community structure in soil.Acta Prataculturae Sinica,2017,26(6):120-130.
2016-12-30;改回日期:2017-03-14
贵州省烟草公司遵义市公司研究开发项目(201404),国家烟草专卖局重点项目(NY20150601070012),中央高校基本科研业务费专项资金(SWU113094),国家自然科学基金(31370602)和重庆市科委“科技平台与基地建设”项目(CSTC,2014ptyjd10001)资助。
张东艳(1991-),女,河南商丘人,在读硕士。E-mail:1750401841@qq.com
*通信作者Corresponding author.E-mail:yang-sp@163.com

