葛根上调肝胰岛素抵抗HepG2细胞OB—R IRS2,GLUT1和GLUT2蛋白调节糖代谢的研究
黎宇+罗新新+严奉东+魏漳彬+涂珺
[摘要] 研究中藥葛根对人肝癌HepG2细胞胰岛素抵抗(IR)模型糖代谢的改善作用并初步探讨葛根降糖的分子作用机制。该实验采用课题组优化方法,1×10-9 mol·L-1胰岛素加3.75×10-6 mol·L-1地塞米松联合给药HepG2细胞48 h建立稳定的IR模型;CCK-8法检测葛根含药血清对细胞活性的影响;葡萄糖氧化酶法检测多个时间点(12,15,18,21,24,30,36 h) IR-HepG2细胞葡萄糖消耗量;蒽酮法检测细胞内糖原含量;Western blot法检测胰岛素受体底物2(IRS2)、瘦素受体(Ob-R)、葡萄糖转运蛋白1(GLUT1)和GLUT2蛋白表达水平。研究结果显示葛根含药血清(5%,10%,15%)对IR-HepG2细胞的活力没有明显的影响;5%和10%葛根含药血清在给药18,21,24 h均显著上调IR-HepG2细胞葡萄糖消耗量(P<0.01),15%葛根含药血清除给药15 h上调葡萄糖消耗量较弱(P<0.05),18,21,24,30 h都显著上调葡萄糖消耗量(P<0.01),呈现一定程度剂量依赖性。葡萄糖消耗时效实验确认24 h是最佳时间点,进一步研究发现葛根含药血清作用24 h增加胞内糖原含量(P<0.01);上调IRS2,Ob-R,GLUT1和GLUT2蛋白表达量。葛根含药血清降糖作用可能部分通过上调Ob-R和IRS2蛋白表达来调节以PI3K/PDK为中心的胰岛素信号通路;上调IR-HepG2细胞GLUT1和GLUT2表达量,加速葡萄糖转运进入肝细胞中并增加糖原合成来增强IR-HepG2细胞的胰岛素敏感性来实现的。
[关键词] 胰岛素信号通路; 胰岛素受体底物2(IRS2); 瘦素受体(Ob-R); 葡萄糖转运蛋白1(GLUT1);GLUT2
[Abstract] To observe the anti-hyperglycemic effect of Puerariae Lobatae Radix in hepatocyte insulin resistance(IR) models, and investigate its preliminary molecular mechanism. IR-HepG2 cell model was stably established with 1×10-9 mol·L-1 insulin plus 3.75×10-6 mol·L-1 dexamethasone treatment for 48 h according to optimized protocol in our research group. After IR-HepG2 cells were treated with different concentrations(5%,10% and 15%) of Puerariae Lobatae Radix-containing serum, cell viability was detected by CCK-8 assay; the glucose consumptions in IR-HepG2 cells were separately detected at different time points (12, 15, 18, 21, 24, 30, 36 h) by using glucose oxidase method; intracellular glycogen content was detected by anthrone method; and the protein expression levels of leptin receptor (Ob-R), insulin receptor substrate-2 (IRS2), glucose transporter 1(GLUT1) and GLUT2 were detected by Western blot assay. The results showed that Puerariae Lobatae Radix-containing serum (5%, 10% and 15%) had no significant effect on IR-HepG2 cell viability; 5% and 10% Puerariae Lobatae Radix-containing serum significantly increased glucose consumption of IR-HepG2 cells (P<0.01) at 18, 21 and 24 h; 15% Puerariae Lobatae Radix-containing serum elevated the glucose consumption of IR-HepG2 cells at 15 h (P<0.05), and significantly elevated the glucose consumption at 18, 21, 24 and 30 h (P<0.01) in a dose-dependent manner. The optimized time of anti-hyperglycemic effect was defined as 24 h, and further study showed that Puerariae Lobatae Radix-containing serum could increase intracellular glycogen content after 24 h treatment (P<0.01), and up-regulate IRS2, Ob-R, GLUT1 and GLUT2 protein expression levels. Our results indicated that Puerariae Lobatae Radix-containing serum could achieve the anti-hyperglycemic effect through important PI3K/PDK signaling pathway partially by up-regulating the expression levels of Ob-R and IRS2, GLUT1 and GLUT2 in IR-HepG2 cells, accelerating the glucose transport into hepatocytes and increasing hepatic glycogen synthesis to enhance the anti-hyperglycemic effect of IR-HepG2 cells.
[Key words] insulin resistance (IR); IRS2; Ob-R; GLUT1; GLUT2
众多临床实践发现中药在降糖调脂及治疗2型糖尿病(type 2 diabetes mellitus,T2DM)中注重调节人体的整体机能,作用温和,长期使用具有较强的竞争优势[1]。在中药临床辨证治疗,葛根为主的系列经方广泛用于糖尿病发生发展的不同阶段。采用分子网络药理学方法发现,葛根主要成分葛根素、大豆苷元、染料木苷等均作用于胰岛素信号PI3K,JNK通路,PI3K,JNK通路在胰岛素信号转导途径中起着重要的作用,其异常的表达可能会影响葡萄糖转运和合成、脂质代谢等[2]。已有研究发现葛根颗粒剂可明显改善肥胖小鼠的糖脂代谢紊乱[3]。葛根煎剂能显著降低糖尿病大鼠空腹血糖、游离脂肪酸、TNF-α的含量来提高胰岛素敏感指数[4]。葛根主要药效成分葛根素能改善T2DM患者血糖[5],葛根素治疗糖尿病的主要作用机制可能与降血糖、抗氧化应激、抑制蛋白质非酶糖基化等相关[6]。
本课题组研究发现重用葛根的葛根芩连汤配伍干预糖尿病大鼠呈现更好的降糖降脂药效,可有效减轻胰岛素抵抗(insulin resistance,IR)。本课题组已采用血清药理学方法发现葛根含药血清可明显提高IR-3T3-L1脂肪细胞降糖降脂作用,干预多个糖脂代谢相关基因表达来改善脂肪IR的作用[7]。本实验采用先期优化胰岛素加地塞米松的稳定体外肝IR細胞模型[8],研究葛根含药血清对IR-HepG2细胞糖代谢的影响及并初步探讨降糖的相关分子机制,为葛根的方剂配伍和临床精准用药提供理论指导。
1 材料
1.1 药物 人肝癌细胞系HepG2细胞购于北京鼎国生物科技有限公司(源于协和细胞库)。葛根(批号912014,产地广西,江西汇仁药业有限公司),葛根素质量分数为5.4%,符合2015年版《中国药典》标准。
1.2 动物 SPF级雄性SD大鼠,购于北京维通利华实验动物技术有限公司,动物合格证号11400700119627。
1.3 试剂 葡萄糖测定试剂盒(上海荣盛生物药业有限公司,GOD-POD法,批号361500);DMEM高糖培养基(Hyclone公司,批号NAE1396);胰岛素(Sigma分装);地塞米松(Sigma公司,批号#BCBC92609V);Cell Counting Kit-8(同仁化学研究所,批号JH620);盐酸二甲双胍(中国食品药品检定研究院,批号41DF-4HDKM);非诺贝特(中国食品药品检定研究院,批号41DF-4HKJM);GLUT1抗体(美国Millipore公司,批号#2430566);GLUT2抗体(美国Abcam公司,批号#ab921599);Ob-R抗体(美国Santa公司,批号L2673);IRS-2(美国CST公司,批号3089S);辣根酶标记山羊抗鼠二抗(联科生物公司,批号#5103930)。
1.4 仪器 倒置显微镜(日本Olympus CKX41);CO2培养箱[赛默飞世尔科技(中国)有限公司];全波长酶标仪(Spectra Max Plus384,美国Molecular Devices);电泳仪、水平和垂直电泳槽、转移槽(美国Bio-Rad公司);化学发光凝胶成像仪(美国Bio-Rad公司)。
2 方法
2.1 葛根含药血清的制备及含量测定 参考本课题组已发表文献的方法制备[7],简述如下:称取葛根药材并加入8倍药重的水,浸泡30~60 min;煮沸40 min后,减压旋转蒸发浓缩制备葛根水提液(1 g·mL-1),保存于4 ℃备用。SD雄性大鼠60只,体重(280±20) g,随机分为空白血清组(40只),葛根含药血清组(20只)。含药血清组按每100 g大鼠体重给药量2.5 mL给予葛根水提液灌胃制备,分装-20 ℃保存。UPLC-MS检测葛根成分葛根素和大豆苷元出峰时间及含量。
2.2 细胞培养 将冻存的HepG2细胞用15%FBS转至细胞培养瓶中,放37 ℃,5%CO2培养箱中。待细胞接触性抑制后,用10%FBS的DMEM培养基每3 d按1∶3传代1次,待细胞从复苏适应2周后,于对数生长期进行实验。
2.3 IR-HepG2细胞模型建立 参考本课题先期优化肝IR模型建立方法[8],用1×10-9mol·L-1胰岛素加3.75×10-6 mol·L-1地塞米松培养诱导48 h后,弃去培养液,PBS洗涤2次,再用培养基37 ℃孵育20 min;重复上述过程1次,换上无血清培养液孵育24 h后,检测各组细胞培养基上清液中葡萄糖含量,计算葡萄糖消耗量。
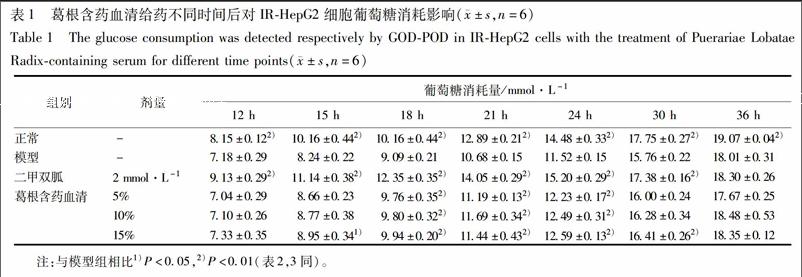
2.4 对IR-HepG2细胞葡萄糖消耗量的影响 复制2.3项中的模型,给药分组为正常组,IR组,二甲双胍组(2 mmol·L-1),5%,10%,15%葛根含药血清分组,每组都补大鼠空白血清至总血清含量为15%,在给药12,15,18,21,24,30,36 h分别采用葡萄糖氧化酶法检测其上清液中葡萄糖含量,参照文献加以改进[9],以无细胞的空白孔为对照,以起始葡萄糖浓度减去各时间点葡萄糖浓度来计算葡萄糖消耗量。
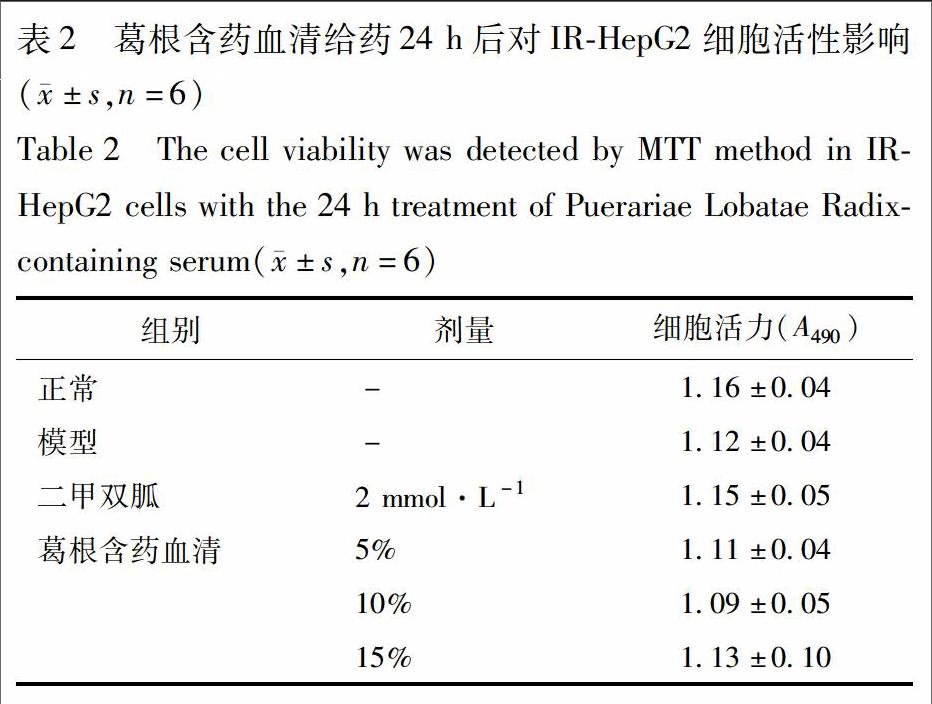
2.5 对HepG2细胞活性的影响 IR-HepG2细胞模型建立参照2.3项,细胞分组如2.4项。参照文献方法[8],给药24 h后,每孔加10 μL CCK-8测定液,孵育1 h后,酶标仪检测490 nm吸光度A,计算细胞存活率,细胞存活率=A模型组/A对照组×100%。
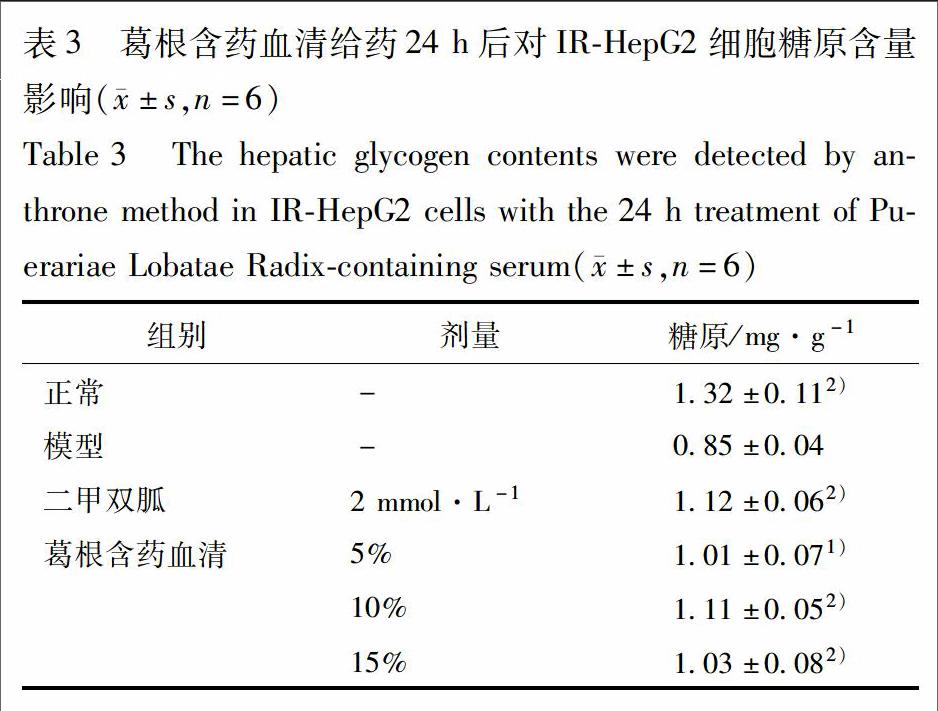
2.6 对IR-HepG2细胞糖原含量的影响 复制2.3项中的模型,细胞分组如2.4项。给药24 h时,将培养基弃去,用PBS清洗消化后,1 000 r·min-1, 5 min收集细胞。弃去上清后加入1 mL PBS将细胞吹打均匀后分为2份后离心弃上清。一份加入糖原裂解液提取细胞内的糖原,以蒽酮法测定糖原含量[10];另一份加入细胞裂解液提取细胞蛋白,用BCA试剂盒测定细胞内总蛋白含量。细胞糖原合成量=糖原量/细胞总蛋白量。
2.7 对IR-HepG2细胞IRS2,Ob-R,GLUT1和GLUT2蛋白表达影响 将培养基弃去加入裂解液覆盖细胞表面,放冰上10 min后4 ℃离心,14 000 r·min-1,15 min后取上清;用BCA测定蛋白浓度。取各组蛋白样品40 μg,以10%十二烷基硫酸钠聚丙烯酰胺凝胶分离蛋白,然后湿转法(280 mA,1 h)将蛋白质转移至PVDF膜上,再用含5%脱脂奶粉的1×TBST室温下封闭1 h后加入一抗蛋白,4 ℃过夜后,1×TBST洗膜3次,每次10 min;辣根过氧化物酶标记二抗蛋白,室温轻摇1 h,充分洗涤后加入ECL工作液,放入化学发光凝胶成像仪检测,采用BIO-RAD公司的Image Lab软件分析。
2.8 统计分析 所有数据以±s表示。2组间比较用单因素方差分析(One-Way ANOVA),P<0.05为差异有统计学意义。采用德国Qiagen公司的Ingenuity Pathway Analysis(IPA)通路软件对差异蛋白进行功能分析,网络关联并绘制相应示意图。
3 结果
3.1 葛根含药血清对IR-HepG2细胞葡萄糖消耗量的影响 在1×10-9 mol·L-1胰岛素加3.75×10-6 mol·L-1地塞米松联合培养48 h之后,与正常组相比,IR组葡萄糖消耗量显著降低(P<0.01);与IR组相比,5%和10%葛根含药血清在给药18,21,24 h均显著上调IR-HepG2细胞葡萄糖消耗量(P<0.01),15%葛根含药血清除给药15 h上调葡萄糖消耗量较弱(P<0.05),18,21,24,30 h都显著上调葡萄糖消耗量(P<0.01),呈现一定程度剂量依赖性。时效数据表明葛根含药血清在给药24 h增加IR-HepG2细胞的葡萄糖消耗量效果最好,见表1,认定24 h为最佳药效时间点。葛根含药血清按作用24 h进行后续糖原与蛋白实验。
3.2 葛根含药血清对IR-HepG2细胞活性的影响 不同剂量葛根含药血清作用于IR-HepG2细胞24 h后,与正常组相比没有明显差异,表明葛根含药血清对IR-HepG2细胞的活性没有明显影响,见表2。
3.3 葛根含药血清对IR-HepG2细胞糖原含量影响 与正常组相比,IR组细胞糖原含量显著降低(P<0.01)。给药24 h后,与IR组相比,葛根含药血清(5%,10%,15%)显著增加IR-HepG2细胞的糖原含量,以10%和15%葛根含药血清更为显著(P<0.01),见表3。
3.4 对IRS2,Ob-R,GLUT1和GLUT2蛋白表达差异影响 与IR组相比,10%和15%葛根含药血清作用24 h能显著上调IRS2, Ob-R和GLUT2蛋白表达量(P<0.01);葛根含药血清(5%,10%,15%)明显升高GLUT1蛋白表达,以5%和15%葛根含药血清更为显著(P<0.01),见图1。根据干预蛋白表达差异绘制葛根含药血清干预糖代谢途径的示意图,见图2。
4 讨论
糖尿病药物研发以前多集中在单靶点的单成分药物上,目前多靶点开发的西药复方药物不断研发上市并获得较为广泛的接受。单味中药和复方含有多个有效活性成分,可以多通路多靶点在多层次多水平多器官上作用于机体,可以产生较好疗效,长期使用具有较小副作用,具有天然用药优势。
众所周知,T2DM的主要病理基础是IR,IR贯穿T2DM发生发展的整个过程。IR主要表现为机体三大外周组织(脂肪、肝脏和骨骼肌)细胞膜上转运和利用葡萄糖效率下降[11]。许多T2DM药物的研发是基于影响胰岛素信号通路的靶点来研发的,因为胰岛素信号传导障碍被认为是诱发糖尿病系统性IR的主因。胰岛素信号转导途径是胰岛素和细胞膜表面的胰岛素受体结合后,磷酸化胰岛素受体底物(insulin receptor substrate,IRS),與PI3K形成蛋白复合物,磷酸化的PI3K进一步通过PKB/Akt,PKC和一些下游通路,影响到葡萄糖转运和糖原合成[12]。
葡萄糖转运蛋白(glucose transporter,GLUT)是介导哺乳动物细胞内葡萄糖转运和代谢的关键限速因子。GLUT蛋白表达和结构异常与糖尿病及其并发症的发生发展密切相关,从血糖调节角度来说值得关注[13]。GLUT1分布最为广泛,在哺乳动物各组织和细胞中均有表达,在细胞的基础糖代谢中发挥重要作用。GLUT1的调节同GLUT4类似,可分为糖代谢前期的快调节和后期的慢调节2种形式,快调节主要是GLUT1从胞质转位到细胞膜上,慢调节主要是增加GLUT1的合成或减少GLUT1的降解来增加GLUT1蛋白总量[12]。笔者的实验结果显示肝IR造成细胞外液葡萄糖堆积形成高糖环境导致GLUT1表达下调,与以往研究结果相一致[13]。多个剂量组葛根含药血清可通过慢调节显著增加IR-HepG2细胞中GLUT1蛋白总量。此外,葛根含药血清升高肝细胞IRS2蛋白表达,可能增强磷酸化PI3K/ PDK/αPKC信号通路,加速GLUT1转位到细胞膜上[14]。推测葛根可能以快慢2种方式调节GLUT1的数量和位置来主动调节IR-HepG2细胞的糖代谢,减轻肝葡萄糖转运障碍。
除了GLUT1采用主要运输的转运方式外,其他GLUTs主要以易化扩散的被动运输方式来穿过细胞膜的脂质双分子层实现葡萄糖的转运。GLUT2是一种和葡萄糖结合力很低但具有高转运能力的蛋白,主要分布在肝肾和胰岛β细胞中,GLUT2可与葡萄糖激酶共同形成葡萄糖感受器,转运葡萄糖进入细胞中,经一系列信号传递,促成胰岛β细胞的胰岛素合成与分泌。GLUT2也是肝细胞中负责葡萄糖转运的最主要媒介,可为糖原合成提供原料帮助抑制肝糖输出来维持血糖稳态[13-14]。GLUT2不同于GLUT1/GLUT4从胞浆外翻至细胞质膜上执行功能,则主要是从细胞质膜上转运葡萄糖进入细胞后内吞至胞浆内代谢[15]。本实验研究结果显示在无血清培养基孵育24 h后,正常HepG2细胞中GLUT2表达非常低,图1上未见明显条带,与体外正常肝细胞中GLUT2可见明显条带不一致,推测原因可能是细胞外液葡萄糖堆积较少,加之作为癌细胞HepG2中GLUT1基础表达较高,因而抑制GLUT2表达。IR细胞适应高糖环境升高肝细胞膜表面GLUT2的表达,但仍不足以快速消耗外液中过量堆积的葡萄糖。10%和15%葛根含药血清明显上调GLUT2的表达,加速葡萄糖转运进入肝细胞中,为更多的肝糖原提供合成原料增强降糖效应,与其他复方制剂芪蛭降糖胶囊升高GLUT2表达相一致[16]。
瘦素是多功能多靶器官的神经免疫内分泌调节激素,可抑制食欲减少脂肪过度堆积。瘦素与Ob-R结合参与多种信号传导,可在体内外调节胰岛素诱导相关基因表达。Ob-R和瘦素的突变与胰岛素分泌异常密切相关,且相互紧密关联[17]。瘦素抵抗会明显抑制胰岛素受体的表达从而加重机体IR程度。正常的瘦素信号可以增强IRS和PI3K的结合。人肝细胞主要表达IRS2,是抑制肝糖異生必须的蛋白。IRS2是肝细胞中PI3K-Akt级联中关键调控节点,缺失肝IRS2信号可导致营养过剩和肝能量代谢紊乱[18]。本实验研究表明,与IR组相比,10%和15%葛根含药血清增强IR-HepG2细胞Ob-R和IRS2表达。结合其他研究结果,推测葛根增强Ob-R和IRS2表达来减轻瘦素对胰岛素受体表达抑制,增强IRS2和PI3K的结合,调节以磷酸化PI3K/PDK为中心节点的胰岛素信号通路,通过PKC及其下游通路调节葡萄糖转运,上调GLUT1和GLUT2表达及可能增加GLUT1的转位到肝细胞膜上,从而减轻葡萄糖转运障碍;通过PKB/Akt及其下游通路增加肝细胞内糖原合成来改善糖代谢来增强胰岛素敏感性。
总之,葛根含药血清能够有效调节肝糖代谢来改善IR,具体的调节机制还需要对胰岛素信号通路上重要节点IRS2,Ob-R,PI3K和AKT等蛋白磷酸化水平及活性进一步深入研究。对葛根体外细胞糖代谢的系列基础研究将有助于从理论上指导以葛根为主要配伍的降糖复方制剂开发。
[参考文献]
[1] 史秀明,徐国良,黎宇,等.中药治疗糖尿病的研究进展[J].江西中医药,2015,46(5):64.
[2] 林卫东,胡靖敏,梁生旺,等.葛根改善胰岛素抵抗的网络药理学研究[J].中药材,2016,39(7):1628.
[3] Prasain J K, Peng N, Rajbhandari R, et al. The Chinese Pueraria root extract (Pueraria lobata) ameliorates impaired glucose and lipid metabolism in obese mice[J]. Phytomedicine, 2012, 20(1):17.
[4] 刘竹青,张克良,麻风华.葛根煎剂对糖尿病大鼠降血糖机理的研究[J].中医药信息,2005, 23(3):56.
[5] 王宪,赵晓燕,李建.葛根素对2型糖尿病患者IR作用的研究[J].中华全科医学,2010,8(1):46.
[6] 李文平,石京山,陈修平.葛根素对糖尿病及其并发症的治疗作用和机制研究进展[J].山东医药,2015,35(15):90.
[7] 罗新新,徐国良,黎宇,等.葛根调节脂肪细胞糖脂代谢改善胰岛素抵抗的研究[J].中国中药杂志,2016,41(14):2687.
[8] 黎宇,徐国良,罗新新,等.胰岛素加地塞米松联合诱导体外肝细胞胰岛素抵抗模型的建立[J].江西中医药杂志,2016,47(3):40.
[9] Kang Y J, Jung U J, Lee M K, et al. Eupatilin, isolated from Artemisia princeps Pampanini, enhances hepatic glucose metabolism and pancreatic β-cell function in type 2 diabetic mice[J].Diabetes Res Clin Pract,2008,82(1): 25.
[10] 任新凤,陆雪芬.科罗索酸对HepG2细胞糖消耗以及细胞内糖原的影响[J].药学进展,2011, 35(3):129.
[11] Saltiel A R, Kahn C R. Insulin signalling and the regulation of glucose and lipid metabolism[J]. Nature, 2001,414:799.
[12] Guo S D. Insulin signaling resistance, and the metabolic syndrome: insights from mouse models to disease mechanisms[J]. J Endocrinol, 2014, 220(2):T1.
[13] Klip A, Tsakiridis T, Marette A, et al. Regulation of expression of glucose transporters by glucose: a review of studies in vivo and in cell cultures[J].FASEB J,1994,1:43.
[14] Burant C F, Sivitz W I, Fukumoto H, et al. Mammalian glucose transporters: structure and molecular regulation[J]. Recent Prog Horm Res,1991,47:349.
[15] Leturque A, Brot-Laroche E, Le Gall M. GLUT2 mutations, translocation, and receptor function in diet sugar managing[J]. Am J Physiol Endocrinol Metab, 2009, 296(5): E985.
[16] 刘博,于春江,孟祥宝,等.芪蛭降糖胶囊对2型糖尿病大鼠肝组织中InsR, PI3K, GLUT2, p-JNK蛋白表达影响[J]. 中国中药杂志,2016, 41(11):1978.
[17] Dong X, Park S, Lin X, et al. Irs1 and Irs2 signaling is essential for hepatic glucose homeostasis and systemic growth[J]. J Clin Invest,2006, 116:101.
[18] Szanto I, Kahn C R. Selective interaction between leptin and insulin signaling pathways in a hepatic cell line[J]. Proc Natl Acad Sci USA,2000, 97: 2355.
[责任编辑 张宁宁]

