变温干制对白花丹参有效成分的二次提升研究
周冰谦+吕海花+杨帆+刘伟+耿岩玲+王晓+王涛+曲振玉
[摘要] 该文研究了不同变温干制条件对白花丹参有效成分的影響,为优选白花丹参产业化干制工艺提供基础。为保证丹参活性成分含量,设计多种变温干制工艺,分别为低温30 ℃高温60 ℃、低温30 ℃高温70 ℃、低温30 ℃高温80 ℃、低温40 ℃高温60 ℃、低温40 ℃高温70 ℃、低温40 ℃高温80 ℃,采用鼓风干燥箱对白花丹参进行变温干制,利用HPLC测定不同干制条件下白花丹参中的有效成分含量变化;采用SPSS 17.0统计软件分析数据。结果显示当采用低温40 ℃-6 h-高温80 ℃干制3 h的工艺时,丹参中二氢丹参酮、隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA的含量最高,质量分数分别是0.35,2.76,0.78,4.47 mg·g-1,其中二氢丹参酮、隐丹参酮和丹参酮Ⅰ的含量分别比阴干样品增加2.9%(P>0.05),45.3%(P<0.05),34.5%(P<0.05),丹参酮ⅡA的含量减少44.1%(P<0.05)。其相应水溶性成分迷迭香酸及丹酚酸B的含量当采用低温30 ℃-6 h-高温70 ℃干制3 h的工艺时达到最高,分别是3.83,55.44 mg·g-1,分别比阴干时增加62.3%(P<0.05),109.1%(P<0.05)。变温干制显著影响白花丹参有效成分含量的变化,相对于传统的阴干工艺,低温干制增加白花丹参中水溶性成分的含量,对二氢丹参酮、隐丹参酮、丹参酮Ⅰ等脂溶性成分含量也有明显促进作用,变温干制可以有效缩短干燥过程,为丹参产业化加工提供一定的理论基础。
[关键词] 白花丹参; 变温干制; 有效成分
[Abstract] To study the effects of different variable temperature drying modes on active components of roots of Salvia miltiorrhiza f. alba, and provide basis for its industrialized drying process. In order to ensure the content of active components, variable temperature drying modes were designed: low temperature at 30 ℃ and high temperature at 60 ℃, low temperature at 30 ℃ and high temperature at 70 ℃, low temperature at 30 ℃ and high temperature at 80 ℃, low temperature at 40 ℃ and high temperature at 60 ℃, low temperature at 40 ℃ and high temperature at 70 ℃, low temperature at 40 ℃ and high temperature at 80 ℃ and air dry oven was used for variable temperature drying process. Then HPLC method was used to determine the changes of active components in roots of S. miltiorrhiza f. alba under different temperature modes; and SPSS 17.0 was used to analyze the data. The results showed that the samples, which were first dried at 40 ℃ for six hours and then dried at 80 ℃ for three hours, had the highest contents in dihydrotanshinone, cryptotanshinone, tanshinone Ⅰ and tanshinone ⅡA as compared with other kinds of drying methods, and the contents were 0.35, 2.76, 0.78, 4.47 mg·g-1, respectively. Additionally, as compared with samples dried in the shade, the contents of dihydrotanshinone, cryptotanshinone and tanshinone Ⅰ were increased 2.9% (P>0.05), 45.3% (P<0.05) and 34.5% (P<0.05), respectively; however, the content of tanshinone ⅡA was decreased by 44.1% (P<0.05). The water-soluble active components (rosmarinic acid and salvianolic acid B) of roots of S. miltiorrhiza f. alba, had the highest contents when the samples were first dried at 30 ℃ for six hours and then 70 ℃ for three hours, and the contents were 3.83,55.44 mg·g-1, increased by 62.3% (P<0.05) and 109.1% (P<0.05) respectively as compared with the samples dried in the shade. Variable temperature drying can significantly affect the contents of active components in roots of S. miltiorrhiza f. alba. As compared with the traditional process of shade-drying process, low temperature drying can significantly increase the content of water-soluble active components and also with significant promotion effect on the liposoluble components such as tanshinone ⅡA, cryptotanshinone and tanshinone Ⅰ. The variable temperature drying mode, can effectively shorten the process of drying and provide theoretical basis for industrial processing of roots of S. miltiorrhiza f. alba.
[Key words] roots of Salvia miltiorrhiza f. alba; variable temperature drying; active components
丹参为唇形科鼠尾草属植物丹参Salvia miltiorrhiza Bge.的干燥根及根茎,具有活血祛瘀,通经止痛,清心除烦,凉血消痈的功效[1]。白花丹参为紫花丹参的变型[2],除具有紫花丹参的用途外,对治疗血栓闭塞性脉管炎具有独特疗效[3],目前白花丹参主要在山东省大量种植,为山东特产药材之一[4]。已有文献表明[5-6],白花丹参根、茎中总丹参酮、总黄酮等的含量较紫花丹参相应部位的含量高,这些均表明白花丹参可能具有更高的药用价值。近年来关于白花丹参的研究主要集中在化学成分测定、微量元素等方面[7-10],对于其采后有效成分含量变化的研究较少,而产地加工作为不可缺少的重要环节[11],对白花丹参的药材生产及品质形成起着至关重要的作用。
现已研究表明,产地加工的干制环节作为药材生产的必要工序,对中药材的有效成分含量有着显著的影响[12-14]。如不同温度烘干的丹参样品与阴干、晒干的样品相比,其隐丹参酮和丹参酮ⅡA的含量显著提高[15]。而变温干燥作为简便节能的干燥技术之一,在国内外农产品加工中应用较多[16],能够很大程度上改善干燥后的质量,且随着近年来对干燥工艺的重视,其在中药材产地加工中应用也逐渐增多[17]。本研究以山东莱芜白花丹参为实验材料,采用高效液相色谱法,选择脂溶性成分(二氢丹参酮、隐丹参酮、丹参酮Ⅰ及丹参酮ⅡA)和水溶性成分(丹酚酸B、迷迭香酸)作为定量指标,对不同变温干制的工艺进行比较,为建立规范化的高效现代化干燥工艺提供技术支撑,为丹参产业化加工提供一定的理论支撑。
1 材料
1.1 药材
白花丹参药材于2015年10月中旬到12月,分批次采收于山东莱芜紫光生态园丹参种植基地,经山东中医药大学李佳教授鉴定为唇形科植物丹参S. miltiorrhiza f.alba的根。
1.2 仪器
SB-3200 DT型超聲波清洗仪(宁波新芝生物科技股份有限公司);Agilent 1120高效液相色谱仪;Agilent DAD检测器;Agilent ChemStation工作站(美国安捷伦公司);分析天平(METTLER公司);1/10万电子天平(赛多利斯科学仪器北京有限公司);GZX-9140 数显鼓风干燥箱(上海博讯实业有限公司)。
1.3 试剂
甲醇,乙醇(分析纯),乙酸,乙腈(色谱纯),水为娃哈哈纯净水;丹参药材脂溶性对照品:二氢丹参酮、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA(山东省分析测试中心,纯度≥98%),水溶性对照品:丹酚酸B(山东省分析测试中心,纯度≥98%)、迷迭香酸(成都曼思特生物科技有限公司,批号MUST 12020702,纯度≥98%)。
2 方法
2.1 样品制备
选择直径相同的白花丹参根茎,除去芦头、须根以及泥土,将其切成长短一致(1~2 mm)的切段,将干制过程分为2个阶段,第一阶段为白花丹参活性成分生成阶段(Ⅰ),选择30,40 ℃,干制时间分别为4,5,6 h,研究活性成分的变化规律,筛选最佳前期干制温度和干制时间;第二个阶段为快速失水阶段(Ⅱ),在白花丹参活性成分稳定之后,迅速升高干制温度,筛选60,70,80 ℃ 3个处理,在稳定白花丹参活性成分的前提下快速使药材失水,整个干制时间持续10 h左右,每隔1 h提取1次,直至恒重。
2.2 对照品溶液的制备
2.2.1 脂溶性对照品 精密称取丹参酮Ⅰ 0.003 8 g,丹参酮ⅡA 0.003 4 g,二氢丹参酮0.003 8 g,隐丹参酮0.003 8 g,甲醇溶解后分别定容于25 mL量瓶中,依次吸取1,3,3,3 mL于10 mL量瓶中配成脂溶性混标,质量浓度依次为0.015 2,0.040 8,0.045 6,0.045 6 g·L-1。
2.2.2 水溶性对照品 分别取丹酚酸B 0.001 8 g,甲醇溶解后定容于5 mL量瓶中,质量浓度为0.36 g·L-1;迷迭香酸0.002 4 g甲醇溶解后定容于10 mL量瓶中,质量浓度为0.24 g·L-1。
2.3 供试品溶液的制备
取不同干制工艺的白花丹参样品0.5 g,用研钵研碎,置磨口锥形瓶中,加入50 mL 70%乙醇,超声提取30 min,冷却至室温,过滤,定容,滤液过0.45 μm微孔滤膜,保存备用。
2.4 色谱条件的选择
Compass色谱柱C18(4.6 mm×250 mm,5 μm),脂溶性成分测定条件:流动相乙腈-0.2%乙酸 55∶45,检测波长270 nm,柱温25 ℃,流速1.0 mL·min-1,进样体积5 μL;水溶性成分检测条件:流动相为0.2%乙酸水(A)-乙腈(B),梯度洗脱(0~25 min,5%~35% B;25~26 min,35%~100% B),检测波长280 nm,柱温25 ℃,流速1.0 mL·min-1,进样体积5 μL。
2.5 线性关系考察
取制备好的6种不同浓度的对照品溶液,进样5 μL,按选择好的色谱条件测定峰面积。以对照品进样量(μg)为横坐标(X),峰面积积分值为纵坐标(Y),绘制标准曲线,得6种标准品的回归方程,见表1。结果表明,各成分在相应的进样量范围内与各自的峰面积积分值的线性关系良好。
2.6 数据分析
用SPSS 17.0软件进行同组间的差异显著性分析,用Excel软件处理数据并获得标准差。
3 结果
3.1 变温干制对白花丹参脂溶性成分的影响
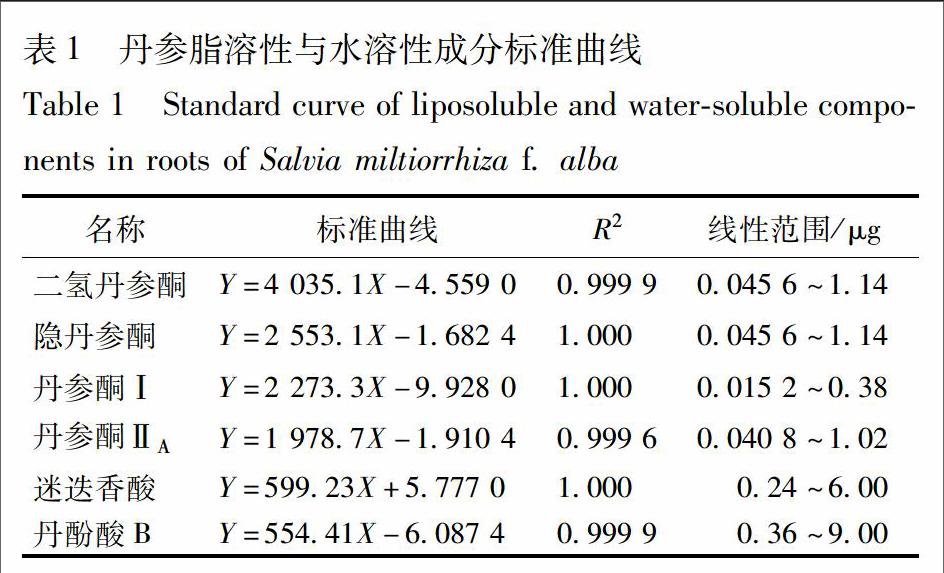
3.1.1 Ⅰ30 ℃Ⅱ60 ℃不同干制工艺对脂溶性成分的影响 采用低温30 ℃分别烘干4,5,6 h高温60 ℃的变温干制对白花丹参脂溶性成分的影响见图1。鲜样中二氢丹参酮、隐丹参酮、丹参酮Ⅰ及丹参酮ⅡA质量分数分别为0.31,3.6,0.70,5.00 mg·g-1,3种变温干制工艺加工时脂溶性含量均呈现先下降后上升的趋势,干制至恒重时其相应含量最高分别为0.25,2.52,0.50,3.13 mg·g-1。其中,Ⅰ30 ℃,4 hⅡ60 ℃干制样品中所含二氢丹参酮及丹参酮Ⅰ含量最高,隐丹参酮及丹参酮ⅡA含量最高的样品为Ⅰ30 ℃,6 hⅡ60 ℃干制工艺。
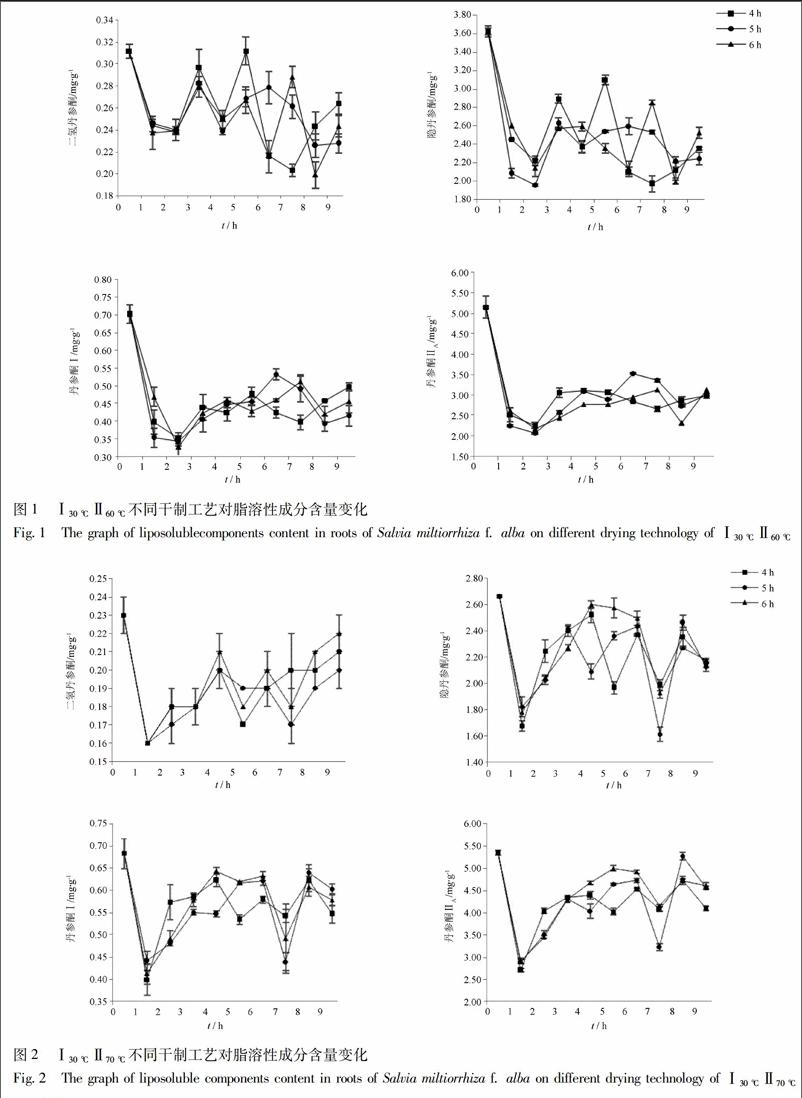
3.1.2 Ⅰ30 ℃Ⅱ70 ℃不同干制工艺对脂溶性成分的影响 采用低温30 ℃分别烘干4,5,6 h高温70 ℃的变温干制对白花丹参脂溶性成分的影响见图2。鲜样中二氢丹参酮、隐丹参酮、丹参酮Ⅰ及丹参酮ⅡA质量分数分别为0.23,2.6,0.67,5.45 mg·g-1,变温干制过程中白花丹参的脂溶性成分含量呈现先下降后上升的趋势,干制至恒重时其质量分数最高分别为0.22,2.18,0.60,4.61 mg·g-1,即Ⅰ30 ℃,6 hⅡ70 ℃干制样品二氢丹参酮、隐丹参酮、丹参酮ⅡA的含量最高,Ⅰ30 ℃,5 hⅡ70 ℃变温干制中丹参酮Ⅰ含量最高。
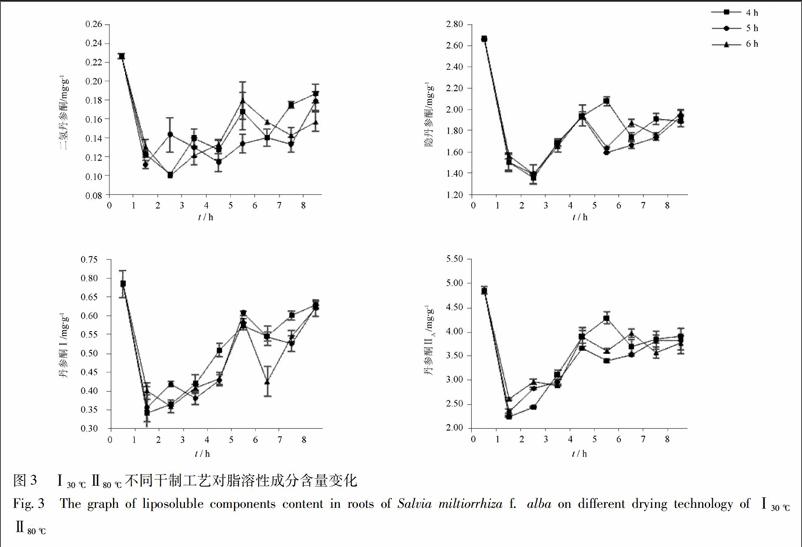
3.1.3 Ⅰ30 ℃Ⅱ80 ℃不同干制工艺对脂溶性成分的影响 采用低温30 ℃分别烘干4,5,6 h高温80 ℃的变温干制对白花丹参脂溶性成分含量呈现先下降后上升的变化规律,见图3。未干制的白花丹参中二氢丹参酮、隐丹参酮、丹参酮Ⅰ及丹参酮ⅡA质量分数分别为0.23,2.7,0.67,4.86 mg·g-1,采用3种变温干制加工后其质量分数最高分别为0.22,1.97,0.63,3.97 mg·g-1。二氢丹参酮及丹参酮Ⅰ含量最高为Ⅰ30 ℃,4 hⅡ80 ℃变温干制样品,Ⅰ30 ℃,6 hⅡ80 ℃干制工艺白花丹参中隐丹参酮及丹参酮ⅡA含量最高。
3.1.4 Ⅰ40 ℃Ⅱ60 ℃不同干制工艺对脂溶性成分的影响 低温40 ℃分别烘干4,5,6 h高温60 ℃的变温干制对白花丹参中脂溶性成分影响较大,见图4。干制初始样品中二氢丹参酮、隐丹参酮、丹参酮Ⅰ及丹参酮ⅡA质量分数分别为0.21,2.56,0.77,5.00 mg·g-1,3种变温干制工艺完成时其对应最高质量分数分别为0.19,2.32,0.61,3.59 mg·g-1,其中Ⅰ40 ℃,6 hⅡ60 ℃干制的白花丹参中脂溶性成分含量最高。
3.1.5 Ⅰ40 ℃Ⅱ70 ℃不同干制工艺对脂溶性成分的影响 低温40 ℃分别干制4,5,6 h高温70 ℃变温干制对白花丹参脂溶性成分的影响见图5。初始样品中二氢丹参酮、隐丹参酮、丹参酮Ⅰ及丹参酮ⅡA质量分数分别为0.25,2.29,0.77,5.30 mg·g-1,变温干制工艺完成时其对应最高质量分数分别为0.17,1.86,0.46,3.76 mg·g-1,其中Ⅰ40 ℃,4 hⅡ70 ℃干制的白花丹参中二氢丹参酮、丹参酮Ⅰ及丹参酮ⅡA含量最高,隐丹参酮含量最高为Ⅰ40 ℃,6 hⅡ70 ℃变温干制的样品。
3.1.6 Ⅰ40 ℃Ⅱ80 ℃不同干制工艺对脂溶性成分的影响 低温40 ℃分别干制4,5,6 h高温80 ℃变温干制对白花丹参脂溶性成分影响呈现出先下降后上升的趋势,见图6。鲜样中二氢丹参酮、隐丹参酮、丹参酮Ⅰ及丹参酮ⅡA质量分数分别为0.34,2.70,0.70,5.80 mg·g-1,变温干制完成时其对应最高质量分数分别为0.35,2.76,0.78,4.47 mg·g-1,其中Ⅰ40 ℃,6 hⅡ80 ℃干制的白花丹参中脂溶性成分含量最高。
3.2 变温干制对白花丹参水溶性成分的影响
3.2.1 Ⅰ30 ℃Ⅱ60 ℃不同干制工艺对水溶性成分的影响 白花丹参鲜样中迷迭香酸及丹酚酸B质量分数分别为1.00,20 mg·g-1,在3个干制工艺中迷迭香酸及丹酚酸B的含量逐漸上升,最高含量值均出现在干制9 h后分别为2.85,41.78 mg·g-1,见图7。其中Ⅰ30 ℃,6 hⅡ60 ℃变温干制白花丹参中水溶性成分含量最高,迷迭香酸的含量比前2个干制工艺的样品增加4.4%,丹酚酸B的含量分别比前2个干制工艺增加了7.85%,1.63%。
3.2.2 Ⅰ30 ℃Ⅱ70 ℃不同干制工艺对水溶性成分的影响 低温30 ℃分别干制4,5,6 h高温70 ℃对白花丹参水溶性成分的影响见图8,3种变温干制中水溶性成分含量均呈现上升的趋势。0 h样品中迷迭香酸及丹酚酸B的质量分数分别为1.20,24.00 mg·g-1,其中Ⅰ30 ℃,6 hⅡ70 ℃变温干制的白花丹参水溶性成分为最高,迷迭香酸及丹酚酸B的最高质量分数在干制终点时分别为3.83,55.44 mg·g-1,迷迭香酸分别比前2个干制工艺增加23.95%,11.01%,丹酚酸B的含量比2个干制工艺分别增加了11.21%,0.73%。
3.2.3 Ⅰ30 ℃Ⅱ80 ℃不同干制工艺对水溶性成分的影响 低温30 ℃分别干制4,5,6 h高温80 ℃的变温干制有利于白花丹参中水溶性成分的积累,见图9。鲜样品中迷迭香酸及丹酚酸B 的质量分数分别是1.20,24.00 mg·g-1,迷迭香酸在变温1 h后质量分数最高为2.24 mg·g-1,干制完成后迷迭香酸及丹酚酸B的最高质量分数分别为1.87,35.20 mg·g-1,均出现在Ⅰ30 ℃,6 hⅡ80 ℃变温干制样品中。
3.2.4 Ⅰ40 ℃Ⅱ60 ℃不同干制工艺对水溶性成分的影响 低温40 ℃分别干制4,5,6 h高温60 ℃对白花丹参中水溶性成分影响见图10。0 h样品中迷迭香酸及丹酚酸B的质量分数分别为0.80,17.00 mg·g-1,3种变温干制工艺结束时水溶性成分均上升,迷迭香酸及丹酚酸B的最高含量均出现在干制终点,分别为2.37,32.11 mg·g-1,为Ⅰ40 ℃,6 hⅡ60 ℃干制样品。
3.2.5 Ⅰ40 ℃Ⅱ70 ℃不同干制工艺对水溶性成分的影响 低温40 ℃分别干制4,5,6 h高温70 ℃干制对白花丹参水溶性成分见图11,迷迭香酸及丹酚酸B均呈现出先上升后下降再上升的趋势。白花丹参鲜样中迷迭香酸及丹酚酸B的初始质量分数分别为1.00,18.00 mg·g-1,其中水溶性成分含量的最高点均出现在变温干制后1 h,至恒重时Ⅰ40 ℃,6 hⅡ70 ℃变温干制的样品中迷迭香酸及丹酚酸B含量高于另2种干制样品,分别为3.10,33.97 mg·g-1。
3.2.6 Ⅰ40 ℃Ⅱ80 ℃不同干制工艺对水溶性成分的影响 迷迭香酸及丹酚酸B在变温干制初始时质量分数分别为1.00,18.00 mg·g-1,见图12。变温干制中白花丹参水溶性成分含量的最高值均出现在变温后1 h,其中迷迭香酸及丹酚酸B 的质量分数分别为3.09,41.05 mg·g-1,而干制至恒重时其相应最高质量分数则分别为3.05,35.81 mg·g-1。迷迭香酸含量最高为Ⅰ40 ℃,5 hⅡ80 ℃干制样品,Ⅰ40 ℃,6 hⅡ80 ℃干制样品中丹酚酸B含量最高。
3.3 阴干对白花丹参脂溶性及水溶性成分含量的影响
为对比变温干制与传统阴干工艺对白花丹参药材品质的影响,本实验分别测定了阴干后白花丹参样品中脂溶性及水溶性成分的含量,见图13。阴干后脂溶性成分二氢丹参酮、隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA的质量分数分别为0.34,1.9,0.58,7.99 mg·g-1。迷迭香酸和丹酚酸B的含量变化都是先降低后升高,在阴干终点的质量分数分别为2.36,26.51 mg·g-1。
4 讨论
产地加工是中药材生产中不可缺少的环节,传统干燥往往周期长、费时费力、受环境影响大,且无法实现加工方法的统一和标准,导致中药材品质无法保障[18]。而在丹参传统干燥工艺中多采用户外阴干的方式,成本较低,但需要晾晒场地大、干燥时间长、易受天气影响,且易发霉、变黄、变质,遭受各种污染,从而影响药材的质量[19-20]。低温干制有利于白花丹参中活性成分的生成,本实验采用变温干制的方式探究白花丹参的干制工艺,对低温烘干的条件进行设计,第一阶段选择30,40 ℃ 2个较低的温度,研究活性成分的生成和变化规律,筛选最佳前期干制温度和干制时间;第二阶段在稳定丹参活性成分的前提下快速使药材干制,极大的提高了干燥速率。
通过实验表明,采用不同工艺进行变温干制时,白花丹参有效成分含量变化较大。第一阶段采用低温干制时,二氢丹参酮、隐丹参酮、丹参酮I和丹参酮ⅡA的含量均表现出先升高后降低的趨势,且变温1 h脂溶性成分含量出现小幅度的上升。本实验发现,当采用Ⅰ40 ℃,6 hⅡ80 ℃干制3 h的工艺时,丹参中4种脂溶性成分二氢丹参酮、隐丹参酮、丹参酮I和丹参酮ⅡA的含量均为最高,其中二氢丹参酮、隐丹参酮和丹参酮I的含量分别比阴干时增加2.9%(P>0.05),45.3%(P<0.05)和34.5%(P<0.05),丹参酮ⅡA的含量减少44.1%(P<0.05)。对于白花丹参中水溶性成分的研究表明,当采用Ⅰ30 ℃,6 hⅡ70 ℃干制3 h的工艺时,丹参中迷迭香酸和丹酚酸B的含量最高,分别比阴干时增加62.3%(P<0.05),109.1%(P<0.05)。因此最终选择白花丹参最佳的变温干制工艺为Ⅰ30 ℃,6 hⅡ70 ℃干制3 h,脂溶性含量隐丹参酮、丹参酮Ⅰ分别比阴干时增加42.1%(P<0.05),1.2%(P>0.05);但相对于传统干制工艺,变温干制大大缩短了干制时间,提高了干制效率。且随着干制工艺的进行,白花丹参水溶性成分尤其是丹酚酸B的含量处于一个动态增加的变化过程中,进一步说明丹参的水溶性成分是在干制过程中随着水分的耗散而生成的,进而证实了丹参根部药材在水分的散失过程中仍然在进行生理活动的这一理论[21]。采用变温干制对白花丹参进行干燥,可以最大程度的提高白花丹参有效成分的含量,缩短丹参干燥时间,改善干燥过程中易受天气影响的缺陷,为丹参产业化干制工艺提供理论依据。
[参考文献]
[1] 中国药典. 一部[S]. 2015: 76.
[2] 山东省药品监督管理局. 山东中药材标准[S]. 济南:山东友谊出版社, 2002: 66.
[3] 李允尧, 赵华英, 陈沪宁,等. 山东省白花丹参的植物资源[J]. 中药材, 2000, 23(2): 69.
[4] 陈力, 李秀兰. 白花丹参同源四倍体的诱导与鉴定[J]. 中草药, 2009, 40(12):1995.
[5] 杭亮, 王俊儒, 杨东风,等. 紫花丹参和白花丹参不同部位有效成分的分布特征[J]. 西北农林科技大学学报:自然科学版, 2008, 36(12): 217.
[6] 徐翠红, 舒志明, 王研,等. 紫花丹参和白花丹参不同器官主要药用成分积累规律研究[J]. 时珍国医国药, 2010, 21(9): 2129.
[7] 张琳琳, 宋志前, 王淳,等. 白花丹参及其提取物中总丹酚酸含量测定方法研究[J]. 中国实验方剂学杂志, 2014, 20(6): 86.
[8] 张琳琳, 王淳, 宋志前,等. HPLC同时测定白花丹参中丹参酮ⅡA、隐丹参酮、丹参酮Ⅰ和二氢丹参酮Ⅰ的含量[J]. 中国实验方剂学杂志, 2015, 21(6):62.
[9] 刘伟, 魏莹莹, 孙鹏,等. 须根自然腐解对白花丹参生长及其活性成分含量的影响[J]. 中国中药杂志, 2015, 40(13): 2548.
[10] 齐永秀, 高允生, 夏作理,等. 白花丹参不同部位微量元素分析比较[J]. 微量元素与健康研究, 2004, 21(1):20.
[11] 赵润怀, 段金廒, 高振江,等. 中药材产地加工过程传统与现代干燥技术方法的分析评价[J]. 中国现代中药, 2013, 15(12): 1026.
[12] 李嘉, 黄瑞松, 黄建猷, 等. 不同干制方法对喜树果中喜树碱含量的影响[J]. 广西医学, 2006, 28(11): 1699.
[13] 陈艺文, 于生, 丁安伟, 等. 荆芥不同干制加工方法药材质量变化研究[J]. 广州化工, 2010, 38(5): 102.
[14] 吴发明, 张芳芳, 李敏, 等. 川麦冬产地干制方法综合评价研究[J].中药材, 2015, 38(7): 1400.
[15] 侯晓杰, 李玮, 张建锋, 等. 加工方法对丹参中隐丹参酮及丹参酮ⅡA的影响[J]. 贵州农业科学, 2014, 42(9): 190.
[16] 姚斌, 张绪坤, 温祥东,等. 国内外农产品变温干燥研究进展[J]. 食品科技, 2015(7): 94.
[17] 孫洁, 王晓, 周洁,等. 变温干燥对良种金银花活性成分含量的影响[J]. 中华中医药杂志, 2014(10): 3302.
[18] 赵润怀, 段金廒, 高振江, 等. 中药材产地加工过程传统与现代干燥技术方法的分析评价[J]. 中国现代中药, 2013, 15(12): 1026.
[19] 张薇, 邹兆重, 刘慧珍, 等. 微波干燥丹参药材及其质量评价研究[J]. 中国中医药信息杂志, 2010, 17(12): 36.
[20] 范开, 王征, 黄松, 等. 不同干燥方式对丹参品质的影响[J]. 天津中医药, 2012, 29(4): 389.
[21] Li X B, Wang W, Zhou G J, et al. Production of salvianolic acid B in roots of Salvia miltiorrhiza (Danshen) during the post-harvest drying process[J]. Molecules, 2012, 17: 2388.
[责任编辑 孔晶晶]

