苦豆子遗传转化体系建立及SaLDC启动子缺失分析
陆姗姗+孟祥善+李娟+杨毅+刘萍+刘妍

[摘要] 药用植物遗传转化体系的建立对其功能基因研究具有重要意义,该研究在已有苦豆子再生体系的基础上,对农杆菌菌液浓度、农杆菌侵染时间、农杆菌与苦豆子愈伤组织的共培养时间、愈伤组织预培养时间、乙酰丁香酮添加方式和乙酰丁香酮浓度6个遗传转化因子进行优化,结果表明在预培养15 d的苦豆子愈伤组织中农杆菌菌液浓度A600为0.9、侵染时间15 min、农杆菌与愈伤组织共培养48 h、并在侵染液中添加AS 200 μmol·L-1时,GUS瞬时转化效率高达83.33%。以苦豆子基因组DNA为模板克隆获得SaLDC上游1 260 bp的启动子序列(GenBank登录号KY038928),将不同长度(310,594,765,924,1 260 bp)的启动子缺失片段分别与GUS报告基因融合,构建的植物表达载体经农杆菌介导转化苦豆子愈伤组织,GUS瞬时表达结果显示,5个不同长度的SaLDC启动子片段均可驱动GUS在苦豆子愈伤组织中的表达,表明克隆所得的SaLDC启动子具有启动活性,以310 bp的片段启动活性最强,为进一步分析该启动子功能奠定了基础。
[关键词] 苦豆子; 赖氨酸脱羧酶(LDC); 启动子基因; GUS瞬时表达; 功能分析
[Abstract] Establishing the genetic transformation system of medicinal plant is important to study their functional genes. Based on the established regeneration system of Sophra alopecuroides, 6 factors of genetic transformation were optimized, that was the concentration of Agrobacterium tumefaciens, the infection time, the co-cultivation time of agrobacterium tumefaciensand S.alopecuroides callus, the preculture time of S.alopecuroides callus, the adding method ofacetosyringone (AS) and the concentration of AS, respectively. The results showed that a maximum genetic transformation efficiency of 83.33% was achieved with 15d-precultured of S.alopecuroides callus, which was infected by A600=0.9 A. tumefaciens for 15 minutes and then co-cultivated for 48 hours with 200 μmol·L-1AS. The promoter sequence (1 260 bp) of upstream SaLDC was cloned from S.alopecuroides genomic DNA (gene bank accession number: KY038928). The deletion fragment of SaLDC promoter with different length (310,594,765,924,1 260 bp) were ligated with the GUS reporter gene to form five plant expression vectors named P310,P594,P765,P924,P1260, which were then transferred into S.alopecuroides callus. The GUS transient expression showed that all 5 different deletion fragment of SaLDC promoter can drive the GUS gene expression in S. alopecuroides callus. The SaLDC promoter we cloned has high promoter activity, and they may facilitate its function analysis in the future.
[Key words] Sophra alopecuroides; lysine decarboxylase (LDC); promoter gene; GUS transient expression; function analysis
苦豆子Sophra alopecuroides L.别名苦豆根、苦甘草和欧苦参等,是豆科槐属多年生草本植物,广泛分布于宁夏、新疆、内蒙古、甘肃、西藏等荒漠、半荒漠和草原边缘地带[1]。苦豆子地下根部粗壮且多侧根,加之其较强的耐旱性、耐盐碱和抗风沙等性能,在西北地区的生态环境中有着重要的保护作用[2]。苦豆子也是我国西北地区重要的药用植物,具有抗肿瘤、抗菌消炎、止痛杀虫、通经活血等功效[3-4],其中氧化苦参碱(oxymatrine,OMA)(又称苦参素)在治疗慢性乙型病毒性肝炎、苦参碱(matrine,MA)在治疗妇科炎症中均有很好的疗效[5],此外,苦参碱生物农药由于具有对人畜毒性低等特点,在我国也有广泛的应用[6]。
OMA和MA属于喹诺里西啶类生物碱(quinolizidine Alkaloids,QAs)[7],QAs是赖氨酸在赖氨酸脱羧酶作用下脱羧产生的戊二胺(尸胺)经过一系列的生化代谢而成[8]。赖氨酸脱羧酶(lysine decarboxylase,LDC)作为QAs生物合成途径的第一个关键酶[9],在OMA和MA生物合成过程中有着至关重要的作用。杨毅等[10]克隆获得了苦豆子SaLDC基因,并發现苦豆子SaLDC的表达和OMA的积累均受干旱胁迫的影响,且基因的表达量与OMA的积累呈正相关关系。逯明辉等[11]利用cDNA-AFLP技术从耐冷性强的黄瓜中获得了132 bp长的LDC部分片段,推测该基因可能在提高种子低温发芽力方面起重要作用。
在植物遗传转化过程中,GUS瞬时表达常被用于快速确定和优化各种影响转化效率的因素,继而建立高效遗传转化体系[12]。启动子在基因转录起始和转录频率的调控中有决定性作用,可以控制结构基因的表达起始时间和表达程度的强弱[13],启动子缺失分析是研究启动子及其调控元件功能的一种重要且有效的方法[14]。邵克强等[15]通过5′端缺失系统研究了水稻Pib启动子中分子元件YTCANTYY的拷贝数与启动子启动活性和暗诱导性的关系。Ren等[16]通过对水稻OsMT2b启动子的缺失分析明确该启动子从-21~-212是最短的活性区域。本研究在已有苦豆子再生体系的基础上,研究影响其遗传转化效率的各种因素,构建SaLDC不同启动子缺失片段与报告基因GUS的重组表达载体,探讨不同启动子缺失片段在苦豆子愈伤组织中的瞬时表达水平,以期对苦豆子SaLDC启动子的功能进行系统研究,为启动子的顺式作用元件与相关转录因子的互作研究提供依据,也为今后详细研究SaLDC在OMA生物合成途径中的地位奠定基础。
1 材料
苦豆子植株由宁夏大学农学院李晓伟副教授鉴定为S. alopecuroides,种子采于宁夏永宁县杨和乡(106.14°E,38.14°N),凭证标本号为103,室温风干后脱粒并精选。
根癌农杆菌Agrobacterium tumefaciens EHA 105和pBI121质粒载体由本实验室保存;Taq DNA聚合酶购自TaKaRa生物工程有限公司;克隆载体pGEM-T1simple、DNA胶回收试剂盒和GUS组织化学染色底物5-溴-4-氯-3-吲哚-β-D-葡萄糖苷酸(5-bromo-4-chloro-3-indolyl-β-D-glucuronide,X-Gluc)购自生工生物工程(上海)股份有限公司;质粒提取试剂盒购自北京天根生化科技有限公司;T4DNA连接酶和限制性内切酶HindⅢ,BamHⅠ均购自NEW ENGLAND生物工程有限公司;所有引物均由生工生物工程(上海)股份有限公司合成,其他试剂均为进口或国产分析纯。
2 方法
2.1 苦豆子子叶节愈伤组织的获得
挑选洁净、饱满、大小一致的苦豆子种子去硬实,无菌处理后接种于MS基本培养基上使其发芽。6 d后选取生长健壮、未展开子叶的无菌苗切取子叶节(离上胚轴基部和下胚轴各约3 mm),沿子叶下胚轴垂直剖开,刮去已长出的腋芽,纵切面朝下接种于MS+0.5 mg·L-12,4-D+0.5 mg·L-1 6-BA的诱导培养基上,培养温度(28±1)℃,16 h/8 h光/暗體系,光照1 200~1 600 lx。
2.2 农杆菌介导的苦豆子瞬时转化体系建立
分别对苦豆子愈伤组织的预培养时间、农杆菌(含pBI121质粒)侵染时间、侵染浓度、愈伤组织与农杆菌的共培养时间、乙酰丁香酮(AS)添加方式及浓度6个因素进行研究。所有因子均按单一因素进行优化,以报告基因GUS瞬时表达率的高低反映各因子对转化效率的影响(GUS瞬时表达率以50%以上有靛蓝色反应的外植体数占被检测外植体总数的百分数计),每处理20个外植体,3次重复,得到最佳农杆菌介导的苦豆子瞬时转化体系。
2.3 不同长度的启动子片段获得及植物表达载体构建
利用Primer Premier 5.0软件设计SaLDC启动子5个不同长度片段的上游引物(P1,P2,P3,P4,P5)和1个共用下游引物(R)(表1),以苦豆子基因组DNA为模板扩增不同长度的启动子序列。PCR反应体系(20.0 μL):DNA模板2.0 μL,10×Buffer2.0 μL,dNTP(2.5 mmol·L-1)3.2 μL,上下游引物(10.0 μmol·L-1)各1 μL,Taq DNA polymerase (5.0 U·μL-1)0.2 μL,dd H2O 10.4 μL;PCR反应程序:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 40 s,72 ℃2 min;36个循环;72 ℃ 10 min;4 ℃保存。
目标片段经1.2%琼脂糖凝胶电泳检测、回收纯化后分别连接至pGEM-T1 simple载体,热激转化大肠杆菌TOP10,蓝白斑、氨苄青霉素抗性平板筛选出阳性克隆,送生工生物工程(上海)股份有限公司测序。
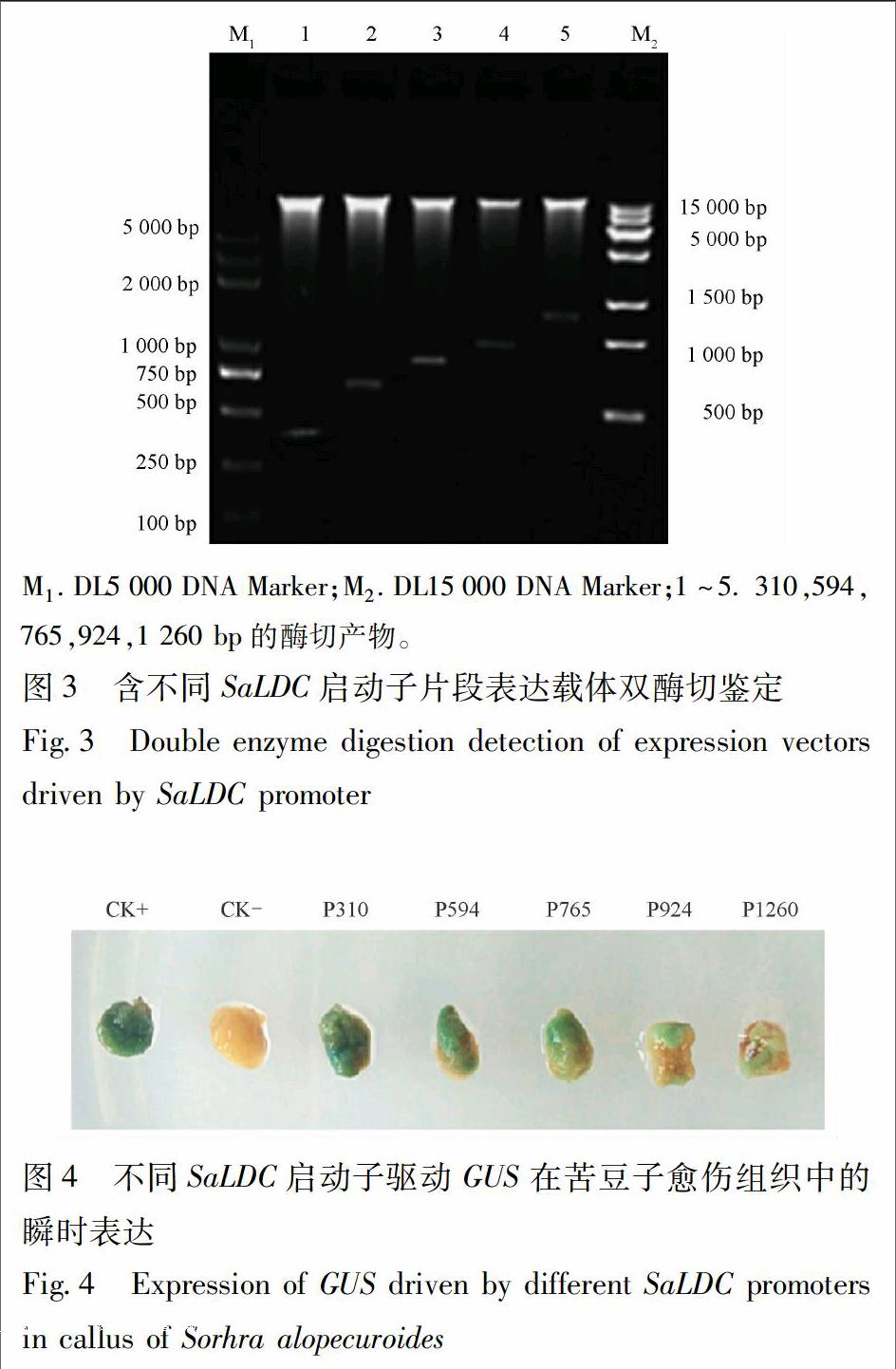
分别提取含苦豆子不同长度启动子片段的质粒DNA,用HindⅢ,BamHⅠ进行双酶切并回收目的片段,同时双酶切pBI121质粒,用目的片段代替其中35S启动子,T4 DNA连接酶连接后得到具有不同长度SaLDC启动子片段的重组表达载体,依次命名为P310,P594,P765,P924,P1260(图1)。表达载体导入大肠杆菌TOP10,利用pBI121中卡那霉素抗性基因nptⅡ进行重组质粒阳性克隆筛选,选取阳性菌株提取质粒并进行双酶切验证。
2.4 农杆菌介导表达载体瞬时转化苦豆子愈伤组织
构建好的植物表达载体分别转化至农杆菌EHA105,Kan筛选,阳性单克隆于含Kan(50 mg·L-1)的LB液体培养基中28 ℃培养至A600 = 0.8~1.5,菌体用侵染液(1/2MS+5%蔗糖+200 μmol·L-1 AS)悬浮至A600 =0.9,按试验设计转化已培养15 d的苦豆子愈伤15 min,无菌滤纸吸掉愈伤表面多余的菌液后接种于诱导培养基中,26 ℃黑暗共培养48 h经无菌水清洗、吸干水分,一部分用于GUS组织化学染色,另一部分用500 mg·L-1头孢霉素(Cef)水溶液清洗后,转MS+0.1 mg·L-1NAA+1.25 mg·L-1 6-BA+500 mg·L-1Cef分化培养基上继续脱菌分化培养。每处理10块外植体,重复3次,以非转基因苦豆子愈伤为阴性对照(CK-),CaMV35S启动子驱动GUS的pBI121转化苦豆子愈伤作为阳性对照(CK+)。
2.5 苦豆子外植体GUS组织化学染色
经农杆菌侵染或未侵染的苦豆子外植体或愈伤用GUS组织化学染色液进行染色,37 ℃过夜,75%乙醇脱色,期间更换数次直至洗脱液无色为止,仔细观察、统计染色情况并拍照。染色液组成:50 mmol·L-1磷酸钠缓冲液(pH 7.0),50 mmol·L-1铁氰化钾,50 mmol·L-1亚铁氰化钾,0.1 mol·L-1 Na2EDTA,1 g·L-1X-Gluc。
2.6 统计分析
利用DPS 6.0对所有数据进行方差分析。
3 结果与分析
3.1 农杆菌介导的苦豆子瞬时转化体系的建立和优化
3.1.1 农杆菌菌液浓度对瞬时转化的影响 将预培养15 d的苦豆子愈伤,分别在菌液浓度A600为0.3,0.6,0.9,1.2的农杆菌菌液中侵染15 min,黑暗共培养48 h,结果表明菌液浓度对转化效率具有显著影响(P<0.05)。在A600为0.3~0.9时,菌液浓度越大瞬时转化效率越高,菌液浓度A600=0.3,GUS瞬时表达率仅为23.33%,A600 =0.6~0.9时,瞬时表达率都在60.00%以上(表2),但当菌液浓度A600 =1.2时,愈伤组织经过48 h共培养后基本被农杆菌覆盖,整体褐化严重、软化并且丧失活性,转化效率降低,GUS瞬时表达率只有30.00%(图2A)。
3.1.2 农杆菌侵染时间对瞬时转化的影响 用A600 =0.9的農杆菌菌液对预培养15 d的苦豆子愈伤组织分别侵染5,10,15,20 min,黑暗共培养48 h,结果显示,在5~15 min随着侵染时间的延长,GUS瞬时表达率极显著增加(P<0.01),侵染15 min时,愈伤长势良好,且表达率达66.67%,极显著高于其他侵染时间(表2),侵染20 min共培养48 h后,发现有大量愈伤组织出现软腐症状,后续培养变黑死亡(图2B)。
3.1.3 共培养时间对瞬时转化的影响 农杆菌与愈伤组织的共培养过程是外源基因导入受体细胞的关键时期,将预培养15 d的苦豆子愈伤经A600 =0.9的农杆菌侵染15 min,分别进行24,48,72 h的共培养后做除菌处理。共培养24 h,农杆菌生长量较低,愈伤表面肉眼不可见农杆菌菌落,对愈伤未造成大面积的侵染,GUS瞬时表达率仅为36.67%;共培养48 h,愈伤表面可见到农杆菌菌落,愈伤开始褐化,但此时遗传转化效率较高,GUS瞬时表达率达66.67%;共培养72 h,愈伤褐化严重。研究发现,共培养超过48 h后,由于农杆菌的过渡繁殖,阻断了愈伤组织细胞对营养成分的吸收,从而抑制细胞的正常生长,使得愈伤褐变、枯萎,死亡率升高,导致瞬时表达率下降为18.33%(图2C,表2)。
3.1.4 子叶节预培养时间对瞬时转化的影响 根据本实验室苦豆子愈伤组织诱导结果可知,苦豆子子叶节经2~3 d的培养后膨胀,4~10 d开始形成愈伤,但长势缓慢,10~15 d愈伤因快速生长而膨大,20 d后愈伤停止生长,23 d后愈伤褐化。本研究将子叶节分别进行0,2,10,15,20,23 d的预培养,用A600 =0.9的含pBI121质粒的农杆菌EHA105侵染15 min,黑暗共培养48 h。研究表明,苦豆子子叶节的预培养时间显著影响转化效率,预培养0~2 d,子叶节才开始产生愈伤,农杆菌的侵染效率低;预培养10~15 d由于子叶节正处于愈伤增生期,愈伤组织细胞分裂速度快,结构疏松,细胞壁薄,有利于外源基因的导入,统计显示,GUS瞬时表达率可达到60.00%以上(表2),与其他4个预培养时间有极显著差异(P<0.01);随着预培养天数的增加子叶节愈伤褐化严重,转化效率急剧下降(图2D)。
3.1.5 AS对瞬时转化的影响 农杆菌对植物酚类化合物具有趋化性,它可以使农杆菌Ti质粒上的Vir活化和表达[17]。本研究分别向共培养基和侵染液中添加浓度梯度为100,200,300 μmol·L-1的AS,以不添加AS为对照。结果表明在共培养基内添加不同浓度AS对苦豆子愈伤转化效率没有影响(图2E),各浓度梯度间无显著性差异(表2);但在侵染液中添加一定浓度的AS可以有效提高农杆菌对愈伤的转化效率,其中AS浓度为200 μmol·L-1时GUS瞬时表达率最高为83.33%,显著高于其他各浓度的表达效率(表2),且染色覆盖率都较高,单块愈伤染色覆盖率可达90%以上(图2F),但当AS浓度为300 μmol·L-1时,转化效率极显著下降(P<0.01)。
3.2 不同长度的SaLDC启动子缺失片段分析
3.2.1 不同长度启动子片段的获得及植物表达载体构建 以苦豆子基因组DNA为模板,利用设计的5条上游引物和1条下游引物分别进行PCR扩增,获得310,594,765,924,1 260 bp 5条长度不同的启动子片段,依次定向替换pBI121载体上的CaMV35S启动子,连接并转化到大肠杆菌TOP10,菌液PCR检测后双酶切验证,已成功获得5个启动子片段的植物表达载体(P310,P594,P765,P924,P1260,图3)。
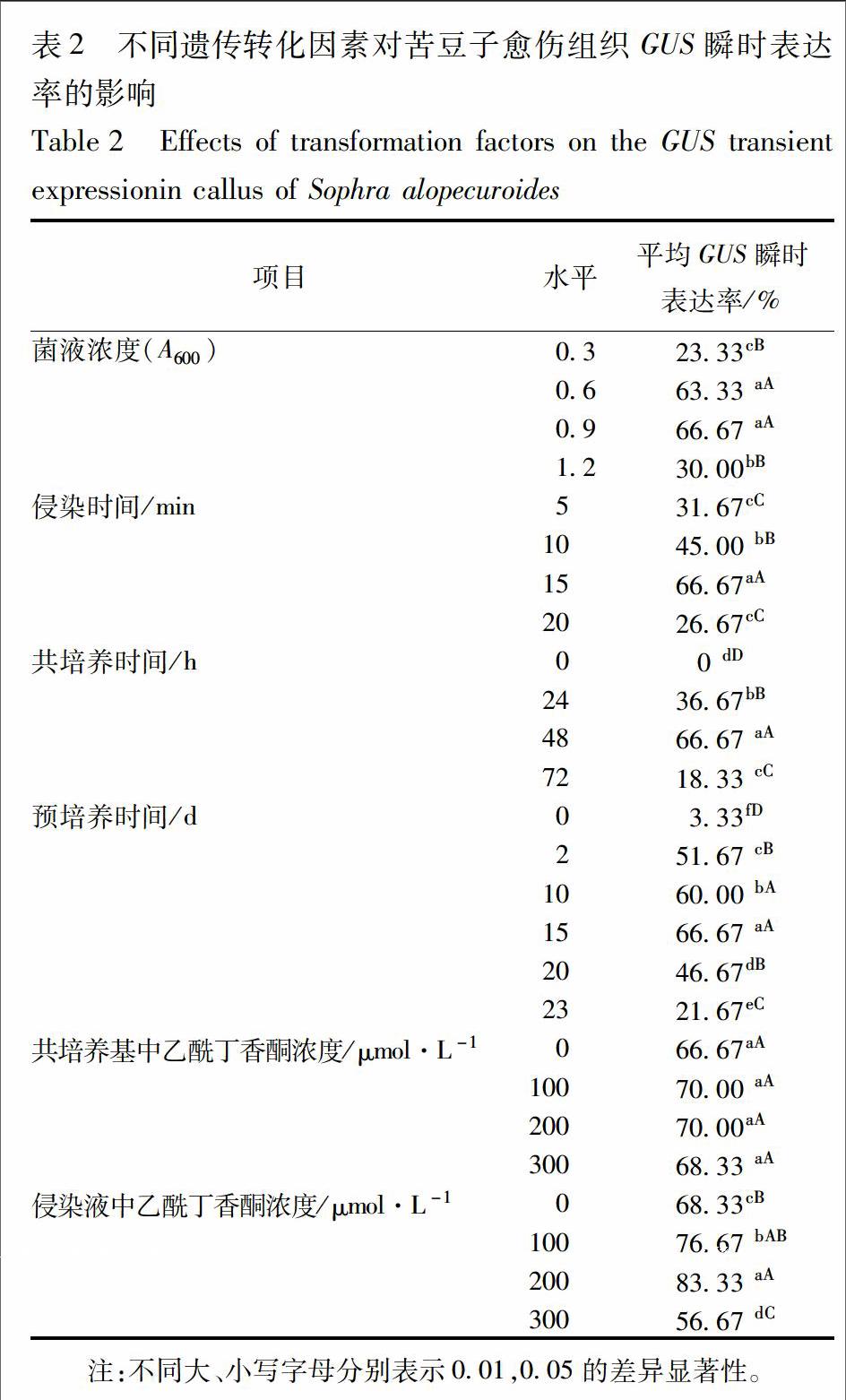
3.2.2 不同长度SaLDC启动子片段在苦豆子愈伤中的瞬时表达 将构建好的5个植物表达载体(P310,P594,P765,P924,P1260)以及阳性对照质粒通过农杆菌介导分别转化苦豆子愈伤组织。通过GUS组织化学染色发现,5个不同长度的SaLDC启动子序列都能驱动GUS的表达,说明这5个启动子序列均具有启动必备的作用元件活性,能驱使下游基因表达,但观察发现表达水平有明显差异,以310,594 bp的启动子片段GUS瞬时表达强度最高,随着SaLDC启动子片段长度的增加,GUS瞬时表达强度逐渐下降,924,1 260 bp的启动子片段瞬时表达强度都明显减弱,非转化愈伤组织中无GUS表达(图4),5个启动子片段的GUS瞬时表达率分别为73.33%,66.67%,60.00%,43.33%,40.00%。P310,P594的GUS瞬时表达率均极显著高于P924,P1260(P<0.01)。
4 讨论
遗传转化是细菌与植物相互作用的过程,对外植体进行预培养,严格控制农杆菌侵染时间、农杆菌与愈伤组织的共培养时间,选择合适的农杆菌浓度以及添加乙酰丁香酮等酚类物质均可有效提高遗传转化的效率[18-19]。宿主细胞的生理状态和发育过程对遗传转化的结果有明显影响,只有当其处在对农杆菌良好的感受态时,才能有效接受外源DNA,启动遗传转化。培养15 d的苦豆子愈伤生长旺盛,处于增生期,GUS瞬时表达率最高,这与Collado[20]等研究菜豆处于增生期愈伤更有利于遗传转化的结果一致。农杆菌侵染时间和菌液浓度也是影响植物遗传转化效率的重要因素,本研究发现农杆菌菌液浓度A600控制在0.6~0.9,侵染时间为15 min可获得高的瞬时表达率。农杆菌附着后并不能立刻转化植物细胞,只有在创伤部位生存16 h以上的菌株才有此功能[21],但是共培养时间过长,植物细胞易受毒害而死亡,并且导致后续操作中脱菌困难,本研究对苦豆子愈伤和农杆菌共培养48 h既可以得到最高的转化效率,同时又不致使愈伤组织细胞过度受害。
农杆菌Ti质粒的Vir区基因对T-DNA转移起介导作用,它靠植物受伤细胞产生的酚类化合物激活,AS诱导己知所有Vir调节子[22]。多数学者认为在共培养基内添加AS可有效提高GUS瞬时表达率[23-25],但也有研究认为由于不同植物对AS反应的敏感程度不同,共培养基内添加AS对有些植物的遗传转化并不是必不可少的[26]。本研究就AS不同添加方式和添加浓度做了一系列探索,研究发现共培养基内添加AS,GUS瞬时表达率与对照无显著性差异,但在侵染液中添加AS可有效提高瞬時表达率,这可能是在共培养基中添加AS,愈伤组织只能与共培养基接触面的活化农杆菌相接触,而在侵染液中添加AS,侵染过程中农杆菌全方位包裹并附着于愈伤组织,在共培养过程中更有利于表达载体导入愈伤组织,从而使得转化效率显著增加,相似的结论在他人的研究中也有报道[27]。然而添加AS的浓度并不是越高越好,在侵染液中添加300 μmol·L-1的AS,愈伤褐化严重,GUS瞬时表达率降低至56.67%,与添加100~200 μmol·L-1AS的瞬时表达率差异极显著。一方面可能由于高浓度的酚类物质本身使外植体毒害致死,另一方面由于农杆菌介导的外源基因转化是农杆菌菌株与植物细胞之间相互作用的结果,过高浓度的AS将过度诱导Vir的表达,增强了农杆菌侵染活力,使转化的植物细胞受农杆菌毒害而死亡。
在已报道的植物启动子中,大多数均富含A/T序列,这是基因启动子的一个基本特征[28],本研究SaLDC启动子序列中A/T量高达90%,G/C量仅占10%,说明该启动子转录时DNA解旋所需消耗的能量更小[29],GUS瞬时表达显示SaLDC启动子具有较强的转录活性,说明高含量的A/T使得DNA双链结构更易解螺旋从而提高基因的转录效率。
真核基因表达是非常复杂的调控过程,研究基因的启动子调控元件及启动子活性对分析转录起始水平上基因调控具有重要意义,在本研究中,序列分析表明在SaLDC启动子-1~-594区段集中存在大量增强子元件GATA(-489,-287,-235,-119),增强效果叠加,对启动子的活性具有显著增强作用,对SaLDC启动子缺失片段驱动的苦豆子愈伤组织的GUS瞬时表达发现,P310,P594驱动的GUS表达强度较高,也说明此段区域是启动子调控的关键序列部分,预测结果与瞬时表达结果一致;在-806处存在1个抑制子WRKY710S[30],由于该抑制子的存在,减弱了启动子的活性,导致P924,P1260的愈伤组织GUS瞬时表达明显减弱;此外,随着SaLDC启动子自身序列长度的增加,启动子序列中存在的大量顺式作用元件,影响了下游结构基因的表达水平。由于GUS瞬时表达结果只是短暂的高水平的表达,表达水平不长久也不稳定,因此对于SaLDC启动子功能与特性的进一步研究,例如其大量顺式作用元件功能的验证,还需获得稳定表达的转基因株系。
[参考文献]
[1] 中国科学院中国植物志编辑委员会.中国植物志.第40卷[M].北京:科学出版社,1994:80.
[2] 秦学功,元英进.苦豆子生物碱的研究与苦豆子的综合利用[J].中国野生植物资源,2011,19(4):30.
[3] 刘芬,刘洁,陈霞.氧化苦参碱的抗炎作用及其机制[J].吉林大学学报,2005,6(31):728.
[4] 杨巧丽,顾政一,黄华.中药苦豆子的研究进展[J].西北药学杂志,2011,26(3):232.
[5] 张清云,张国荣,尹长安,等.宁夏苦豆子药用植物资源保护与开发利用[J].世界科学技术——中医药现代化,2006,8(1):104.
[6] 高晓原,贝盏临,雷茜,等.宁夏苦豆子资源基本情况及综合开发现状[J].中国野生植物资源,2009,28(2):17.
[7] Bunsupa S,Yamazaki M,Saito K. Quinolizidine alkaloid biosynthesis: recent advances and future prospects[J].Front Plant Sci,2012,3(239): 1.
[8] Tsuda K, Saeki S, Imura S, et al. Studies on the synthesis of matrine. Ⅰ. The total synthesis of nordehydro-α-matrinidine and dehydro-α-matrinidine[J]. J Org Chem,1956,21(12):1481.
[9] Bunsupa S, Katayama K, Ikeura E, et al. Lysine decarboxylase catalyzes the first step of quinolizidine alkaloid biosynthesis and coevolved with alkaloid prAuction in Leguminosae[J]. Plant Cell,2012,24 (3):1202.
[10] 杨毅,陆姗姗,刘萍,等.苦豆子赖氨酸脱羧酶基因克隆与表达分析[J].草业学报,2016,25(8):128.
[11] 逯明辉,李晓明,陈劲枫,等.黄瓜发芽期耐冷性与赖氨酸脱羧酶基因表达[J].中国农业科学,2005,38(12):2492.
[12] Gubba S, Xie Y H, Das A. Regulation of Agrobacterium tumefaciens virulence gene expression:isolation of a mutation that restores WrGD52E function[J]. Mol Plant Microbe In,1995,8(5):788.
[13] 卢荣江,刘迪秋,葛锋,等.三七鲨烯环氧酶基因(SE)启动子的瞬时表达分析[J].植物生理学报,2015,51(4):495.
[14] Iwamoto M, Higo H, Higo K. Strong expression of the rice catalase gene CatB promoter in protoplasts and roots of both a monocot and dicots[J].Plant Physiol Bioch, 2004,42:241.
[15] 邵克强,杨世湖,余丽,等.Pib基因启动子内YTCANTYY暗诱导分子元件功能的转基因验证[J].作物学报, 2008, 34(9): 1667.
[16] Ren Y J, Zhao J. Functional analysis of the rice metallothionein gene OsMT2b promoter in transgenic Arabidopsis plants and rice germinated embryos[J]. Plant Sci, 2009,176:528.
[17] 储俊,许娜,张强,等.农杆菌介导药用百合鳞片遗传转化体系的构建[J].草业学报,2011,20(6):164.
[18] Deo P C, Tyagi A P, Taylor M, et al.Factors affecting somatic embryogenesis and transformation in mAern plant breeding[J]. South Pac J Nat App Sci, 2010,28(10):27.
[19] Kayani W K, Fattahi M, Palazon J, et al. Comprehensive screening of influential factors in the Agrobacterium tumefaciens-mediated transformation of the himalayan elixir: Ajuga bracteosa Wall. ex. Benth[J].J App Res Med Aromatic Plants,2016, 3(4): 151.
[20] Collado R, Caraballoso B, Garcia L R, et al. Agrobacterium-mediated transformation of Phaseolus vulgaris L. using indirect organogenesis[J].Sci Hortic, 2015,195:89.
[21] 王关林, 方宏筠.植物基因工程[M].2版.北京:科学出版社, 2002:388.
[22] Cho H, Winans S C. VirA and VirG activate the Ti plasmid repABC operon, elevating plasmid copy number in response to wound-released chemical signals[J]. Proc Natl Acad Sci USA, 2005,102(41):14843.
[23] Zhang J J,Shi L, Chen H, et al. An efficient Agrobacterium-mediated transformation methA for the edible mushroom Hypsizygus marmoreus[J]. Microbiol Res, 2014, 169: 741.
[24] 楊茹,袁庆华,曹致中,等.农杆菌介导多年生黑麦草遗传转化体系的建立[J].中国草地学报,2010,32(1):26.
[25] Khan S, Fahim N, Singh P,et al. Agrobacterium tumefaciens mediated genetic transformation of Ocimum gratissimum: a medicinally important crop[J].Ind Crop Prod,2015,71:138.
[26] 黄天带,李哲,孙爱花,等.根癌农杆菌介导的橡胶树花药愈伤组织遗传转化体系的建立[J].作物学报,2010, 36(10): 1691.
[27] 姚庆荣,郭运玲,孔华,等.影响根癌农杆菌介导的木薯遗传转化因素分析[J].植物研究,2012,32(2):227.
[28] 杜皓,丁林云,何曼林,等.受多逆境诱导表达的Gh WRKY64基因启动子克隆与功能分析[J].作物学报,2015,41(4):593.
[29] Lam E, Kano-Murakami Y, Gilmartin P, et al. A metal-dependent DNA-binding protein interacts with a constitutive element of a light-responsive promoter[J]. Plant Cell, 1990, 2(9): 857.
[30] 崔同霞,白江平,魏桂民,等.马铃薯SGT3基因表达及其启动子功能分析[J].草业学报,2014,23(2):196.
[责任编辑 吕冬梅]

