骨髓间充质干细胞移植到心肌梗死大鼠对心肝功能的影响
张若青 胡静 王颖
·论著·
骨髓间充质干细胞移植到心肌梗死大鼠对心肝功能的影响
张若青 胡静 王颖
目的 探讨骨髓间充质干细胞(bone marrow mesenchymal stem cells,MSCs)移植到心肌梗死大鼠后在心肝脏器的分布及对其功能的影响。方法 建立心肌梗死大鼠模型,1周后将标记的MSCs通过大鼠舌下静脉注射至体内,细胞移植4周后通过组织学观察其在心肝脏器的分布,并通过心脏超声及血生化检查观察两脏器的功能情况。结果 移植细胞主要集中于心肌梗死区域,且少量迁移至肝脏组织。实验组的心功能指标LVEDD、LVESD、左心室EF、左室FS均明显优于对照组,差异具有统计学意义(P<0.05)。实验组肝功能指标ALT、AST、ALP明显低于对照组,差异具有统计学意义(P<0.05),而2组之间ALB及TBIL并无明显差异(P>0.05)。结论 MSCs经静脉注射可顺利分布于心肌梗死组织改善心脏功能,且可迁移至肝脏组织,可能对肝功能也具有一定的改善作用。
骨髓间充质干细胞;心肌梗死;细胞移植;大鼠
骨髓MSCs是来源于中胚层的一类成体干细胞,具有极强的自我更新及分化能力,在不同条件下可分化为中胚层来源的骨、心肌、脂肪等细胞,还可跨胚层分化为肺、肠、上皮、神经等细胞[1-3]。MSCs还具有可自体获取、培养,无免疫原性等优点,该类细胞的移植能够增加梗死区域的心肌细胞数量并促进心肌细胞再生,增强其活性,已经成为治疗心肌梗死的新兴手段[4,5]。MSCs细胞移植通常通过冠脉注射、静脉注射及心外膜注射等,注射途径直接影响到治疗效果及安全性[6,7]。心外膜注射定位较准确,可使体外培养的细胞准确的进入梗死区域,但其因开胸后才可操作受限制,静脉内注射是可多次、反复进行的无创治疗,其应用价值更大[8,9]。相关研究提示MSCs细胞经心外膜移植后可观察到细胞迁移至肝脾等脏器,本次研究通过对心肌梗死大鼠经静脉注射MSCs细胞,观察其在心脏及肝脏的分布及功能影响。
1 材料与方法
1.1 实验动物及试剂 选用体重范围在180~220 g的SD大鼠[购于上海斯莱克实验动物有限公司,合格证号:SCXK(沪2012-0005)]60只,雄性,混合饲养,5只/笼,自然光照射,室温23℃,湿度45%~55%。DMEM培养基(北京拜尔迪生物技术有限公司),胎牛血清(北京拜尔迪生物技术有限公司),0.25%胰酶(北京拜尔迪生物技术有限公司),超顺磁性氧化铁纳米颗粒(上海交通大学纳米生物医学研究中心)。
1.2 MSCs的分离及培养 取SD大鼠注射苯巴比妥后,无菌条件下取大鼠胫骨、股骨,去除两端,DMEM液冲洗骨髓腔内骨髓,离心后去除沉淀,用含有FBS的DMEM培养液接种于培养瓶中,37℃、5%CO2培养箱中培养,每3天更换一次培养液,细胞融合达70%-80%后用0.25%胰酶进行传代,于培养瓶中继续扩增培养,使用第3代细胞进行移植。
1.3 细胞标记 MSCs细胞标记采用超顺磁性氧化铁颗粒,对第3代细胞融合达50%时,用含400 μg/L多聚左旋赖氨酸及0.2 g/L超顺磁性氧化铁颗粒的培养液进行培养,PBS冲洗后去除未进入细胞的铁离子,0.25%胰酶细化制成细胞悬液,滤去团块及残渣。
1.4 模型建立及细胞移植 对SD大鼠采用10% 0.3 ml/100 g水合氯醛腹腔麻醉,气管插管接呼吸机辅助呼吸,于第4肋间隙开胸,结扎做冠状动脉前降支,确认左室前壁梗死区域出现后关胸。建模3周后,心脏超声检测选择左室射血分数(EF)<60%并左心室缩短分数(FS)<30%的48只大鼠进行随机分组,实验组大鼠将第3代MSCs细胞悬液2 ml经舌下静脉注射,对照组同法注射等量0.9%氯化钠溶液,4周后实验组大鼠存活21只,对照组大鼠存活18只。
1.5 观察指标
1.5.1 组织病理学观察:细胞移植4周后脊椎脱臼法处死大鼠,取心脏、肝脏组织,甲醛固定,制作石蜡包埋切片,普鲁士蓝染色,镜下观察MSCs细胞在心脏及肝脏组织中的分布。
1.5.2 脏器功能检测:取细胞移植4周后处死前大鼠静脉血检测肝功能指标,包括丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、白蛋白(ALB)、总胆红素(TBIL)、碱性磷酸酶(ALP)。对细胞移植后1周、2周、4周大鼠应用Siemens X300超声仪观察左心室舒张末内径(LVEDD)、左心室收缩末内径(LVESD)、左心室EF、左心室FS,并记录移植后4周LVEDD、LVESD、左心室EF及FS进行比较。
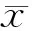
2 结果
2.1 组织病理学观察 进行细胞标记的超顺磁性氧化铁颗粒进入包浆,经普鲁士蓝染色可于镜下观察到MSCs细胞包浆中蓝染颗粒。在心脏组织中,实验组大部分蓝染颗粒聚集于梗死区域组织内,正常心肌组织中蓝染颗粒极少;在肝脏组织中,实验组可见少量蓝染的MSCs细胞迁移至肝脏组织,肝细胞形态规则,未观察到变性及纤维化,对照组仅可见肝细胞水肿,余结构无异常。见图1A~C。


心肌梗死区域正常心肌组织MSCs迁移至肝脏组织
图1 组织病理学结果(普鲁士蓝染色×400)
2.2 心功能检测 检测MSCs细胞移植后各时间点后心肌梗死大鼠心功能发现,实验组大鼠的LVEDD、LVESD、左心室EF、左心室FS均没有明显的变化,而对照组大鼠的LVEDD及LVESD呈现不断增加的趋势,左心室EF及左心室FS逐渐下降。经统计分析细胞移植4周后,实验组的心功能指标LVEDD、LVESD、左心室EF、左心室FS均明显优于对照组,差异有统计学意义(P<0.05)。见表1。

表1 心功能检测 ±s
2.3 肝功能检测 MSCs细胞移植4周后,实验组肝功能指标ALT、AST、ALP明显低于对照组,差异有统计学意义(P<0.05),而2组之间ALB及TBIL并无明显差异(P>0.05)。见表2。

表2 肝功能检测 ±s
3 讨论
MSCs是来源于中胚层的成体干细胞,具有自我更新及分化的功能,其不仅对骨髓中造血干细胞有机械支持作用,还能够分泌多种生长因子支持造血,在不同条件下更可以分化为心肌、上皮细胞等[10-12]。MSCs细胞移植也是近年来众多器官损伤修复的热点,本次研究我们建立了大鼠心肌梗死模型,探讨MSCs细胞移植到损伤心肌组织后的影响。
MSCs细胞移植的途径很多,冠状动脉注射、静脉注射、心外膜注射等,我们选择了创伤小、可反复进行、研究前景更广的静脉注射作为细胞移植途径[13]。本研究发现MSCs细胞移植后逐渐的随着血液循环到达梗死的心肌组织,并参与损伤组织的修复,且在心脏修复的同时,MSCs细胞还可随血液及淋巴循环迁移至体外的较大脏器肝脏。我们选择在建模3周后进行细胞移植,避免了梗死区域早期的炎性反应对移植细胞的威胁[14],有利于MSCs细胞到达并分布于梗死区域组织,细胞移植后MSCs逐渐由血供丰富的正常心肌细胞通过交界处进入梗死区域,最终细胞基本集中与心肌梗死区域,而周边正常心肌组织的MSCs细胞较少,这也证实了MSCs参与了心肌组织损伤的修复,体现了其趋向性[15]。同时MSCs也随着体内循环逐渐分布于肝脏组织中,证实了其具有一定的向肝样细胞分化的能力。有报道发现MSCs也具有分化为肝星状细胞的能力,肝星状细胞可活化生成成纤维细胞,导致肝脏的纤维化[16],但我们在细胞移植4周后的病理组织观察中并未发现明显的细胞形态改变,也未观察到肝细胞的变性及纤维化,因此我们考虑迁移至肝脏的MSCs细胞并未对肝脏产生损害。
本次研究通过心脏超声检测了MSCs细胞移植后对心脏功能的影响。在对细胞移植后不同时间点的心脏超声观察中我们发现移植组大鼠梗死区域的心功能指标并没有进一步恶化的趋势,而对照研究的生理盐水注射组却出现了心功能指标的逐步恶化。究其原因,可能是由于MSCs细胞的修复作用,其可在梗死区域分化形成具收缩力的心肌且重构了心室的梗死组织[17,18],这也证实了MSCs细胞通过静脉注射可大部分顺利分布于心肌梗死区域,对心脏功能具有明显的改善作用。
肝损伤会在心肌梗死后逐渐出现,由于心脏泵功能的衰竭,导致肝脏缺血缺氧,从而出现干细胞的坏死、溶解、水肿[19]。MSCs细胞迁移至肝脏后是否会对既有的肝损伤具有影响,我们也通过肝功能检测进行了研究。细胞移植4周后,细胞移植组大鼠的肝功能指标具有显著的改善,明显优于对照组,这可能是受益于MSCs对心功能的改善作用,缺血缺氧环境得到改善,减轻了肝细胞的损伤,也可能是MSCs细胞横向分化为成熟肝细胞的能力,说明MSCs的迁移定植可能对肝功能具有一定的改善作用[20,21]。
综上,MSCs经静脉注射可顺利分布于心肌梗死组织改善心脏功能,且可迁移至肝脏组织,可能对肝功能也具有一定的改善作用,证实了该治疗方法治疗心肌梗死的有效性及安全性。
1 Bar-Or D,Thomas GW,Rael LT,et al.Low Molecular Weight Fraction of Commercial Human Serum Albumin Induces Morphologic and Transcriptional Changes of Bone Marrow-Derived Mesenchymal Stem Cells.Stem Cells Transl Med,2015,4:945-955.
2 Qi M,Liu W,Ma Y,et al.Spermidine enhances osteogenic differentiation and inhibits adipogenic differentiation of bone marrow-derived mesenchymal stem cells from ovariectomized mice.Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2015,31:787-791.
3 Pan X,Peng L,Yin G.Downregulation of Annexin A1 by short hairpin RNA inhibits the osteogenic differentiation of rat bone marrow-derived mesenchymal stem cells.Int J Mol Med,2015,36:406-414.
4 臧宇,陈伟,徐开林,等.CXCR4基因修饰骨髓间充质干细胞对照射损伤小鼠造血重建的影响.中国实验血液学杂志,2013,21:1261-1265.
5 石良晨,秦峰,王岩松.胶质细胞源性神经营养因子修饰骨髓间充质干细胞移植与传统方法治疗脊髓损伤研究进展.中华实用诊断与治疗杂志,2015,29:423-425.
6 詹菲,徐志伟,黄进,等.左归丸对衰老大鼠骨髓间充质干细胞增殖的影响.中华中医药杂志,2015,30:2518-2521.
7 邱慧,李敏.间充质干细胞向内皮细胞的分化及其在血管组织工程中的应用.生命科学研究,2013,17:458-464.
8 李树仁,王天红,刘东霞,等.自体骨髓间充质干细胞移植对急性心肌梗死后心功能不全家兔基质金属蛋白酶-9的影响.中国老年学杂志,2013,23:5947-5950.
9 唐帮丽,邓丹琪.间充质干细胞移植治疗自身免疫性疾病的进展.临床皮肤科杂志,2013,42:62-66.
10 Zhang YX,Yuan MZ,Cheng L,et al.Treadmill exercise enhances therapeutic potency of transplanted bone mesenchymal stem cells in cerebral ischemic rats via anti-apoptotic effects.BMC Neurosci,2015,16:56.
11 Ni S,Wang D,Qiu X,et al.Bone marrow mesenchymal stem cells protect against bleomycin-induced pulmonary fibrosis in rat by activating Nrf2 signaling.Int J Clin Exp Pathol,2015,8:7752-7761.
12 Tzameret A,Sher I,Belkin M,et al.Epiretinal transplantation of human bone marrow mesenchymal stem cells rescues retinal and vision function in a rat model of retinal degeneration.Stem Cell Res,2015,15:387-394.
13 Havlas V,Kotaška J,Koníĉek P,et al.Use of Cultured Human Autologous Bone Marrow Stem Cells in Repair of a Rotator Cuff Tear:Preliminary Results of a Safety Study.Acta Chir Orthop Traumatol Cech,2015,82:229-234.
14 Sheng J,Xia Y,Xu G,et al.Expression of SDF-1/CXCR4 in acute infarct myocardium after implantation of bone marrow mesenchymal stem cells in rats.Zhonghua Yi Xue Za Zhi,2015,95:1421-1424.
15 Hao L,Hao J,Fang W,et al.Dual isotope simultaneous imaging to evaluate the effects of intracoronary bone marrow-derived mesenchymal stem cells on perfusion and metabolism in canines with acute myocardial infarction.Biomed Rep2015,3:447-452.
16 Qu M,Cui J,Zhu J,et al.Bone marrow-derived mesenchymal stem cells suppress NK cell recruitment and activation in PolyI:C-induced liver injury.Biochem Biophys Res Commun,2015,37:2634-3640.
17 Wang X,Zhen L,Miao H,et al.Concomitant Retrograde Coronary Venous Infusion of Basic Fibroblast Growth Factor Enhances Engraftment and Differentiation of Bone Marrow Mesenchymal Stem Cells for Cardiac Repair after Myocardial Infarction.Theranostics,2015,5:995-1006.
18 Zhang Z,Liang D,Gao X,et al.Selective inhibition of inositol hexakisphosphate kinases(IP6Ks) enhances mesenchymal stem cell engraftment and improves therapeutic efficacy for myocardial infarction.Basic Res Cardiol,2014,109:417.
19 Hao NB,Li CZ,Lü MH,et al.SDF-1/CXCR4 Axis Promotes MSCs to Repair Liver Injury Partially through Trans-Differentiation and Fusion with Hepatocytes.Stem Cells Int,2015,25:461-466.
20 Guo CH,Han LX,Wan MR,et al.Immunomodulatory effect of bone marrow mesenchymal stem cells on T lymphocytes in patients with decompensated liver cirrhosis.Genet Mol Res,2015,14:7039-7046.
21 Zhang Q,Sun X,Ding J,et al.Autoserum:An Optimal Supplement for Bone Marrow Mesenchymal Stem Cells of Liver-Injured Rats.Stem Cells Int,2015,25:324-330.
10.3969/j.issn.1002-7386.2017.12.015
050011 河北省石家庄市第一医院心内科(张若青),消化内科(胡静);河北省水利医院内科(王颖)
R 542.22
A
1002-7386(2017)12-1814-03
2016-11-27)

