谷氨酰胺在断奶仔猪上的应用及其机理的研究
敖 翔,李元凤,范明东,何 健
(1.四川铁骑力士集团冯光德实验室,四川 绵阳 621006;2.西南科技大学生命科学与工程学院,绵阳 621010)
谷氨酰胺在断奶仔猪上的应用及其机理的研究
敖 翔1,李元凤2,范明东1,何 健2
(1.四川铁骑力士集团冯光德实验室,四川 绵阳 621006;2.西南科技大学生命科学与工程学院,绵阳 621010)
为研究谷氨酰胺对断奶仔猪生长性能、营养物质表观消化率、血液生化指标、小肠黏膜形态及相关酶活性和肠道健康相关因子基因表达的影响,试验选用 33 日龄、平均体重(9.2±0.20)kg的杜长大断奶仔猪 200 头,采用随机区组试验设计,按体重随机分为 5 组,每组 4 个重复,每个重复 10 头仔猪,公母各半。对照组饲喂不添加 L-谷氨酰胺(Gln)和谷氨酸(Glu)的基础饲粮,试验1 组饲喂在基础饲粮中添加 1%L-谷氨酰胺∶谷氨酸为 1∶9 的饲粮,试验 2 组饲喂在基础饲粮中添加 1%L-谷氨酰胺∶谷氨酸为 2∶8 的饲粮,试验 3 组饲喂在基础饲粮中添加 1%L-谷氨酰胺的饲粮,试验 4 组饲喂在基础饲粮中添加 1%谷氨酸的饲粮。预试期 3 d,试验期 28 d,其中前期 0~14 d,后期 15~28 d。结果表明:1)与对照组相比,试验 3 组前期和全期的日增重分别显著提高了 30.55%(P<0.05)和 23.95%(P<0.05),料重比分别降低了 12.90%(P<0.05)和 13.33%(P<0.05);2)试验 3 组的干物质、总能和粗蛋白质消化率最高;3)与对照组相比,试验 3 组显著增加了 4 周时血清超氧化物歧化酶的活性(P<0.05)、IgG 含量(P<0.05),显著降低了 CD8+的含量(P<0.05);4)试验 3 组的谷氨酰胺合成酶活力显著低于对照组、试验 1 组和试验 4 组,而乳糖酶活力显著高于试验 1 组(P<0.05);5)与对照组相比,试验 3 组降低了 PPARγ mRNA 和 PK mRNA 在十二指肠、空肠和回肠的表达水平(P<0.05),但提高了 mTORmRNA 表达水平(P<0.05)。综上所述,在饲粮中添加 1%谷氨酰胺可通过促进肠道健康发育,改善养分表观消化率,从而显著提高断奶仔猪生长性能。
断奶仔猪;谷氨酰胺;生长性能;表观消化率;酶活;基因表达
因受到生理、营养和环境的突然改变,加上消化道发育不完善,仔猪在断奶后肠绒毛萎缩,隐窝增生,消化酶活性降低,生物大分子在小肠上皮细胞间的跨膜转运和消化吸收下降(Wijtten 等,2011)[1],同时肠道免疫细胞生长分化受阻,激发炎症细胞因子的表达(Pie 等,2004)[2],导致断奶后一段时间仔猪表现出断奶应激综合征:采食量下降,生长受阻,腹泻发生率增加。
研究表明,谷氨酰胺(Gln)有缓解早期断奶应激的功能。Gln 主要功能有:1)是肠道上皮细胞、淋巴细胞、纤维原细胞和网状细胞增殖更新的重要能量物质(冯俊 等,2009)[3];2)是猪初乳 和 常乳中含量最丰富的游离氨基酸,在断奶、受伤和疾病感染等应激条件下被认为是一种条件性必需氨基酸(Li等,2007)[4];3)是维持早期断奶仔猪胃肠道结构和功能完整性的重要组分(Li等,2007;Kozar等,2004;Wu等,1996)[4-6];4)能增强免疫机能,提高机体抗氧化能力(Johnson 等,2006;张军民等,2002;Yoo 等,1997)[7-9]。尽管有关谷氨酰胺对断奶仔猪小肠形态、生理和健康方面的影响有大量的研究报道,但饲粮中添加谷氨酰胺对营养物质消化率及肠道健康相关因子的影响研究报道较少。本研究的目的是探讨在断奶仔猪饲粮中添加不同水平的谷氨酰胺对其生长性能、营养物质表观消化率、血液生化指标、小肠黏膜形态及相关酶活性和肠道健康相关因子基因表达的影响,为谷氨酰胺在断奶仔猪料中的应用提供理论依据。
1 材料与方法
1.1 试验材料
L-谷氨酰胺(Gln)和谷氨酸(Glu)由山东新泰市佳禾生物科技有限公司提供,其有效成分分别为99.0%和 99.5%。
1.2 试验时间与地点
本试验于 2016 年 7 月初至 8 月中旬在绵阳市铁骑力士松垭种猪场进行。
1.3 试验动物与试验设计
试验选用 33 日龄、平均体重(9.2±0.20)kg 的杜长大断奶仔猪 200 头,采用随机区组试验设计,按体重随机分为 5 组,每组 4 个重复,每个重复 10 头仔猪,公母各半。对照组饲喂不添加 L-谷氨酰胺(Gln)和谷氨酸(Glu)的基础饲粮,试验 1 组饲喂在基础饲粮中添加 1%L-谷氨酰胺∶谷氨酸为 1∶9 的饲粮,试验 2 组饲喂在基础饲粮中添加 1%L-谷氨酰胺∶谷氨酸为 2∶8 的饲粮,试验 3 组饲喂在基础饲粮中添加1%L-谷氨酰胺的饲粮,试验 4 组饲喂在基础饲粮中添加 1%谷氨酸的饲粮。试验饲粮由四川铁骑力士实业有限公司提供,参照美国 NRC(1998)断奶仔猪营养需要标准配制,其原料组成及营养水平见表 1。预试期 3 d,试验期 28 d,其中前期 0~14 d,后期 15~28 d。

表1 试验基础饲粮组成与营养水平
1.4 饲养管理
按仔猪正常饲养管理、保健进行。试验期间仔猪自由采食,鸭舌式自动饮水器饮水。饲喂方法为少量多次,日饲喂 4~5 次。
1.5 样品采集及指标测定
1.5.1 生长性能 试验第 0 天、第 15 天和第 28 天,试验动物单独称重,采食量以圈为单位进行统计,计算试验前期、试验后期以及试验全期的日采食量(ADFI)、日增重(ADG)以及料重比(F/G)。
1.5.2 营养物质表观消化率 试验第 22 天至第 24天,每天 8:00~9:00 收集排出的具有代表性的新鲜粪样 150 g左右。测定试验料和粪样中的酸不溶性灰分、干物质、能量和粗蛋白质含量。
1.5.3 血液生化指标 试验第 28 天 8:00 在每个重复中选取3头体重最接近圈平均体重的个体前腔静脉采血分离血清样本测定以下指标:免疫球蛋白A(IgA),免疫球蛋白 G(IgG),免疫球蛋白 M(IgM),T淋巴细胞亚群 CD4+、CD8+和 CD4+/CD8+比值,超氧化物歧化酶(SOD)和总抗氧化活力(T-AOC),谷胱甘肽过氧化物酶(GSH-Px),丙二醛(MDA),白蛋白(ABL),尿素氮(BUN),碱性磷酸酶(ALP)。
1.5.4 肠道形态、相关酶活及基因表达指标 试验第 29 天 0:00 断料,空腹 8 h 后每个重复选取 1 头体重最接近圈平均体重的个体麻醉屠宰,分别在十二指肠、空肠和回肠中段取约 1 cm 的肠道 3 段,其中2段使用生理盐水清洗后置入福尔马林溶液中固定,石蜡包埋后用于测定肠道形态,另外 1 段液氮速冻后-80 ℃冰箱保存待测。空肠近端 1/4 处取 10 cm肠管,生理盐水冲洗完内容物后用载玻片刮取黏膜待测。测定指标如下:1)小肠绒毛高度和隐窝深度;2)肠黏膜蔗糖酶、麦芽糖酶、乳糖酶、谷氨酰胺合成酶活力;3)实时荧光定量 RT-PCR 测定肠道健康相关因子过氧化物酶体增殖体激活受体 γ(PPARγ)、雷帕霉素靶蛋白(mTOR)和丙酮酸激酶(PK)基因mRNA 表达量。
1.6 统计分析
试验数据先用 Excel进行处理,再用 SAS 统计软件进行多重比较。
2 试验结果与分析
2.1 谷氨酰胺对生长性能的影响
由表 2 可知,在 0~2 周时,试验 3 组日增重显著高于对照组(P<0.05),与其他组间无显著差异(P>0.05);各组间日采食量无显著差异(P>0.05);试验 3组料重比显著低于对照组(P<0.05),与其他组间无显著差异(P>0.05)。在 3~4 周时,各组间日增重和日采食量无显著差异(P>0.05),但试验 3 组料重比显著低于其他组(P<0.05)。在 0~4 周时,试验 3 组末重显著高于对照组(P<0.05),与其他组无显著差异(P>0.05);试验 3 组日增重显著高于对照组、试验 1组和试验 4 组(P<0.05);试验 3 组日采食量显著高于对照组(P<0.05);试验 3 组料重比显著低于对照组和试验 4 组,与其他组无显著差异(P>0.05)。

表2 不同谷氨酰胺水平对断奶仔猪生长性能的影响
2.2 谷氨酰胺对营养物质表观消化率的影响
由表3可知,试验4组干物质消化率显著低于试验 3 组(P<0.05),与其他组间无显著差异(P>0.05);对照组和试验 1 组粗蛋白质消化率显著低于试验 3 组(P<0.05);各组间总能消化率无显著差异(P>0.05)。
2.3 谷氨酰胺对血液生化指标的影响
由表 4 可知,在 2 周时,试验 3 组 CD8+显著低于对照组(P<0.05);试验 1 组 IgG 显著低于试验 3组(P<0.05);试验 3 组 IgM 显著高于试验 1 组(P<0.05)。在 4 周时,对照组 SOD 酶活力显著低于试验 3 组(P<0.05);试验 3 组 CD8+显著低于对照组(P<0.05);对照组、试验 1 组和试验 4 组 IgG显著低于试验 3 组(P<0.05);试验 1 组 IgM 显著低于对照组、试验 2 组、试验 3 组和试验 4 组(P<0.05)。
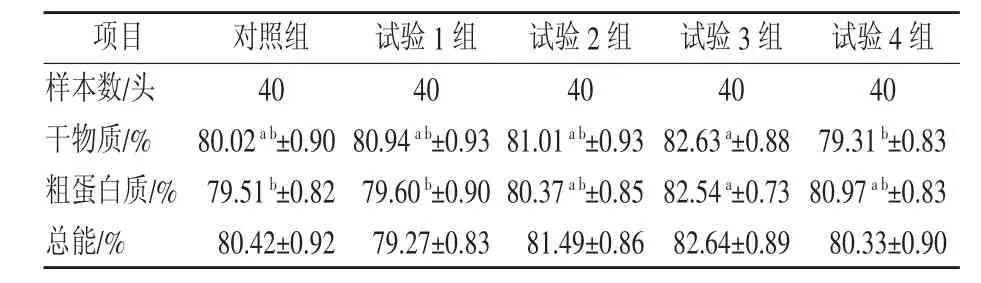
表3 不同谷氨酰胺水平对断奶仔猪营养物质表观消化率的影响

表4 不同谷氨酰胺水平对断奶仔猪血液生化指标的影响
2.4 谷氨酰胺对肠道酶活的影响
由表 5可知,试验 2组和试验 3组谷氨酰胺合成酶活力显著低于对照组、试验1组和试验4组(P<0.05);试验 3 组乳糖酶活力显著高于试验 1 组(P<0.05);各组麦芽糖酶和蔗糖酶活力无显著差异(P>0.05)。
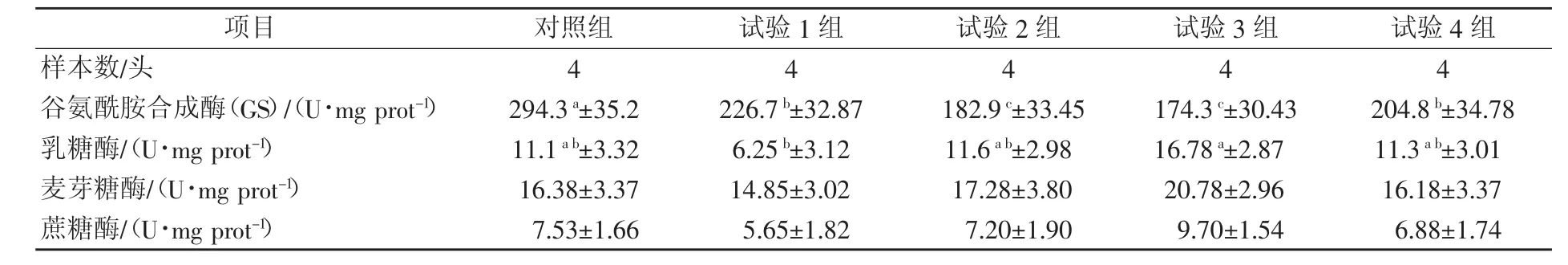
表5 不同谷氨酰胺水平对断奶仔猪空肠黏膜二糖酶活性的影响
2.5 谷氨酰胺对肠道形态的影响
由表 6 可知,各组间绒毛高度、隐窝深度和绒毛高度/隐窝深度无显著差异(P>0.05)。

表6 不同谷氨酰胺水平对断奶仔猪小肠形态的影响
2.6 谷氨酰胺对肠道健康相关因子基因表达的影响
由表 7 可知,与对照组相比,试验 3 组 PPARγ mRNA表达水平分别在十二指肠、空肠和回肠显著下降了 86%、93%和 79%;mTORmRNA 表达水平在十二指肠、空肠和回肠显著提高了 120%、132%和178%;PK mRNA 在十二指肠、空肠和回肠的表达水平则分别显著下降了 80%、89%和 58%。

表7 不同谷氨酰胺水平对断奶仔猪肠道健康相关因子mRNA 基因相对表达水平的影响
3 讨论
3.1 谷氨酰胺对生长性能的影响
从本次试验结果看,添加1%谷氨酰胺能显著提高断奶仔猪生长性能。与对照组相比,1%谷氨酰胺组全期平均日增重和平均日采食量分别增加23.95%和 7.6%,而料重比降低 13.33%。肖英平等(2012)[10]报道添加 1%谷氨酰胺能显著提高断奶后第 10 天和第 30 天的平均日增重,降低料重比,与本次研究结果一致。类似的试验结果也在其他研究中被报道(蒋宗勇等,2010;Wu 等,1996;周荣艳等,2006)[6,11-12],即饲粮中添加 1%谷氨酰胺显著提高了断奶仔猪生长性能。添加 0.125%~0.25%的谷氨酰胺二肽也可提高断奶仔猪生产性能(席鹏彬等,2007)[13]。本次试验中,谷氨酰胺∶谷氨酸为 1∶9 组、谷氨酰胺∶谷氨酸为 2∶8 组和只添加谷氨酸组也有提高断奶仔猪生长性能的趋势,但达不到添加1%谷氨酰胺组的效果,说明谷氨酰胺对断奶仔猪有促生长作用。这可能由于添加谷氨酰胺除满足肠道黏膜对其生理需要外,还可减少必需氨基酸和非必需氨酸转化成谷氨酰胺,从而提高利用饲粮中氨基酸合成蛋白质及满足其他生理需要的效率 (Wu 等,2010)[14]。早期断奶仔猪因为饲粮中谷氨酰胺摄入量不足及由葡萄糖加上其他支链氨基酸合成谷氨酰胺量减少,导致在断奶后1周内采食量降低和肠道黏膜受损(Wu 等,1996;Wang 等,2008)[6,15]。因此,断奶仔猪饲粮必须单独添加谷氨酰胺来满足肠道发育的需要。Wu 等(2010)[14]研究表明,要满足 21~35 日龄仔猪小肠发育所需的谷氨酰胺为每天 965 mg/kg BW,而通常断奶饲粮中的谷氨酰胺加上血液中的谷氨酰胺每天仅为 618mg/kg BW,假设 21~35 日龄断奶仔猪日采食量为 33 g/kg BW,那么饲粮中谷氨酰胺添加量就为 1.05%[(0.965-0.618)/33×100%],这正好与本次研究中1%效果最好的结果一致。
3.2 谷氨酰胺对养分表观消化率的影响
本研究发现,仔猪生长性能的提高可能由于养分消化率的提升。饲粮添加1%谷氨酰胺后粗蛋白质表观消化率显著提高 3.8%,同时提高了干物质和能量表观消化率,但差异不显著。肖英平等(2012)[10]研究表明,饲粮添加 1%谷氨酰胺使仔猪干物质、粗蛋白质表观消化率和表观代谢能均显著提高,在断奶后第 10 天时分别提高了 9.06%、4.77%和 7.02%;在 断 奶 后 第 30 天 分 别 提 高 了 5.90% 、2.80% 和6.43%。这可能是因为谷氨酰胺能够阻止断奶仔猪小肠绒毛的萎缩,提高肠道的抗氧化能力(Wang 等,2008;Wu 等,1996)[6,15],减少小肠上皮 细胞的损伤(Reeds 等,2000)[16],调节肠道细胞的屏障功能,增强营养物质的跨膜转运,从而提高消化吸收能力,进而促进生长 (Wijtten 等,2011;Kozar 等,2004)[1,5]。此外,小肠绒毛上皮刷状缘碱性磷酸酶是关联着肠道基本消化吸收功能的标志性关键酶,可加速物质的摄取和转运,同时为 ADP 磷酸化转变为 ATP 提供更多所需的无机磷酸(Hodin 等,1995)[17]。本次试验中,1%谷氨酰胺组血清碱性磷酸酶活性最高,这与肖英平等(2012)[10]研究结果一致。这可能是因为谷氨酰胺能够增加刷状缘碱性磷酸酶活性,从而提高营养物质表观消化率。
3.3 谷氨酰胺对血液生化指标的影响
动物机体内超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和总抗氧化活力(T-AOC)作为抗氧化系统的重要酶系,在清除自由基、氧化损伤和维持细胞结构方面起着重要作用。在应激状态下,SOD、GSH-Px 和 T-AOC 活性降低,而血液中脂质过氧化物丙二醛(MDA)含量升高(杨保收,1999)[18]。本次试验中,1%谷氨酰胺显著提高了 SOD 酶活性,降低了 MDA 含量,但对 GSH-Px和 T-AOC 无影响,说明谷氨酰胺可改善仔猪断奶后抗氧化能力,缓解应激造成的过氧化损伤,有利于仔猪生长。席鹏彬等(2007)[13]报道,添加 0.125%和 0.25%的谷氨酰胺二肽能提高 SOD 和 GSH-Px酶活性,对 MDA 含量无影响。这与曾翠平(2004)[19]的研究结果基本一致,即添加 0.15%和 0.30%谷氨酰胺二肽不仅可提高仔猪血清 SOD 活性,还可提高肝脏和小肠黏膜 SOD 和GSH-Px 活性,降低血清、回肠黏膜 MDA 含量。上述差异可能由于试验所用仔猪品种、试验条件和时间、饲粮组成等不同引起。
免疫球蛋白是一类存在于机体内广泛参与体液免疫反应的球蛋白,其中 IgA 具有抗菌、抗病毒、抗毒素的免疫学活性,对机体呼吸道、消化道等局部黏膜免疫起着相当重要的作用;IgG 是由脾脏和淋巴结中的浆细胞产生,它是动物血清中含量最高的免疫球蛋白,是最重要的免疫球蛋白之一;IgM 是动物机体初次体液免疫反应中最早出现的免疫球蛋白,具有激活补体等生物学功能(章金刚等,1997)[20]。本次试验中,1%谷氨酰胺提高了 IgG 和 IgM 的含量,但对 IgA 无显著影响。这可能是因为谷氨酰胺可解除环磷酰胺对抗体形成细胞的抑制作用,增进B细胞的功能,对淋巴细胞有较强的活化作用,能提高IgG 和 IgM 的含量(Newsholme 等,1999)[21]。
本次试验中,1%谷氨酰胺 CD8+含量最低,CD4+/ CD8+比值最高,这与前人的研究结果一致(席鹏彬等,2007;蒋宗勇等,2010)[11,13]。T 淋巴细胞亚群是反映机体内细胞免疫机能的非特异性免疫学指标,其稳定是维持机体正常免疫调节功能所必须的。CD4+和 CD4+/CD8+比值高,意味着机体处于高的免疫状态。谷氨酰胺提高仔猪体液免疫功能的原因可能是由于淋巴细胞数量的增加,提高了淋巴细胞转化率,最终使体液免疫功能得到调节。本次试验中 IgG 和IgM 含量的增加也正好印证了这一点。
3.4 谷氨酰胺对空肠黏膜二糖酶活性的影响
乳糖酶和麦芽糖酶等二糖酶作为新生动物肠道中重要的消化酶,是肠道功能发育成熟的指示剂。本研究显示,添加1%谷氨酰胺能显著提高空肠乳糖酶活性,对麦芽糖酶和蔗糖酶也有提高的趋势。蒋宗勇等(2010)[11]研究表明,与对照组相比,饲粮添加 1%谷氨酰胺仔猪在 14 日龄时空肠蔗糖酶、麦芽糖酶和乳糖酶活性显著升高。断奶导致仔猪蔗糖酶和麦芽糖酶活性大幅度下降,在饲粮中添加谷氨酰胺可缓解这种下降趋势,在断奶后第 7天和第 14天,谷氨酰胺组蔗糖酶活性和麦芽糖酶活性均比对照 组 显 著 提 高 (杨 彩 梅 ,2006)[22]。 相 反 , 冯 俊 等(2009)[3]发现,添加 1%谷氨酰胺 对 断 奶 后 14 天 仔猪小肠乳糖酶、蔗糖酶和麦芽糖酶活性无显著影响,但均比对照组有所提高。这可能由于仔猪品种不同、日龄不同和饲粮不同引起。1%谷氨酰胺降低了 GS酶活性,说明饲粮中添加外源谷氨酰胺有降低仔猪空肠内源合成谷氨酰胺的作用,从而提高必需氨基酸和非必需氨基酸合成蛋白质的效率,这与蒋宗勇等(2010)[11]研究结果一致。
3.5 谷氨酰胺对小肠形态的影响
前期试验已经确认了谷氨酰胺对小肠绒毛的有益作用(Wu 等,1996;Liu 等,2002;Yi等,2005)[6,23-24]。Cabrera 等(2013)[25]研究发现,在教槽料和保育料中添加 1%谷氨酰胺显著增加绒毛高度,而 0.88% AminoGut(含有至少 10%谷氨酰胺和 10%谷氨酸)显著提高了隐窝深度。本次试验也观察到小肠形态有改善趋势,但差异不显著。这可能由于日龄原因造成的,因为本次试验选择的是断奶7 d后的仔猪,已经度过了应激期,所以谷氨酰胺对肠道形态的影响微乎其微。
3.6 谷氨酰胺对肠道健康相关因子基因表达的影响
Rhoads 等(2009)[26]报道,谷氨酰 胺在小肠中具有抗炎症效应。PPARγ 是一个标志性的前期炎症细胞因子。mTOR 蛋白激酶是一个高度保守的丝氨酸/苏氨酸蛋白激酶,调控细胞生长因子编码框的丰度和多样性(Schmelzle 等,2000)[27]。PK 是调节葡萄糖代谢的重要调节酶 (Stifel等,1969)[28]。本试验结果表明,添加1%谷氨酰胺可显著提高断奶仔猪小肠中 PPARγ mRNA 的表达,说明谷氨酰胺可在一定程度上缓解断奶应激产生的肠道炎症(Fiatte 等,2008;肖英平等,2012)[10,29]。本次试验中 mTOR mRNA 表达的增加说明1%谷氨酰胺能够促使肠道细胞对氨基酸和能量作出积极反应,从而促进细胞的生长。因为细胞中谷氨酰胺的摄取与其他必需氨基酸的相互作用是激活 mTOR 系统的限制性步骤,谷氨酰胺水平升高为必需氨基酸的摄取提供开关,激活mTORC1信号,通过调节细胞对能量利用来调控细胞生长(Nicklin 等,2009)[30]。本次试验中 1%谷氨酰胺使空肠 PK mRNA 表达水平降低,这可能由于肠道细胞等快速分裂的细胞是以谷氨酰胺为主要能源物质,饲粮中提供了充足的谷氨酰胺,有利于肠道细胞摄取所需的谷氨酰胺作为能量,而不是以细胞内的葡萄糖作为主要的能源物质,从而保证了肠道正常的生理功能(Reeds 等,2000)[16]。
4 结论
本次研究表明,1%谷氨酰胺能提高断奶仔猪生长性能,改善养分表观消化率,增加空肠二糖酶活性,调控肠道 PPARγ、mTOR 和 PK mRNA 表达。其可能机制是谷氨酰胺通过提高消化吸收相关酶活性和调控与肠道健康相关因子的基因表达水平来提高断奶仔猪的生长性能和营养物质消化吸收能力。
[1]Wijtten P J,Vandermeulen J,Verstegen MW.Intestinal barrier function and absorption in pigs after weaning:a review[J]. British journal of nutrition,2011,105(7):967-981.
[2] Pie S,Lalles JP,Blazy F.Weaning is associated with an upregulation of expression of inflammatory cytokines in the intestine of piglets[J].Journal of Nutrition,2004,134(3):641-647.
[3] 冯俊,梁国旗,赵燕,等.谷氨酰胺和壳聚糖及其复合对断奶仔猪肠道酶活和形态及粪便菌群的影响[J].动物营养学报,2009,21(3):335-340.
[4] LiP,Yin Y L,LiD F,etal.Aminoacidsand immune function[J]. British journal of nutrition,2007,98(2):237-252.
[5] Kozar R A,Schultz SG,Bick R J.Enteral glutamine but not alanine maintains small bowel barrier function after ischemia/ reperfusion injury in rats[J].Shock,2004,21(5):433-437.
[6]Wu G,Meier SA,Knabe D A.Dietary glutamine supplementation preventsjejunal atrophy in weaned pigs[J].Journal of Nutrition,1996,126:2578-2584.
[7] Johnson IR,Ball R O,Baracos V E,et al.Glutamine supplementation influences immune development in the newly weaned piglet[J].Developmental and comparative immunology,2006, 30(12):1191-1202.
[8] 张军民,王连递.日粮添加谷氨酰胺对早期断奶仔猪抗氧化能力的影响[J].畜牧兽医学报,2002,33(2):105-109.
[9] Yoo SS,Field C J,Mc Burney M I.Glutamine supplementation maintainsintramuscular glutamine concentrations and normalizes lymphocyte function in infected early weaned pigs[J]. Journal of Nutrition,1997,127:2253-2259.
[10] 肖英平,洪奇华,刘秀婷,等.谷氨酰胺对断奶仔猪生长性能、营养物质表观消化率、空肠碱性磷酸酶活性及与肠道健康相关因 子基因表达 的影响[J].动物营 养学报 ,2012,24(8):1438-1446.
[11] 蒋宗勇,郑卫川,林映才,等.谷氨酰胺对新生仔猪生长性能、血清激素水平及小肠黏膜酶活性的影响[J].动物营养学报,2010,22(1):125-131.
[12] 周荣艳.谷氨酰胺与早期断奶仔猪的营养[J].饲料研究,2006(3):16-18.
[13] 席鹏彬,林映才,蒋宗勇,等.谷氨酰胺二肽对断奶仔猪生长、免疫、抗氧化力和小肠黏膜形态的影响[J].饲料博览,2007(9):61-62.
[14]Wu G,Bazer FW,Johnson G A,et al.Important roles for L-glutamine in swine nutrition and production[J].Journal of animal science,2011,89:2017-2030.
[15]Wang JJ,Chen L X,Li P,et al.Gene expression is altered in piglet small intestine by weaning and dietary glutamine supplementation[J].Journal of Nutrition,2008,138(6):1025-1032.
[16]Reeds P J,Burrin D G.The gut and amino acid homeostasis[J]. Nutrition,2000,16(7):666-668.
[17]Hodin R A,Chamberlain SM,Meng S.Pattern of rat intestinal brush-border enzyme gene expression changes with epithetlial growth state[J].American journal of physiology,1995,269: 385-391.
[18] 杨保收,陈越.应用化学发光法测定肉鸡全血及组织 SOD 活性的研究[J].中国兽医杂志,1999(5):5-6.
[19] 曾翠平.甘氨酰谷氨酰胺对早期断奶仔猪的促生长作用及其机制[D].广州:华南农业大学,2004.
[20] 章金刚,殷震.重视病毒学研究与实践中的生物安全性问题[J].中国兽医学报,2000,20(5):417-418.
[21]Newsholme P,Curi R,Curi,TC P,et al.Glutaminemetabolism by lymphocytes,macrophages,and neutrophils:its importance in health and disease[J].Journal of nutritional biochemistry, 1999,10:316-324.
[22] 杨彩梅. 谷氨酰胺和甘氨酰-谷氨酰胺对断奶仔猪小肠黏膜的影响[J].中国粮油学报,2006,21(4):119-123.
[23]Liu T,Jian P,Xiong Y Z,et al.Effects of dietary glutamine and glutamate supplementation on small intestinal structure, active absorption and DNA,RNA concentration in skeletalmuscle tissue ofweaned piglets during d 28 to 42 of age[J].Asian-Australian journal of animal science,2002,15(2):238-242.
[24]Yi G F,Carroll JA,Allee G L,et al.Effect of glutamine and spray-dried plasma on growth performance,smallintestinal morphology,and immune responses of Escherichia coli K88+-challengedweaned pigs[J].Journal of animal science,2005,83: 634-643.
[25]Cabrera R A,James L U,Consuelo A,et al.Effects of creep feeding and supplemental glutamine or glutamine plus glutamate(Aminogut)on pre-and post-weaning growth performance and intestinal health of piglets[J].Journal of animal science and biotechnology,2013,4(3):29-41.
[26]Rhoads JM,Wu G Y.Glutamine,arginine and leucine signaling in the intestine[J].Amino Acids,2009,37(1):111-122.
[27]Schmelzle T,HallM N.TOR a central controller of cellgrowth[J]. Cell,2000,103(2):253-262.
[28]Stifel F B,Herman R H,Rosensweig N S.Dietary regulation of glycolytic enzymes:Adaptive changes in rat jejuna pyruvate kinase,phosphofructokinase,fructose diphosphatase and glyc -erol-3-phosphate dehydrogenase[J].Biochimica et biophysica acta-biomembranes,1969,184(11):29-34.
[29]Fiatte C,Huin C,Collet P.Expression of PPARγ is reduced by medium supplementation with L-glutamine in human colorectal Caco-2-cells[J].International journal of molecular medicine, 2008,22(6):825-832.
[30]Nicklin P,Bergman P,Zhang B L.Bidirectional transport of aminoacids regulatesmTOR and autophagy[J].Cell,2009,136(3): 521-534.
(编辑:富春妮)
S816.7
A
1002-1957(2017)03-0033-06
2017-03-31
敖 翔(1985-),男,四川成都人,硕士,研究方向为猪的营养.E-mail:602777287@qq.com
何 健,副教授.E-mail:904606344@qq.com

