FSHβ基因对从江香猪母猪繁殖性能的影响
李 俊,陈大芳,张 勇,熊胜利,龙清孟,张 雄,白 优,陆 静,冯文武,李 平,王 燕,李 波,侯 萍
(1.贵州省种畜禽种质测定中心,贵州 贵阳 550018;2.贵州大学动物科学学院,贵州 贵阳 550025;3.贵阳绿生源畜牧科技发展有限公司,贵州 贵阳 550018)
遗传育种
FSHβ基因对从江香猪母猪繁殖性能的影响
李 俊1,陈大芳1,张 勇2,3,熊胜利1,龙清孟1,张 雄2,白 优2,陆 静2,冯文武1,李 平1,王 燕1,李 波1,侯 萍1
(1.贵州省种畜禽种质测定中心,贵州 贵阳 550018;2.贵州大学动物科学学院,贵州 贵阳 550025;3.贵阳绿生源畜牧科技发展有限公司,贵州 贵阳 550018)
以从江香猪母猪为研究对象,选取卵泡刺激素 β 亚基(FSHβ)基因作为影响从江香猪繁殖性能的候选基因,采用 PCR-SSCP(单链构象多态性)和测序技术,对从江香猪母猪的 FSHβ 基因进行单核苷酸多态性研究,寻找与繁殖性状相关联的遗传标记。结果表明:在受试群体中,发现FSHβ 基因第 2 外显子 86 bp 处发生 C/T 突变,该突变为同义突变,产生 3 种带型,分别命名为 TT、CT、CC 基因型。关联性分析显示:在初产母猪的产活仔数和经产母猪的总产仔数中,TT 基因型均比 CC、CT 基因型多,均未达到差异显著水平(P>0.05);但初产母猪总产仔数 TT 基因型比 CC 基因型多 1.66 头,差异显著(P<0.05),经产母猪的产活仔数 TT 基因型比 CC 基因型多 1.95 头,差异显著(P<0.05);对于乳头数,TT 基因型比 CC 基因型多 1.38 对,差异显著(P<0.05)。遗传效应分析发现,等位基因 T 对从江香猪母猪的繁殖性能表现为正效应,TT 基因型对母猪总产仔数、产活仔数、乳头数的估计育种值分别为 0.87、1.03、0.72。总体上,TT 基因型为有利基因型,对从江香猪母猪的繁殖性状数量值具有一定的促进作用,在选育过程中可注重 TT 基因型个体的选育。
从江香猪;FSHβ 基因;多态性分析;繁殖性能
从江香猪是我国珍贵的优良地方微型猪种,仅产于贵州省从江县,以体形矮小、肉质香嫩、基因纯合、纯净无污染等独特优点而著称[1],2000 年农业部130 号公告将其列入《国家级畜禽品种资源保护名录》;但其产仔数较低,平均产仔数 7 头左右,乳头数平均 5 对[2]。猪的产仔数是评价猪繁殖性能的主要指标,提高产仔数对增加养猪业的总体经济效益意义重大。由于产仔数这一性状的遗传力较低,且性状表现晚,如采用常规选择方法对其改良则进展缓慢,如丹麦耗费 30 余年的时间仅将猪产仔数提高 1 头[3]。近年来,随着分子生物学和分子遗传学的发展,对动物经济性状(数量性状)多基因构成的遗传分析研究成为遗传学研究的主要方向,尤其对猪的高繁殖性能研究更是众多研究中的热点,大量的工作投入到从分子水平对繁殖性状的遗传剖分研究中,使得寻找多仔基因的遗传标记、开展分子标记辅助选择(MAS)成为可能。目前,已证实雌激素受体(ESR)基因和卵泡刺激素 β 亚基(FSHβ)基因是影响猪产仔数的主效基因[4-5]。
卵泡刺激素 (follicle stimulating hormone,FSH)是由垂体前叶合成的糖蛋白激素,分子结构由 α、β两个亚基组成,其中β亚基决定促卵泡素的特异性促卵泡素 β 亚基(FSHβ)主要是刺激卵泡的生长和发育,影响生长卵泡的数量,并在促黄体素的协同作用下,激发卵泡的最后成熟,诱发排卵[6]。FSHβ 亚基基因定位于猪 2 号染色体上,全长 10 kb,由 3 个外显子和 2 个内含子组成,编码 111 个氨基酸的蛋白 质[7]。 Li 等[5]研 究 表 明 ,促 卵 泡 素 β 亚 基(follicle stimulating hormone β sub-unit,FSHβ) 基因与猪产仔数的主效基因连锁,进一步的研究证明 FSHβ基因本身也是猪产仔数的主效基因。
本试验以从江香猪母猪为研究对象,统计初产母猪和经产母猪的总产仔数、产活仔数、乳头数,利用 PCR-SSCP(单链构象多态性)、DNA 测序等分子生物学研究技术,从分子水平探究 FSHβ 基因对从江香猪繁殖性能的影响,为后续分子育种提供理论参考,最终结合常规育种手段,提高从江香猪繁殖性能,推动从江香猪高繁殖力品系的选育,促进贵州这一特有珍稀小型猪品种的合理保护、开发和利用。
1 试验方法
1.1 试验时间与地点
试验于 2015 年 10 月在贵州大学动物科学学院和贵州省贵阳市绿生源香猪生态福利养殖场进行。
1.2 试验材料
1.2.1 试验动物 从江香猪母猪 52 头,采自贵阳市乌当区绿生源畜牧科技公司香猪生态福利养殖场。用耳号钳取耳组织 0.5 g,放入装有 1 mL 70%乙醇的 1.5 mL 离心管中,带回实验室-20 ℃冰箱保存备用;同时,通过母猪记录卡记录母猪的总产仔数(total number born,TNB)、产活仔数 (number born alive,NBA)及乳头数(teatnumber,TN)指标。
1.2.2 主要试剂 组织基因组 DNA 提取试剂盒、2× Taq Master Mix、丙烯酰胺、N,N,-亚甲基双丙烯酰胺、硼酸、过硫酸铵、核酸染料、琼脂糖(Agarose)、硝酸银、碳酸钠、去离子甲酰胺、DL 2 000 DNA Marker等试剂均购自上海生工生物工程技术服务有限公司;去离子水、无水乙醇、TAE 缓冲液等试剂实验室自备。
1.2.3 主要仪器 PCR 扩增仪(C1000 Touch,美国BIO-RAD 公司),凝胶成相系统(Universal Hood II,美国 BIO-RAD 公司),电泳仪 (PowerPacTM HV Power Supply,美国 BIO-RAD 公司),微量移液器(eppendorf,德国艾本德公司),紫外分光光度计(Ultrospec 2100 pro,安玛西亚中国有限公司)等。
1.3 试验方法
1.3.1 DNA 提取 组织基因组 DNA 提取试剂盒提取 DNA,1%琼脂糖凝胶电泳检测,凝胶成像系统照相保存,并用紫外分光光度计测量每个 DNA 样品浓度 3 次,取其平均值,-20 ℃保存备用。
1.3.2 引物设计与 PCR 扩增 参照 GenBank(登录号为 NC_010444.3)提供的猪 FSHβ基因序列,运用GenBank 中的 Primer-BLAST 设计 FSHβ基因 Exon2引物(表 1),委托上海生工生物工程技术服务有限公司合成。
采用 25 μL PCR 反应体系:DNA 模板 2.5 μL,2×Taq Master Mix 12.5 μL,上、下游引物各 1.5 μL,ddH2O 7 μL。PCR 反应条件:95 ℃预变性 4min,94 ℃变性 30 s,退火 30 s,72 ℃延伸 1 min,共 34 个循环;72 ℃再延伸 10 min;PCR 产物 4 ℃保存,1%琼脂糖凝胶电泳检测,凝胶成像系统照相保存;将目的PCR 产物送北京诺赛生物公司测序。

表1 PCR-SSCP 引物序列、退火温度、扩增长度及区域
1.3.3 统计分析 将测序得到的 DNA 序列用 DNAStar等软件进行序列对比,筛选 SNPs位点和基因分型,计算不同位点在受试群体中的基因型频率、等位基因频率、有效等位基因数(Ne)、群体遗传纯合度(Ho)、杂合度(He)和多态信息含量(PIC),并进行哈迪-温伯格平衡检测;根据最小二乘线性模型,分析不同基因型及单倍型与样本母猪繁殖性能的关联效应。
2 结果与分析
2.1 基因组 DNA 提取
利用基因组 DNA 提取试剂盒提取从江香猪耳组织 DNA,用 1%琼脂糖凝胶电泳检测,电泳条带明亮清晰、整齐、无拖尾(图 1),说明所提取的从江香猪基因组 DNA 完整度好,且无降解和污染;然后用微量紫外分光光度计检测,其 OD260/280在 1.6~1.8 之间,说明提取的基因组 DNA 纯度较好,无需纯化,可用于后续 PCR 扩增试验。

图1 从江香猪基因组DNA提取结果
2.2 FSHβ 基因 Exon2 PCR 扩增
对所有样品进行 PCR 扩增,经 1%琼脂糖凝胶电泳检测,均显示为 1 条特异性条带,其片段长度为178 bp(图 2),与预期相符,可用于后续 PCR-SSCP检测分析。
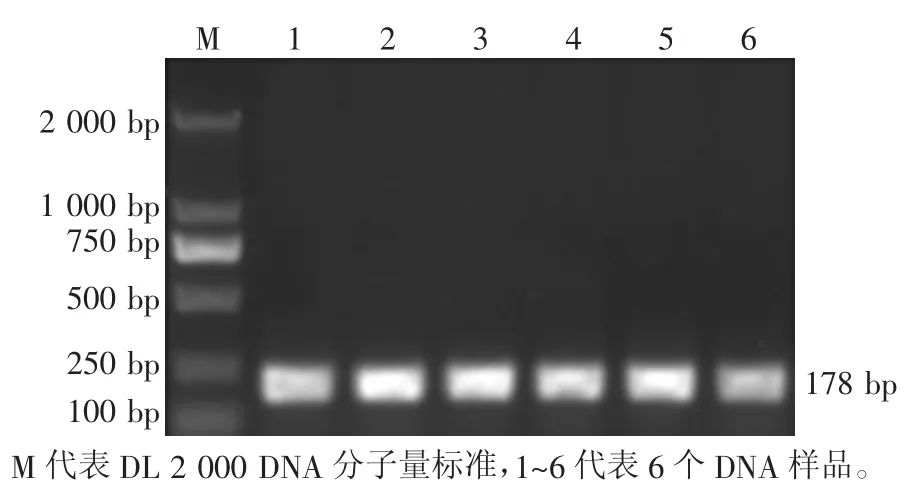
图2 FSHβ 基因 Exon2 PCR 电泳检测结果
2.3 PCR-SSCP 分析及测序结果
将目的 PCR 产物经变性后,通过 10%非变性聚丙烯酰胺凝胶电泳和硝酸银染色,结果显示为3种带型,分别命名为 CC、CT 和 TT(图 3)。选取每种基因型3个重复样送北京诺赛生物公司测序,运用SeqMan 软件分析测序结果(图 4),发现第 2 外显子86 bp 处发生 C/T 突变,该突变为同义突变,未导致氨基酸序列发生改变。通过序列对比发现,CC 基因型个体的序列与 GenBank 上提交的序列相一致,定义为野生型,TT 基因型定义为突变型,而 CT 基因型定义为杂合型。

图3 FSHβ 基因 Exon2 PCR-SSCP 电泳结果

图4 FSHβ基因 Exon2 不同基因型测序结果
2.4 遗传效应分析
从群体遗传学角度对从江香猪 FSHβ 基因C86T 位点的基因型和等位基因频率进行分析结果见表 2。由表 2 可知,CC 基因型频率为 21.15%,CT基因型频率为 61.54%,TT 基因型频率为 17.31%;C等位基因频率为 51.92%,表现为优势等位基因,T等位基因频率为 48.08%。
通过对 C86T 位点的遗传结构进行分析,发现纯合度(Ho)为 0.500 7,杂合度(He)为 0.499 3,有效等位基因数(Ne)为 1.997 2;纯合度和杂合度相差不大,说明该位点在该群体中的变异较均衡;有效等位基因数(Ne)接近实际检测到的 2 个等位基因数;多态信息含量 (PIC) 为 0.374 7,表现为中度多态(0.25<PIC<0.50),表明该位点 在该群体中分布均匀,且能比较合理地提供遗传信息。经 χ2适合性检验结果表明,该位点在试验群体中产生的多态性未偏离 Hardy-weinberg 平衡(P>0.05)。

表2 FSHβ 基因 SNP 位点遗传效应分析
2.5 不同基因型与繁殖性能的关联分析
从江香猪 FSHβ 基因第 2 外显子 C86T 位点不同基因型与母猪总产仔数、产活仔数及乳头数的最小二乘分析结果见表 3。由表3可知,对于初产母猪,总产仔数 TT 基因型比 CC 基因型多 1.66 头,差异显著(P<0.05);比 CT 基因型多 0.53 头,差异不显著(P>0.05)。而产活仔数 TT 基因型分别比 CC 基因型和 CT 基因型多 1.2 头和 0.51 头,但差异均不显著(P>0.05)。在经产母猪中,总产仔数 TT 基因型分别比 CC 基因型、CT 基因型多 1.25 头、0.79 头,差异均不显著(P>0.05);而产活仔数 TT 基因型比 CC 基因型多 1.95 头,差异显著(P<0.05),比 CT 基因型多 0.96 头,但差异不显著(P>0.05)。对于乳头数,TT基因型比 CC 基因型多 1.38 对,差异显著(P<0.05);比 CT 基因型多 0.72 对,差异不显著(P>0.05)。对于初产母猪和经产母猪的总产仔数、产活仔数,以及乳头数的总体趋势为:TT>CT>CC。

表3 FSHβ 基因不同基因型与产仔数关联性分析
为进一步分析对从江香猪母猪繁殖性能具有显著影响的 C86T 位点,利用数量性状遗传分析模型计算该 SNP 位点在从江香猪群体的基因平均效应、基因替代平均效应、群体基因型均值和育种值(表 4)。由表 4 中数据可知,C86T 位点对从江香猪母猪的初产总产仔数、经产产活仔数,以及乳头数均有显著影响,其等位基因 T 对初产总产仔数、经产产活仔数、乳头数的平均效分别为 0.44、0.51、0.36;而等位基因C的基因平均效应均表现为负效应。TT基因型对初产总产仔数、经产产活仔数、乳头数的估计育种值分别为 0.87、1.03、0.72;而 CC 基因型均表现为负效应。总体上,TT 基因型对从江香猪母的繁殖性状数量值具有一定的促进作用,在选育过程中可注重TT基因型个体的选育。

表4 FSHβ 基因数量性状遗传效应分析
3 讨论
FSHβ基因作为影响母猪繁殖性状的一个主效基因,近年来,国内相关研究者加大对猪 FSHβ基因多态性研究的力度。赵要风等[8]研究发现,在猪的FSHβ 基因内含子 1 中存在的 292 bp 逆转座子插入突变所形成的多态性位点,只要根据插入突变设计引物,就可利用 PCR 检测猪的 FSHβ 座位的多态性,并发现该座位纯合基因型AA显著提高猪产仔数。李庆岗等[9]发现,FSHβ 基因的 A 等位基因对淮猪新品系繁殖性状均具有正的加性效应,AA 基因型为该猪群的优良基因型。燕志宏等[10]发现,宗地花猪 FSHβ 基因 AA 基因型的平均产仔数及产活仔数均显著高于 AB 基因型。万明春等[11]在玉山黑猪中发现,FSHβ 基因 AA 基因型为优势基因型,这与邹剑戎等[12]在荷包猪和鲁绍雄等[13]在撒坝猪群体中的研究结果相一致。戴丽荷等[14]研究发现,FSHβ基因在嘉兴黑猪、巴马香猪、金华猪和八眉猪中几乎只有A 等位基因,而在大约克、长白、杜洛克猪种中均是以 B 等位基因占优势。苏先敏等[15]研究发现,大白、长白及杜洛克母猪 FSHβ基因 B 等位基因频率较高,BB 基因型占有优势,这与李千军等[16]、施启顺等[17]在长白猪种和大白猪种中的研究结果相一致。刘超等研究也证实大白猪 FSHβ基因优势基因为 B 等位基因,初产母猪的 AB 基因型健仔数比 AA 型多1.21 头。陈来华等[18]研究大白猪 FSHβ基因发现,A等位基因对总产仔数、产活仔数、初生重和胎盘性状均表现为正效应。可见,在中国地方猪种的研究中,大多数是 A 等位基因频率较高,AA 基因型为优势基因型,外来品种和少部分地方品种表现为BB基因型为优势基因型;造成这一差异的原因可能是由于外来品种长期对猪的高产性进行选择而导致了BB基因型的积累。
本试验研究结果发现,在从江香猪 FSHβ 基因第 2 外显子 86 bp 处发现 C/T 突变,且产生 3 种不同基因型,与龙国荣等[19]在贵州白香猪上发现的C86T突变位点相一致,均产生 3 种基因型。而 Zhang 等[20]在民猪、杜洛克等 6 个品系中研究发现,FSHβ 基因外显子 2 在 48 bp 处发生 C/T 突变,与吴兆海[21]在马身猪、杜洛克猪、大白猪、山西黑猪和山西白猪等 5个猪种 FSHβ 基因第 2 外显子第 48 位上检测到C→T 的转换突变为同义突变相一致,但与本研究结果不一致,猜测其原因可能是由于品种的不同导致SNP 位点的检测发生差异。高天等[22]在嘉兴黑猪中研究发现,FSHβ基因第 2 外显子 3 个 SNP 位点(A923C、A926G 和 T1 036C),但与繁殖性状没有显著关联。郑心力等[23]在五指山猪中发现 FSHβ 基因 6处单碱基突变位点,分别位于第 1 内含子(A-757G、A-645G、A-531G)和第 2 内含子(C+1 431T、A+1 434G、C+1 502T)。本研究通过关联分析发现,C86T 位点对从江香猪母猪的初产总产仔数、经产产活仔数以及乳头数均有显著影响(P<0.05),T 基因为有利等位基因,TT 基因型为有利基因型,表现为正效应,对于初产母猪和经产母猪的总产仔数、产活仔数,以及乳头数的总体趋势为:TT>CT>CC。因此,在以后选育从江香猪母猪繁殖性状时,注重TT基因型母猪的选育,再结合常规育种方法,选择和淘汰种母猪,以便更有效地提高选种准确度和遗传改良效率,加快选种选育进程,扩大从江香猪种群规模,更好地保护和利用从江香猪这一名贵的地方猪种。但由于本试验样本数少、品种单一,具有一定局限性,再加上母猪的繁殖性能受到遗传、管理、营养水平和周围环境等各方面的影响很大[24],因此,在今后的研究中,将扩大样本数,并在产仔数、乳头数差异较大品种中验证该突变位点是否对母猪繁殖性能产生影响。
[1] 刘培琼,刘若余,燕志宏,等.香猪的种质特性[J].中国猪业,2013(S1):163-164.
[2] 刘培琼.中国香猪[M].北京:中国农业出版社,2010:142-148.
[3] 熊远著.瘦肉猪育种的发展及展望[J].中国工程科学,2000,2(9):42-46.
[4] Rothschild M,Jacobson C,Vaske D,et al.The estrogen receptor locus is associated with amajor gene influencing litter size in pigs[J].Proc Natl Acad Sci U SA,1996,93(1):201-205.
[5] Li N,Zhao Y F,Xiao L,et al.Candidate gene approach for identification of genetic loci controlling litter size in swine[A]// Proc.6th World Congress on Genetics Applied to Livestock Production[C].Armidale,Australia,1998:183-188.
[6] Cooke D J,Crowe M A,Roche JF,et al.Gonadotrophin hetero-geneity and its role in farm animal reproduction[J].Animal Reproduction Science,1996,41(2):77-79.
[7] Hirai T,Takikawa H,Kato Y.The gene for beta subunit ofporcine FSH of consensus oestrogen-responsive element andpresenceof retroposons[J].JMolEndocrinol,1990,5(2):147-158.
[8] 赵要风,李宁,肖璐,等.猪 FSHβ 亚基基因结构区逆转座子插入突变及其与猪产仔数关系的研究[J].中国科学,1999,29(1):82-86.
[9] 李庆岗,王志秀,张博,等.FSHβ、ESR 和 PRLR 基因多态性与淮猪新品系产仔数相关性分析[J].养猪,2014(1):52-56.
[10] 燕志宏,毛同辉,冯文豪.宗地花猪 ESR、FSHβ 基因的多态性及其对繁殖性能的影响[J].贵州农业科学,2010,38(7):134-137.
[11] 万明春,周泉勇,霍俊宏,等.玉山黑猪 ESR 和 FSH-β 基因多态性及相关性状的研究[J].江西农业学报,2014,26(3):107-109.
[12] 邹剑戎,朱弘焱,苏玉虹.辽宁种猪 ESR 和 FSHβ 基因多态性及其与产仔性能的关联分析[J].黑龙江畜牧兽医,2010(6):66-68.
[13] 鲁绍雄,胡晓湘,连林生,等.撒坝猪 ESR 和 FSH-β 基因多态性及其与产仔数的关联分析[J].云南农业大学学报(自然科学版),2009,24(3):389-393.
[14] 戴丽荷,胡锦平,褚晓红,等.FSHβ 基因多态性及对不同品种猪繁殖性状的影响[J].浙江农业学报,2013,25(3):461-466.
[15] 苏先敏,朱世平,赵乔辉,等.台系大白、长 白和杜洛克 猪FSHβ 基因多态性及其与繁殖性能的关系[J].中国畜牧杂志,2013,49(19):5-8.
[16] 李千军,王立刚,穆淑琴,等.ESR,FSHβ 及 OPN 基因多态性与母猪繁殖性状的关联分析[J].中国畜牧兽医,2010(10):139-143.
[17] 施启顺,柳小春,刘志伟,等.5 个与猪产仔数相关基因的效应分析[J].遗传,2006,28(6):652-658.
[18] 陈来华,王立贤,季跃光,等.FSHβ 亚基基因与繁殖性能及胎盘性状的关联分析[J].畜牧兽医学报,2010,41(11):1365-1370.
[19] 龙国荣,许厚强,李世功,等.贵州白香猪 FSHβ 基因多态性与产仔数的关联分析[J].广东农业科学,2013,40(13):129-131.
[20]Zhang D J,Liu D,Yang GW.Polymorphism of FSHβ subunit gene in six pig breeds[J].Journal of Northeast Agricultural University(English Edition),2010,17(1):62-64.
[21] 吴兆海,薛振锋,梁超,等.猪 FSHβ 基因第 2 外显子多态性与产仔性能的关联分析[J].中国畜牧杂志,2012(17):6-9.
[22] 高天,鐔忠斌,王晓杜,等.嘉兴黑猪 ESR2 和 FSHβ 及 PRLR基因多态性与繁殖性状 相关性分析[J].中国 畜牧杂志,2016,52(5):1-7.
[23] 郑心力,刘海隆,黄丽丽,等.五指山猪 FSHβ 基因克隆测序及生物信息学分析[J].黑龙江畜牧兽医,2016(9):93-95.
[24] 刘婵娟,曾勇庆,魏述东,等.8 个猪种 ESR 和 FSHβ 基因合并基因型与繁殖性状关系的研究[J].畜牧兽医学报,2009,40(3):291-295.
(编辑:富春妮)
艾叶不只用来艾灸
中医认为,艾叶可理气血、除寒湿。除了作为艾灸的原料,艾叶还有很多用处。
止痒:艾叶外用有祛湿止痒、抑菌作用。湿疹导致的皮肤瘙痒、脚部细菌滋生引起的瘙痒,可用艾叶煎水清洗、浸泡。
治疗风湿痛:艾叶有活气血、逐寒湿、温通经络的作用。用菊花与艾叶一同制作成护膝以及护腰垫,可以缓解关节红肿、酸痛、僵硬,以及腰背酸痛等。
调理痛经:艾叶有暖血温经的作用,又能壮子宫,所以治疗妇科疾病的方剂中多会添加。当女性发生痛经时,可以食用艾叶煮蛋、艾叶母鸡汤或艾叶红糖茶来调理。
缓解头痛:艾叶枕头对调理因天气寒冷、潮湿引起的头痛有效好的效果,长期使用艾叶枕头还可以预防感冒与缓解颈椎疼。
止盗汗:清醒时候不流汗,一旦入睡便会大量地出汗,中医称这种现象为盗汗。《本草纲目》指出,可用艾叶 10 克、白茯苓 15 克、乌梅 3 个,一同煎水,睡前服用治疗盗汗。
艾叶虽然作用很多,但是使用时也有一定注意事项。首先,不宜一次性服用太多,容易引起恶心、呕吐以及腹部不适等。其次,艾草中的油脂对皮肤有一定的刺激性,如果出现皮肤发热、潮红,最好停止使用。另外,艾草性温,容易上火的人群最好不要使用,使用艾叶之前最好先咨询医生。
(摘自《长寿养生报》2017.04.21 徐 云/文)
The Effect on Reproductive Performance for FSHβ Gene in Congjiang Sow Pigs
LIJun1,CHEN Dafang1,ZHANG Yong2,3,XIONG Shengli1,LONG Qingmeng1,ZHANG Xiong2,BAIYou2, LU Jing2,FENGWenwu1,LIPing1,WANG Yan1,LIBo1,HOU Ping1
(1.Guizhou Germplasm Determination Center of Livestock and Poultry,Guiyang 550018,China;2.College of Animal Science of Guizhou University,Guiyang 550025,China;3.Guiyang Lvshengyuan Livestock Technology Development Company Limited,Guiyang 550018,China)
In this study,Congjiang sow pigswere served as research objects.The follicle stimulating hormone β subunit(FSHβ)genewas selected as the candidate gene influencing reproductive performance of Congjiang pigs. Using PCR-SSCP and sequencing techniques to research single nucleotide polymorphisms of FSHβ gene in Congjiang sow pigs,which would search for genetic markers associated with reproductive traits.The results showed that C/T mutation was found in 86 bp of exon 2 of FSHβ gene,and the mutation was a synonymous mutation,and 3 genotypes were generated,respectively named TT,CT,and CC genotype.Correlation analysis showed that TT genotype wasmore than CC and CT genotype in the number born alive of primiparous sows and the total number born of sows.The difference was not significant(P>0.05).The TT genotype was 1.66 more than CC genotype in the total number born of primiparous sows,the difference was significant(P <0.05).The TT genotype was 1.95 more than CC genotype in the number born alive of sows,the difference was significant(P<0.05).For the teat number,TT genotype was 1.38 more than CC genotype,the difference was significant(P<0.05). Genetic effects analysis showed that the allele T had a positive effect on the reproductive performance of Congjiang sow pigs.Estimated breeding values of TT genotype were 0.87,1.03,0.72 for the total number born, the number born alive,the teat number of the sows.On the whole,the TT genotype was a favorable genotype, which had a positive effect on the quantitative traits of reproductive performance for Congjiang sow pigs.In the breeding process should pay attention to TT genotype individual breeding.
Congjiang pig;FSHβgene;polymorphism analysis;reproductive performance
S828
A
1002-1957(2017)03-0073-05
2017-03-23
李 俊(1989-),男,贵州遵义人,畜牧师,硕士,主要从事动物遗传育种与种质资源创新工作.E-mail:15285116484@163.com
陈大芳(1968-),女,研究员,主要从事种猪遗传育种研究工作.E-mail:894854907@qq.com
———从江加车村

