外源纤维素诱导下纤维素降解细菌的分离
孟建宇,张曦媛,王巧玲
(内蒙古农业大学生命科学学院应用与环境微生物研究所,内蒙古呼和浩特010018)
外源纤维素诱导下纤维素降解细菌的分离
孟建宇*,张曦媛,王巧玲
(内蒙古农业大学生命科学学院应用与环境微生物研究所,内蒙古呼和浩特010018)
对生物结皮和沙土的混合物分别加入秸秆和木屑进行诱导,通过选择性培养基对样品中的纤维素降解菌进行分离和记数分析。结果共筛得4株具有较强纤维素降解能力的细菌,16S rDNA序列分析表明,它们分别属于不动杆菌属(Acinetobacter)、芽孢杆菌属(Bacillus)、链霉菌属(Streptomyces)、假单胞菌属(Pseudomonas)。从计数结果可以看出,外源纤维素诱导物,特别是秸秆的添加,会明显提高生物结皮和沙土混合物中的纤维素降解菌的生长繁殖能力。
纤维素降解细菌;外源纤维素;诱导;分离;计数
植物材料的主要成分为纤维素,是自然界最丰富的可再生资源之一(吴琳等,2009;吕静琳等,2009)。地球上纤维素生物质资源尤为丰富,年产逾2×106万吨,但部分资源因其结构特点难以被分解利用,大多以堆积、焚烧等形式直接进入环境,造成对资源极大的浪费(廖青等,2014;牛秋红等,2012;邓先余等,2012;赵银瓶等,2012)。因此研究如何利用高效纤维素降解菌降解纤维素对于解决世界能源危机及环境问题具有积极的意义(郑锐东等,2015;王双等,2012;刘永生等,2003)。目前国内对产纤维素酶的细菌分离筛选主要围绕厌氧或兼性厌氧的菌种进行,采用纤维素分解菌分离培养基进行初筛后,利用CMC-Na刚果红平板进行高效菌株的进一步分筛(邓先余等,2012;樊程等,2012;刘占英等,2008)。
生物结皮的形成是荒漠化生态恢复过程中的关键一步(Bassin等,2011)。而纤维素降解菌不仅是土壤微生物中的主要类群,又是生物结皮形成的最主要的一类先驱微生物(邵玉琴等,2004),其可将纤维素降解成单糖加以利用,是土壤中碳源的主要来源(Lynd等,2002)。本文通过从加入秸秆和木屑诱导的生物结皮和沙土的混合物中富集筛选纤维素降解菌株,分析外源诱导物对混合物中纤维素降解细菌生长的影响,为进一步研究纤维素酶活性、产酶条件优化等提供基础理论依据。
1 材料与方法
1.1 分离样品分离样品是加入秸秆和木屑诱导的生物结皮和沙土的混合物。未加任何物质的沙土和结皮混合物为空白对照。
1.2 培养基纤维素分解菌分离培养基:CMCNa 5 g,营养盐100 mL,琼脂2 g。
营养盐:K2HPO42 g,(NH4)H2PO40.5 g,Mg-SO42 g,MnSO4·H2O 2.5 g,FeSO4·7H2O 7.5 mg,NaCl 0.3 g,H2O 1000 mL。
刚果红培养基:K2HPO40.5 g,MgSO40.25 g,CMC-Na 2 g,刚果红0.2 g,蛋白胨2 g,酵母膏1 g,H2O 1000 mL,琼脂12 g。
牛肉膏蛋白胨培养基:牛肉膏3 g,NaCl 5 g,蛋白胨10 g,H2O 1000 mL,pH 7.4~7.6。
羧甲基纤维素固体选择性培养基:CMC-Na 5 g,MgSO40.5 g,KH2PO42 g,酵母粉2 g,琼脂20 g,H2O 1000 mL。
1.3 纤维素分解菌的筛选与计数菌种初筛:分别称取10 g诱导10 d的样品和对照样品溶于90 mL无菌水中,再按10倍稀释法稀释成不同的浓度,取10-3、10-4、10-5三种稀释度,涂布于纤维素选择性培养基中,每个稀释度做三个平行,28℃恒温培养。待长出菌群后,挑菌落划线分离直至长出单菌落。
菌种复筛:将分离纯化的单菌落接种于刚果红培养基平板上,28℃恒温培养3~5 d,挑选出在平板上生长快,产生大的透明水解圈的单菌落。
计数:分别对培养0、10和30 d的空白样、加秸秆诱导样、加木屑诱导样的细菌和纤维素分解菌进行计数。
1.4 菌种的鉴定选取水解圈较大的菌株进行分子鉴定。在8000 r/min条件下离心3 min,收集1~3 mL菌液,加入1 mL TE缓冲液洗涤后再次离心,重悬,进行DNA的提取(胡晓红等,2008)。利用细菌16S rDNA基因通用扩增引物27F(5′AGAGTTTGATCCTGGCTCAG 3′)和1492R(5′GGTTACCTTGTTACGACTT 3′)对目的基因进行PCR扩增,采用荧光染料SYBR GREENⅠ(厦门百维信)为标记进行电泳检测。使用琼脂糖凝胶DNA回收试剂盒(北京中科瑞泰生物科技公司)进行纯化。然后利用pMD19-T载体与目的片段连接,进行重组载体的转化,并将转化细胞涂布于含Amp的LB筛选平板上,于37℃培养24 h。挑取阳性克隆子,采用质粒插入检测引物M13+(5′CGCCAGGGTTTTCCCAGTCACGAC 3′)和M13-
(5′GAGCGGATAACAATTTCACACAGG 3′)进行菌落PCR扩增重组质粒检测,挑取阳性克隆,测序由北京六合华大基因公司完成。利用NCBI数据库的Blastn程序对获得的16S rDNA序列进行分析,确定待测菌株的种属关系。
2 结果与分析
2.1 纤维素降解菌的分离用纤维素选择培养基初筛出生长较快的10株菌,然后将其接种于刚果红培养基进行复筛,水解圈较大的有4株菌,分别为RD01、RD04、RD06、RD10,4株菌的形态见图1,图2是菌株RD01的在刚果红培养基上产生的水解圈。
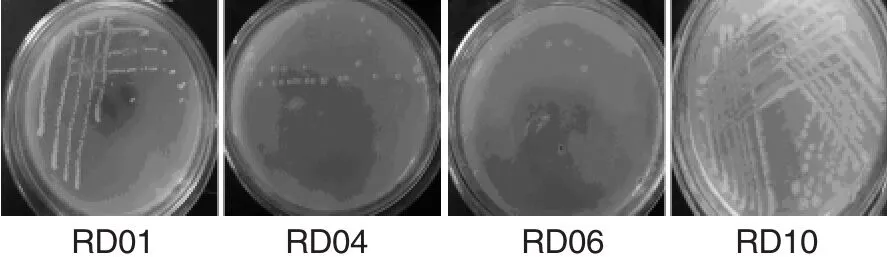
图1 菌株RD01、RD04、RD06、RD10的菌落形态
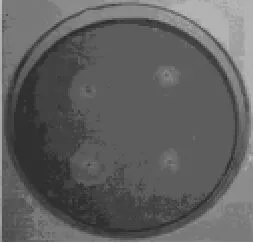
图2 RD01菌株在刚果红培养基上产生的水解圈
2.2 细菌计数由表1可知,无论是加入秸秆和木屑诱导的样品还是空白样品随着培养天数的增加细菌总数都在不断增加,但是加入秸秆和木屑诱导的样品增加幅度没有空白大;随着培养天数的增加,无论是加入秸秆和木屑诱导的样品还是空白样品纤维素降解菌的数目也在不断增加,但是,加入秸秆和木屑诱导的样品明显比空白增加幅度大,而且秸秆诱导效果要明显好于木屑诱导的效果。

表1 细菌总数及纤维素降解菌数
2.3 菌种的鉴定提取4株细菌的总DNA后进行16S rDNA的PCR扩增,产物纯化后进行目的片段的连接转化,挑取阳性克隆子进行菌落PCR检测,结果4株菌菌落分别扩增出单一、清晰且明亮的条带(图3)。用NCBI数据库的Blastn程序对获得的16S rDNA序列进行比对分析发现,4株纤维素降解细菌分别来源于4个不同的属,即RD01为链霉菌属(Streptomyces),RD04为不动杆菌属(Acinetobacter),RD06为假单胞菌属(Pseudomonas),RD10为芽孢杆菌属(Bacillus),其同源性都在99%以上(表2)。

图3 阳性克隆子菌落PCR扩增检测

表2 菌株16S rDNA序列的Blast同源性分析
3 结论与讨论
纤维素降解菌在秸秆、木屑等纤维素类碳源物质诱导下,可产生纤维素酶(高春等,2008),并且可明显提高纤维素降解菌和其他细菌的数量,也有利于纤维素降解菌的分离(孟杰等,2011)。本研究通过选择性培养基对样品中的纤维素降解菌进行初筛、复筛及计数。结果表明,加入外源诱导物的纤维素降解菌对其他细菌产生了拮抗作用。这不仅为研究提供了分离富集纤维素降解菌的方法,也说明了此方法具有可行性。外源纤维素诱导下纤维素降解菌的丰度会有一定程度的增加,由于秸秆纤维比木质素含量更高的木屑更容易降解(赵吉睿等,2013),使得秸秆纤维素的诱导能力要强于木屑纤维素。
基于细菌的16S rDNA在进化上具有高度的保守性,所以可通过16S rDNA基因序列与NCBI数据库中序列进行同源性比较和分属鉴定。本试验复筛出的4株纤维素降解细菌分别属于不动杆菌属(Acinetobacter)、芽孢杆菌属(Bacillus)、链霉菌属(Streptomyces)、假单胞菌属(Pseudomonas)。这些菌属都是常见的有纤维素降解能力的种属,大部分还是低温纤维素降解菌来源种属(罗立津等,2015)。
筛选优良的纤维素降解菌对提高生物降解的效果有着很大的意义。目前所筛选到的菌种虽然具有一定的产纤维素酶能力,但是因纤维素酶系的多型性,纤维素的酶解是一个复杂的过程。菌种的产酶及酶活受诸多因素影响,因此应综合考虑后确定产酶条件(高小朋等,2011)。
[1]邓先余,邹谋勇,黄志坚,等.一株产纤维素酶细菌的分离鉴定及其酶学特性研究[J].中山大学学报(自然科学版),2012,51(5):93~99.
[2]樊程,李双江,李成磊,等.大熊猫肠道纤维素分解菌的分离鉴定及产酶性质[J].微生物学报,2012,52(9):1113~1121.
[3]高春,孟建宇,冯福应.纤维素降解菌的分离筛选及其酶活研究[J].畜牧与饲料科学,2008,29(4):17~20.
[4]高小朋,杨晗,袁茂林,等.纤维素降解菌的筛选及酶活力测定[J].湖北农业科学,2011,50(15):3072~3074.
[5]胡晓红,彭惠民,刘昕,等.PCR及Real-time PCR评价细菌DNA提取方法[J].重庆医科大学学报,2008,33(2):155~158.
[6]廖青,江泽普,邢颖,等.发酵床中纤维素降解菌的分离与鉴定[J].生物技术通报,2014,3:106~110.
[7]刘永生,冯家勋,段承杰,等.能降解天然纤维素的地衣芽孢杆菌GXN151的分离鉴定及其一个纤维素酶基因(cel5A)的克隆和测序分析[J].广西农业生物科学,2003,22(2):132~138.
[8]刘占英,侯先志,刘玉承,等.一株分解纤维素的肠球菌的分离鉴定[J].内蒙古大学学报(自然科学版),2008,39(2):166~171.
[9]吕静琳,黄爱玲,郑蓉,等.一株产纤维素酶细菌的筛选、鉴定及产酶条件优化[J].生物技术,2009,19(6):26~29.
[10]罗立津,万立,陈宏,等.耐低温木质纤维素降解菌群的富集培养及其种群结构分析[J].农业生物技术学报,2015,23(6):727~737.
[11]孟杰,王宏燕,李涛.生物表面活性剂混合纤维素分解菌分解秸秆的研究[J].东北农业大学学报,2011,42(2):97~103.
[12]牛秋红,张林,褚学英,等.松材线虫伴生菌中产纤维素酶细菌的筛选、鉴定及其相关基因的克隆[J].微生物学报,2012,52(11):1408~1414.
[13]邵玉琴,赵吉.草原沙地微生物结皮与固沙作用的研究[J].农业环境科学学报,2004,23(1):94~97.
[14]王双,夏天,潘杨楠,等.秸秆纤维素降解真菌的筛选及产酶条件的优化[J].广东农业科学,2012,39(14):109~112.
[15]吴琳,景晓辉,黄俊生.产纤维素酶菌株的分离、筛选及酶活性测定[J].安徽农业科学,2009,37(17):7855~7857,7859.
[16]赵吉睿,李晓军,孟建宇,等.外源纤维素诱导明显影响微生物土壤结皮细菌群落结构[J].微生物学通报,2013,40(12):2217~2226.
[17]赵银瓶,马诗淳,孙颖杰,等.嗜热厌氧纤维素分解菌的分离、鉴定及其酶学特性[J].微生物学报,2012,52(9):1160~1166.
[18]郑锐东,谢桂勉,罗集丰,等.纤维素降解真菌Aspergillus cel403发酵产酶条件研究[J].轻工科技,2015,9:13~14,20.
[19]Bassin JP,Pronk M,Muyzer G,et al.Effect of elevated salt concentrations on the aerobic granular sludge process:linking microbial activity with microbial community structure[J].Applied and Environental Microbiolology,2011,77(22):7942~7953.
[20]Lynd R L,Weimer J P,Zyl W,et al.Microbial cellulose utilization:fundamentals and biotechnology[J].Microbiology and Molecular Biology Reviews,2002,66(3):506~577.■
Two cellulose materials(wheat straw and sawdust)were added separately into the mixture of biological crust and sand to isolate and count cellulose-degrading bacteria by selective media.As a result,4 bacterial strains with high cellulose-degrading ability were isolated.The 16S rDNA sequence analysis indicated that they belong to Acinetobacter,Bacillus,Streptomyces and Pseudomonas,respectively.The results of bacterial counting showed that the exogenous cellulose especially wheat straw,can rapidly increased the growth of cellulose-degrading bacteria in the mixture of biological crustand sand.
cellulose-degrading bacteria;exogenous cellulose;induction;isolation;counting
S816.3
A
1004-3314(2017)11-0033-03
10.15906/j.cnki.cn11-2975/s.20171107
国家自然科学基金项目(31460002);内蒙古自治区高等学校科学研究项目(NJZY14084)
*通讯作者

