机器人宫颈癌根治术用于放化疗后局部晚期宫颈癌的可行性研究
马 芮,马佳佳,李 娜,周福兴,刘海霞,罗天爱,孙小霞,陈必良
(第四军医大学西京医院妇产科,陕西 西安 710032)
机器人宫颈癌根治术用于放化疗后局部晚期宫颈癌的可行性研究
马 芮,马佳佳,李 娜,周福兴,刘海霞,罗天爱,孙小霞,陈必良
(第四军医大学西京医院妇产科,陕西 西安 710032)
目的 探究机器人宫颈癌根治术用于放化疗后局部晚期宫颈癌的安全性和可行性。方法 选取2013年3月至2015年6月在西京医院接受机器人宫颈癌根治术的101例FIGO分期为ⅠB2~ⅡB期的宫颈癌患者的临床资料。根据术前放化疗与否,将纳入病例分为两组:术前接受过同步放化疗的51例宫颈癌患者为观察组;术前未接受过辅助治疗的50例宫颈癌患者为对照组。两组患者均行机器人宫颈癌根治术。分析比较两组患者的手术时间、术中出血量、术后住院天数、术中术后并发症、术后病理资料和术后补充放化疗及复发生存等情况。统计分析观察组术前放化疗的临床疗效。结果 两组患者在年龄、BMI方面、盆腔手术史和病理分期方面,差别无统计学意义(t值分别为-0.48、0.44,χ2值分别为0.01、4.20;均P>0.05)。观察组术中清扫的淋巴结个数较对照组少,差别有统计学意义(Z=-4.04,P<0.001)。两组的平均手术时间、平均术中出血量、平均术后住院时间、平均术后最高体温、平均术后通气时间和平均术后留置尿管时间均无明显差异(Z值分别为-1.20、-0.71、-1.40、-0.77、-0.72、-0.53,P>0.05)。两组患者术中、术后并发症的发生率无明显差异(P=0.72)。观察组51例患者术前接受同步放化疗,术前放化疗的总有效率为76.47%(39/51),其中CR率为23.53%(12/51),PR率为52.94%(27/51)。观察组和对照组的宫颈间质浸润深度阳性率分别为29.41%和94.00%、淋巴结转移阳性率分别为9.80%和28.00%、淋巴脉管浸润阳性率分别为1.96%和14.00%,差别有统计学意义(χ2分别为44.43、5.47,均P<0.05)。观察组和对照组术后接受补充放化疗的患者分别为20例和47例,差别有统计学意义(χ2=78.32,P<0.001)。在随访期内,观察组有50例患者存活,对照组有47例患者存活。两组患者的3年生存率分别为98.00%和92.80%,差别无统计学意义(χ2=1.16,P=0.28)。结论 机器人宫颈癌根治术用于治疗放化疗后局部晚期宫颈癌患者是安全可行的。该结论仍需大样本临床试验来证实。
机器人手术;宫颈癌根治术;局部晚期宫颈癌;术前放化疗
宫颈癌是妇科最常见的恶性肿瘤,严重威胁妇女的健康。由于定期妇科检查和宫颈癌筛查的普及率较低,多数患者发现时期别较晚。局部晚期宫颈癌广义上是指:宫颈癌国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期ⅠB2~ⅠVA期的宫颈癌;狭义上是指局部肿瘤最大直径≥4cm的早期宫颈癌(即IB2和IIA2期宫颈癌)。自1999年起,同步放化疗被认为是局部晚期宫颈癌的标准治疗方法,被广泛应用于治疗局部晚期宫颈癌患者;但其5年总生存率一直都维持在70%左右,并没有明显增高。近年来,术前放化疗逐步应用于临床。有研究报道了放化疗后行根治性子宫切除治疗局部晚期宫颈癌患者的临床病例,结果显示其无瘤生存率和总生存率均获益[1-3]。机器人手术系统是新一代的微创智能手术系统。自2005年被批准应用于妇科手术领域以来,机器人手术在妇科肿瘤中的应用得到了迅速发展。达芬奇机器人手术系统适用于需要复杂手术操作的宫颈癌根治术。但有研究表明,对于放化疗后的局部晚期宫颈癌患者,其宫旁组织发生纤维化、盆腔内纤维增生使组织粘连。这在一定程度上不利于组织的解剖分离,增加了手术的难度[4]。目前,关于机器人宫颈癌根治术用于放化疗后局部晚期宫颈癌的可行性研究相对较少。因此,本研究通过分析术前放化疗联合机器人宫颈癌根治术治疗局部晚期宫颈癌的临床疗效及其预后情况,来探究机器人宫颈癌根治术用于放化疗后局部晚期宫颈癌的安全性和可行性。
1资料与方法
1.1研究对象
选取2013年3月至2015年6月于西京医院妇产科行机器人宫颈癌根治术的ⅠB2~ⅡB期宫颈癌患者。观察组为术前接受过同步放化疗的ⅠB2~ⅡB期宫颈癌患者;对照组为术前未接受过辅助治疗的ⅠB2~ⅡB期宫颈癌患者。
1.2方法
1.2.1术前放化疗
全盆腔照射25次,2Gy/d,共计50Gy;同期行顺铂单药化疗或顺铂+紫杉醇联合化疗。放疗期间每周进行疗效评估。由两名副主任或以上医师行妇科检查并结合影像学资料,进行临床评估。评价标准参照世界卫生组织(World health organization,WHO)的实体瘤治疗评价标准(response evaluation criteria in solid tumors,RECIST)。分为完全缓解(complete response,CR):肿瘤完全消失;部分缓解(partial response,PR):肿瘤病灶长径总和缩小≥30%;疾病进展(progressive disease,PD):肿瘤病灶长径总和增加≥20%或出现新病灶;疾病稳定(stable disease,SD):肿瘤病灶长径总和缩小未达到PR或增加未达到PD。 由两名副高以上医师进行评估,当患者完全缓解或肿瘤体积缩小时,行机器人宫颈癌根治术。手术时间为放化疗后2~6周。
1.2.2手术适应症
包括:①宫颈癌病理诊断明确;②心肺功能良好可耐受手术;③无肝肾等重要脏器疾病;④无其他手术禁忌症。
1.2.3手术禁忌症
包括:①有严重内科疾病者;②不能耐受人工气腹或头低臀高位者;③大的腹疝及膈疝;④急性弥漫性腹膜炎。
1.2.4术式及术后处理
两组患者均行机器人辅助下广泛全子宫切除+盆腔淋巴结清扫±腹主动脉旁淋巴结清扫术。两组患者术后病理如有以上任意一个高危病理因素者(盆腹腔淋巴结阳性、宫旁侵犯、手术切缘阳性或淋巴脉管间隙浸润、宫颈深间质浸润≥0.5cm),术后需行补充放疗和(或)化疗。
1.2.5观察指标
①患者基本信息:年龄、体质指数(body mass index,BMI)、有无盆腹部手术史、临床分期、观察组接受放化疗后肿瘤体积变化情况;②术中指标:手术时间、术中出血量、术中是否输血、术中并发症、是否中转开腹;③术后指标:术后住院时间、术后病理结果、术后最高体温、术后胃肠及膀胱功能恢复情况、术后并发症情况、术后辅助治疗情况及生存复发情况;④术后病理:宫颈间质浸润深度、淋巴脉管间隙浸润、阴道切缘、宫旁浸润、盆腔淋巴结转移等。
1.2.6随访
治疗后对患者进行随访。随访以门诊随访和电话随访为主。随访内容包括妇科检查、盆腔B超、鳞状细胞相关抗原、宫颈细胞学检查、腹部B超、术后并发症等情况。所有患者随访时间截止2016年12月7日。
1.3统计学方法
采用SPSS 17.0统计软件进行数据分析。正态分布的计量资料用均数±标准差表示,组间比较用t检验;非正态分布的计量资料用中位数、最大值和最小值表示,组间比较用Mann-WhitneyU检验。计数资料用χ2检验或Fisher确切概率法。用Kaplan-Meier法计算生存率,用log-rank检验比较两组间生存率。规定P<0.05差别有统计学意义。
2结果
2.1患者一般临床资料
本研究共纳入了FIGO分期为ⅠB2~ⅡB期的宫颈癌患者101例,所有患者均接受了机器人辅助下广泛全子宫切除+盆腔淋巴结清扫术±腹主动脉旁淋巴结清扫术。术前接受过放化疗的患者为观察组,共有51例;术前未接受放化疗的患者为对照组,共有50例。两组患者的基本临床资料如表1。由表1可知,两组在年龄、BMI、盆腹腔手术史和病理类型方面,差别无统计学意义(P>0.05)。两组在临床分期上存在差异:观察组中ⅡB期患者占25.49%,对照组中无ⅡB期患者,观察组患者的期别较对照组晚(P<0.001)。观察组接受术前放化疗后,12例CR患者,27例PR患者,SD患者12例,无PD患者。术前同步放化疗的总有效率为76.47%(39/51),其中CR率为23.53%(12/51),PR率为52.94%(27/51)。
2.2两组患者术中、术后临床资料
所有手术均顺利完成,无一例中转开腹,均无需术中输血。两组在手术时间、术中出血量、术中输血率、术后通气时间、术后留置尿管时间、术后最高体温和术后住院时间方面的差异均无统计学意义(P>0.05)。对照组术中清扫的淋巴结个数多于观察组,差别有统计学意义(P<0.001),见表2。



项目观察组(n=51)对照组(n=50)t/χ2P年龄(岁)46.37±8.4147.20±8.97-0.480.63BMI(kg/m2)22.8±3.4122.51±2.860.440.66FIGO分期16.87<0.001 ⅠB219(37.25)33(66.00) ⅡA219(37.25)17(34.00) ⅡB13(25.49)0病理类型4.200.09* 鳞癌50(98.04)45(90.00) 腺癌04(8.00) 其他1(1.96)1(2.00)盆腹腔手术史24(47.06)23(46.00)0.010.92
注:*P值为Fisher确切概率法所得。


Table 2 Comparison of intraoperative and postoperative clinical data between two ±S,n(%)]
注:#P为值为Mann-WhitneyU检验。
2.3两组术中、术后并发症
两组患者手术均顺利完成,术中均未出现血管、膀胱、输尿管、肠道等损伤,无术中大出血发生。观察组有1例患者术后残端愈合不良,经内科治疗后好转;2例患者术后出现肾积水。对照组有2例患者术后有下肢静脉血栓形成,1例患者经内科治疗后血栓消失;还有2例患者术后出现肾积水,其中1例行双肾“J”管置入。两组患者的并发症的发生率也无明显差异(P=0.72)。
2.4.两组患者术后病理情况比较
两组患者术后阴道切缘均为阴性。观察组宫颈间质浸润深度≥0.5cm的病例有15例(29.41%),对照组有47例(94.00%),差别有统计学意义(P<0.001);观察组患者均无宫旁浸润,对照组有3例(6.00%)患者有宫旁浸润,差别无统计学意义(P=0.12);观察组有1例(1.96%)患者出现淋巴脉管浸润,对照组有7例(14.00%)淋巴脉管浸润,差别有统计学意义(P=0.03);观察组有5例(9.80%)有淋巴结转移,对照组有14例(28.00%)出现淋巴结转移,差别有统计学意义(P=0.02),见表3。
2.5两组患者术后辅助治疗情况
本研究纳入的101例局部晚期宫颈癌患者中,有67例需术后补充放化疗。其中,观察组有18例患者术后接受了补充化疗,2例接受了补充放化疗;对照组有2例患者术后接受了补充放疗,4例接受补充化疗,41例接受补充放化疗。两组在术后辅助治疗方面的差别有统计学意义(P<0.001),见表4。
表3 两组术后病理资料[n(%)]
Table 3 Pathologic data of patients in two groups[n(%)]

项目观察组(n=51)对照组(n=50)χ2P宫颈间质浸润深度44.43<0.001 <0.5cm36(70.59)3(6.00) ≥0.5cm15(29.41)47(94.00)宫旁浸润0.12* 阳性03(6.00) 阴性51(100.00)47(94.00)脉管浸润0.03* 阳性1(1.96)7(14.00) 阴性50(98.04)43(86.00)盆腔淋巴结转移5.470.02 阳性5(9.80)14(28.00) 阴性46(90.20)36(72.00)切缘阳性00-
注:*P值为Fisher确切概率法所得。
2.6随访情况
截止2016年12月7日,本研究共随访到92例患者。其中共失访9例,失访率为9.78%。观察组5例患者失访,对照组4例患者失访。观察组和对照组的平均随访时间分别为31.50(17~44)月和28.50(17~44)月。在随访期内,观察组有5例患者复发,其中1例患者于术后16个月死于复发。对照组有7例复发,其中1例因术后未按要求追加放疗于术后23个月死于复发,2例患者分别于术后15个月、21个月死于复发。两组患者的复发率无明显差异(P=0.73)。两组患者的死亡率也无明显差异(P=0.36)。在随访期内,观察组有50例患者存活,对照组有47例患者存活。观察组和对照组的3年总生存率分别为98.00%和92.80%,差别无统计学意义(P=0.28)。
表4 两组术后随访结果[n(%)]
Table 4 Follow-up results of patients in two groups[n(%)]
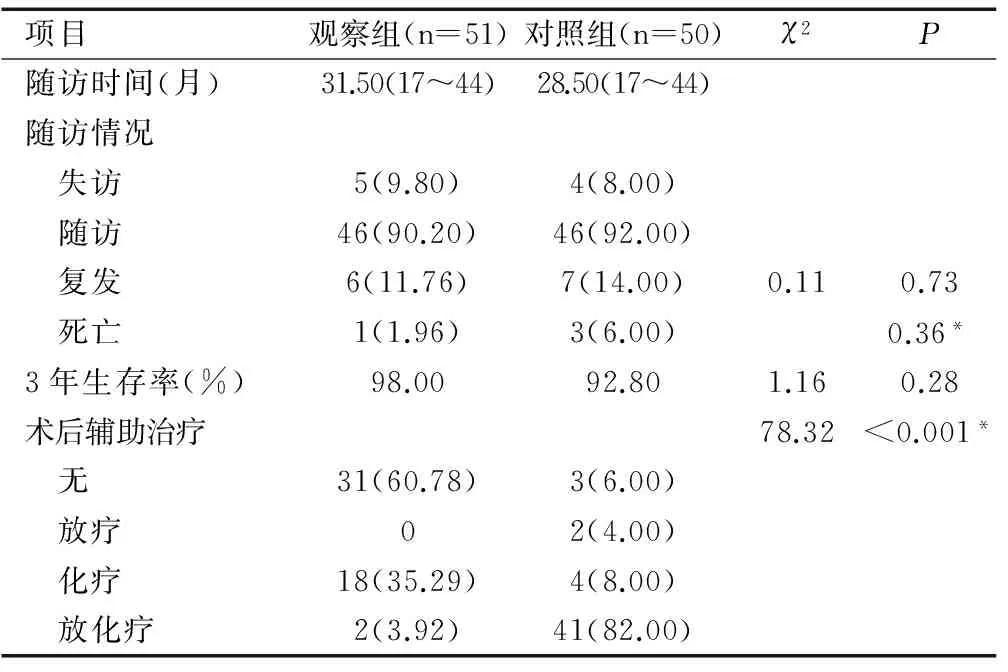
项目观察组(n=51)对照组(n=50)χ2P随访时间(月)31.50(17~44)28.50(17~44)随访情况 失访5(9.80)4(8.00) 随访46(90.20)46(92.00) 复发6(11.76)7(14.00)0.110.73 死亡1(1.96)3(6.00)0.36*3年生存率(%)98.0092.801.160.28术后辅助治疗78.32<0.001* 无31(60.78)3(6.00) 放疗02(4.00) 化疗18(35.29)4(8.00) 放化疗2(3.92)41(82.00)
注:*P值为Fisher确切概率法所得。
3讨论
宫颈癌是女性常见的恶性肿瘤之一,其发病率仅次于乳腺癌,是最常见的女性生殖系统恶性肿瘤。早期宫颈癌以手术为主,宫颈癌根治术是其主要术式。局部晚期宫颈癌是一类具有高危因素的宫颈癌,易复发和转移,5年生存率低。同步放化疗是局部晚期宫颈癌的标准治疗方法,但其疗效并不十分理想。因此,局部晚期宫颈癌的治疗一直是国内外专家关注的热点。近年来,国内外专家着眼于探索放疗、化疗联合手术治疗的综合疗法用于局部晚期宫颈癌患者的临床疗效。最近一项研究探讨了术前放化疗联合开腹宫颈癌根治术治疗局部晚期宫颈癌患者的临床疗效,其结果表明术前放化疗联合开腹宫颈癌根治术治疗局部晚期宫颈癌是安全可行的[5]。
达芬奇机器人手术系统是近年发展起来的新一代的微创智能手术系统。其高清三维立体图像可以更清楚直观的显示患者体腔内精细的解剖结构;其可转腕操作臂更有利于术者在狭小空间进行分离解剖操作;其人手除颤系统和人工力学设计可以减少手术操作过程中非技术性失误发生的概率。机器人手术系统的这些优势更有利于手术医生在盆腔这种狭窄解剖空间进行手术操作,也更利于手术医生对放化疗后的组织进行手术操作。最近的一项Meta分析表明:对于早期宫颈癌患者,机器人根治性子宫切除优于开腹手术,其术中出血少、术中并发症发生率低、中转开腹率低、住院时间短[6-7]。此外,有研究比较了开腹和机器人手术用于新辅助化疗后局部晚期宫颈癌患者的临床疗效。其结果表明:两者的围手术期指标和肿瘤结局相似[8-9]。
3.1观察组患者放化疗敏感性及两组患者病理情况比较
本研究中有51例患者行术前放化疗,其中12例患者完全缓解,27例患者部分缓解,总体有效率达76.47%。结果表明术前放化疗缩小了局部晚期宫颈癌患者的局部肿瘤病灶体积,降低了其手术的期别,给更多的局部晚期宫颈癌患者带来了手术机会。此外,盆腔淋巴结的转移与否、间质浸润深度等是影响宫颈癌预后的重要因素。有研究表明,术前放化疗可降低盆腔淋巴结的转移[10]。本研究表3比较了两组患者术后病理诊断的结果,观察组的宫颈间质浸润深度、脉管浸润阳性率和淋巴结转移阳性率均低于对照组(P<0.05)。这表明术前放化疗或可改善宫颈癌患者的预后。 所以对于局部晚期宫颈癌,可采用放疗、化疗联合机器人宫颈癌根治术的综合治疗方法。
3.2两组患者术中、术后情况比较
有研究认为:术前放化疗会使宫旁组织纤维化、盆腔内纤维增生、组织粘连。这不仅增加了手术难度,还有可能会增加治疗相关的并发症[4]。本研究比较了机器人宫颈癌根治术用于放化疗后局部晚期宫颈癌患者和非放化疗后局部晚期宫颈癌患者的临床疗效。由表1、2可知,虽然观察组较对照组的期别晚,但两组在手术时间、术中出血量、术中输血率、术后通气时间、术后留置尿管时间、术后最高体温和术后住院时间方面均无明显差别(P>0.05);观察组切除的淋巴结个数较对照组少(P<0.05);两组的术中和术后并发症发生率也无明显差异(P=0.72)。由此可知,术前放化疗并未使手术时间、手术相关损伤和术后患者的恢复时间增加。至少对于本研究中的机器人宫颈癌根治术来说,术前放化疗并未增加手术相关的损伤和并发症。由此说明,机器人宫颈癌根治术用于放化疗后局部晚期宫颈癌是安全可行的。本研究结果与最近Gallotta等[11]进行的一项前瞻性的Ⅱ期临床试验的结果一致。
本研究还比较了机器人宫颈癌根治术用于放化疗后和非放化疗后局部晚期宫颈癌的术后辅助治疗情况。观察组术后有20例患者接受补充放化疗治疗,对照组术后有47例患者接受补充放化疗,两组间的差别有统计学意义(P<0.05)。由此可知术前放化疗联合机器人宫颈癌根治术能使一部分患者免于术后补充放化疗。
3.3两组患者术后随访情况
在随访期内,观察组患者的肿瘤复发率为11.76%,总死亡率为1.96%;对照组患者的肿瘤复发率为14.00%,总死亡率为6.00%;差别均无统计学意义(P>0.05)。由表4可知,观察组和对照组的3年总生存率分别为98.00%和92.80%,差别无统计学意义(P=0.28)。虽然如此,本研究术前放化疗联合机器人手术治疗组的复发率为11.76%,这与之前文献报道的结果一致[8]。考虑到随访时间尚短,该结果仍需进一步的随机对照研究来证实。
综上所述,对于局部晚期宫颈癌,可采用放疗、化疗联合机器人宫颈癌根治术的综合治疗方法。机器人宫颈癌根治术用于放化疗后局部晚期宫颈癌是安全可行的。但该结果仍需大样本的临床研究来证明。
[1]Wei L C, Wang N, Shi M,etal. Clinical outcome observation of preoperative concurrent chemoradiotherapy/radiotherapy alone in 174 Chinese patients with local advanced cervical carcinoma[J]. Onco Targets Ther,2013,6:67-74.
[2]Kokka F, Bryant A, Brockbank E,etal. Hysterectomy with radiotherapy or chemotherapy or both for women with locally advanced cervical cancer[J]. The Cochrane Database of Systematic Reviews,2015(4):D10260.
[3]Monnier L, Touboul E, Darai E,etal. Stage IB2, IIA and IIB cervical carcinoma without lymph node extension treated with neoadjuvant chemoradiotherapy[J]. Bull Cancer,2016,103(2):164-172.
[4]Leguevaque P, Motton S, Delannes M,etal. Completion surgery or not after concurrent chemoradiotherapy for locally advanced cervical cancer?[J]. Eur J Obstet Gynecol Reprod Biol,2011,155(2):188-192.
[5]Ferrandina G, Ercoli A, Fagotti A,etal. Completion Surgery After Concomitant Chemoradiation in Locally Advanced Cervical Cancer: A Comprehensive Analysis of Pattern of Postoperative Complications[J]. Annals of Surgical Oncology,2014,21(5):1692-1699.
[6] Shazly S A, Murad M H, Dowdy S C,etal. Robotic radical hysterectomy in early stage cervical cancer: A systematic review and meta-analysis[J]. Gynecol Oncol,2015,138(2):457-471.
[7] Sert B M, Boggess J F, Ahmad S,etal. Robot-assisted versus open radical hysterectomy: A multi-institutional experience for early-stage cervical cancer[J]. European Journal of Surgical Oncology (EJSO),2016,42(4):513-522.
[8]Lambaudie E, Narducci F, Bannier M,etal. Role of robot-assisted laparoscopy in adjuvant surgery for locally advanced cervical cancer[J]. Eur J Surg Oncol,2010,36(4):409-413.
[9]Zanagnolo V, Minig L, Cardenas-Rebollo J M,etal. Robotic Versus Open Radical Hysterectomy in Women With Locally Advanced Cervical Cancer After Neoadjuvant Chemotherapy: A Single-institution Experience of Surgical and Oncologic Outcomes[J]. J Minim Invasive Gynecol,2016,23(6):909-916.
[10]Favero G,Pierobon J,Genta M L,etal.Laparoscopic extrafascial hysterectomy (completion surgery ) after primarychem oradiation in patients with locally advanced cervical cancer:technical aspects and operative outcomes[J].Int J Gynecol Cancer,2014,24(3):608-614.
[11]Gallotta V, Chiantera V, Conte C,etal. Robotic Radical Hysterectomy After Concomitant Chemoradiation in Locally Advanced Cervical Cancer: A Prospective Phase II Study[J]. J Minim Invasive Gynecol,2017,24(1):133-139.
[专业责任编辑: 安瑞芳]
Feasibility study of robot-assisted radical hysterectomy in locally advanced cervical cancer after chemoradiotherapy
MA Rui, MA Jia-jia, LI Na, ZHOU Fu-xing, LIU Hai-xia, LUO Tian-ai, SUN Xiao-xia, CHEN Bi-liang
(DepartmentofObstetricsandGynecology,XijingHospital,FourthMilitaryMedicalUniversity,ShaanxiXi’an710032,China)
Objective To explore the security and feasibility of robot-assisted radical hysterectomy (RRH) in patients with locally advanced cervical cancer (LACC) after chemoradiotherapy. Methods The clinical data of 101 LACC patients stagedⅠB2-ⅡB by International Federation of Gynecology and Obstetrics receiving RRH at Xijing Hospital of Fourth Military Medical University during March 2013 and June 2015 were selected. According to whether treated with preoperative chemoradiotherapy, they were divided into two groups. Totally 51 patients with preoperative chemoradiotherapy were divided into observation group, while 50 patients without receiving any adjuvant therapy before operation were divided into control group. RRH was performed for all patients. The operative time, intraoperative blood loss, postoperative hospital stay, intraoperative and postoperative complications, postoperative pathologic data, postoperative complementary chemoradiotherapy and recurrence survival were analyzed and compared between two groups. The clinical efficacy of preoperative chemoradiotherapy in the observation group was analyzed statistically. Results There was no significant difference in age, BMI, pelvic surgery history and pathological staging between two groups (tvalue was -0.48 and 0.44,χ2value was 0.01 and 4.20, respectively, allP>0.05). The number of lymph nodes dissected during operation in the observation group was less than that in the control group, and the difference was statistically significant (Z=-4.04,P<0.001). There was no significant difference in mean operative time, mean intraoperative blood loss, mean postoperative hospital stay, mean postoperative highest temperature of patients, mean postoperative ventilation time and mean postoperative catheter indwelling time (Zvalue was -1.20, -0.71, -1.40, -0.77, -0.72 and -0.53, respectively, allP>0.05). There was no significant difference in incidence of intraoperative and postoperative complications between two groups (P=0.72*). The total effective rate of preoperative chemoradiotherapy was 76.47% (39/51), including 23.53% in CR rate (12/51) and 52.94% in PR rate (27/51). The positive rates of cervical interstitial infiltration in the observation group and the control group were 29.41% and 94.00%, respectively. The positive rates of lymph node metastasis were 9.80% and 28.00%, respectively. The positive rates of lymphatic vessel infiltration were 1.96% and 14.00%, respectively. The differences were statistically significant (χ2value was 44.43 and 5.47, respectively, bothP<0.05). The number of patients accepting postoperative complementary chemoradiotherapy in the observation group and the control group were 20 and 47, respectively with significant difference (χ2=78.32,P<0.001). During the follow-up period, there were 50 patients survived in the observation group, while in control group there were 47 survived patients. The three-year survival rates of two groups were 98.00% and 92.80%, respectively. The difference was not statistically significant (χ2=1.16,P=0.28). Conclusion RRH in treatment of LACC is safe and feasible. The conclusion still needs a large sample of clinical trials to confirm.
robot-assisted surgery; radical hysterectomy; locally advanced cervical cancer (LACC); preoperative chemoradiotherapy
2017-03-05
西京医院临床高新技术基金资助项目(XJGX13LZ04)
马 芮(1991-),女,在读研究生,主要从事妇科肿瘤研究。
陈必良,主任医师
10.3969/j.issn.1673-5293.2017.05.004
R711.7
A
1673-5293(2017)05-0498-04

