人成体神经干细胞长期培养后遗传稳定性研究
陈世明,章瑾,王卓然,宣丹英,毛钟鸣,陈鹏翾
人成体神经干细胞长期培养后遗传稳定性研究
陈世明,章瑾,王卓然,宣丹英,毛钟鸣,陈鹏翾
神经干细胞因具有自我更新、增殖和多向分化潜能[1],神经干细胞移植已成为治疗神经系统的损伤和神经退行性疾病的新方法[2-5]。但神经干细胞的体外培养仍存在许多技术难点,培养过程中细胞易分化或凋亡,难以长期培养[6]。且培养过程中易产生遗传漂变、微生物污染、细胞交叉污染等问题[7]。培养传代时,一般使用化学性酶,如胰蛋白酶等分离神经干细胞球,酶的多次使用对长期培养的神经干细胞可能产生累积损伤[8-11]。因此,经体外长期培养后神经干细胞的增殖分化能力,尤其是遗传信息稳定性依然未知。我们以物理方法切割分离神经干细胞球,并改良了神经干细胞培养液,成功实现神经干细胞的体外长期培养[12]。但该方法是否存在遗传不稳定性仍需要进行研究。本文通过对体外传代培养不同时间的神经干细胞进行短串重复序列(STR)分析和端粒酶活性鉴定,为神经干细胞的体外长期培养的遗传稳定性提供实验依据。
1 材料和方法
1.1 材料
DMEM/F-12(1∶1)培养基购自美国 Hyclone 公司;人重组表皮细胞生长因子(rhEGF)、人重组碱性成纤维细胞生长因子(rhbFGF)、N2 Supplement 均购自美国 Gibco公司;16 位点 STR 试剂盒和 2800 M DNA 标准品购自美国 Promega 公司;TeloTAGGG 端粒酶 PCR-ELISA 试剂盒购自瑞士罗氏公司;巢蛋白购自武汉博士德生物工程有限公司。
1.2 方法
1.2.1 神经干细胞培养 取流产胎儿脑组织,在无菌条件下分离出海马组织,D-Hank’s 液清洗,眼科剪剪成小组织块,加入 0.25% 的 TP-EDTA 消化 10 min,胰酶抑制剂终止其消化。用 100 目不锈钢细胞过滤筛过滤,去除大组织块,离心收集沉淀细胞。将沉淀细胞重悬于神经干细胞培养基,制成单细胞悬液。经过细胞计数后以(1 ~ 2)× 106/ml接种到 T75 细胞培养瓶中。将细胞培养瓶置于 5% CO2、37 ℃ 培养箱中进行培养。每天观察细胞生长状态,3 ~ 4 d半量更换神经干细胞培养基一次。每月用自行研制的干细胞球切割器切割分离传代一次。
1.2.2 神经干细胞球及分化细胞观察 分别取神经干细胞球悬液滴于经多聚赖氨酸包被的盖玻片上,置 37 ℃ 培养箱中培养 24 h,使细胞黏附于载玻片上,倒置显微镜下观察结果并照相记录。
1.2.3 神经干细胞的 STR 分析法 按 STR 试剂盒说明书操作,检测体外培养 2、6、12 和 30 个月的神经干细胞的短串联重复序列。取 1 × 106个细胞经胰酶消化后,加入裂解液裂解,再加入平衡酚、氯仿、异戊醇提取 DNA,无水乙醇清洗后弃上清,经琼脂糖凝胶电泳鉴定后,对 PCR产物进行 STR 测序。
1.2.4 神经干细胞端粒酶活性检测 按端粒酶试剂盒说明书检测体外培养 2、6、12、24 个月的神经干细胞。空白对照为 DEPC 水,阴性对照选择 RNase 处理的神经母细胞瘤 IMR-32 细胞,阳性对照选择神经母细胞瘤 IMR-32 细胞及试剂盒提供的人肾细胞 293 冻干粉。取培养后的神经干细胞,胰酶消化,台盼蓝染色并计数。取约 2 × 105个细胞,加入裂解液裂解,孵育、离心后取上清进行端粒酶催化特异底物反应的 PCR。PCR 产物变性后按试剂盒要求用地高辛标记的特异探针杂交,而后用偶联过氧化物酶的抗地高辛抗体行 ELISA 反应,酶标仪测定 ELISA 结果(检测波长为 450 nm,参考波长为 690 nm)。测定值大于 0.25 为端粒酶阳性。
2 结果
2.1 神经干细胞球及分化细胞观察
传代培养 30 个月神经干细胞球形态见图 1,神经干细胞的分化细胞形态见图 2。

图 1 倒置显微镜下观察人神经干细胞球(× 100)
2.2 STR 分析
通过检测发现,2、6、12 和 30 个月培养的神经干细胞均有相同的短串连重复序列(表 1)。

图 2 神经干细胞球部分分化[A:经诱导分化的神经干细胞球(× 100);B:神经干细胞分化后的神经细胞(× 100);C:神经干细胞分化后的神经细胞(× 200);D:神经干细胞分化后的神经细胞(× 400)]

表 1 不同培养时间的神经干细胞短串连重复序列检测结果
2.3 端粒酶活性测定
结果(图 3)显示,阳性对照和 IMR-32 细胞具有较高的端粒酶活性。2、6、12、24 个月培养的神经干细胞均为阴性。
3 讨论
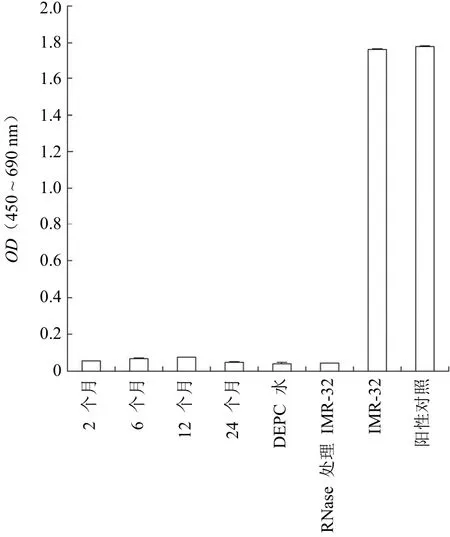
图 3 不同培养时间的神经干细胞端粒酶活性
神经干细胞在体外培养过程中极易分化,并发生微生物污染、细胞间交叉污染等问题,长期传代培养又易导致细胞遗传信息的漂移和变异[13],进而出现异常分化、基因不稳定和癌变等现象,因此,在神经干细胞培养过程中,对其遗传稳定性的检测尤为重要。实验中神经干细胞球的形态在30 个月内无明显变化。体外培养 30 个月后神经干细胞球分化后,可见典型神经元形态及星型胶质细胞形态,可判断此类细胞仍具有良好的增殖和分化能力。
短串联重复序列(STR)在遗传病及亲子鉴定等方面已广泛应用,但在细胞培养中,主要检测基因变异和细胞交叉污染[14]。通常情况下,每一个 STR 位点会被 5% ~ 20% 的人们所共有,理论上联合应用 16 个 STR 位点,其个体识别率可达 99.9999999998%。在细胞培养过程及 STR 过程中的微量 DNA 污染,会造成错误的实验结果。STR 检测过程中,DNA 样品提取纯化的质量、缓冲液的微小差异、离子强度、引物浓度等,甚至不同的热循环条件,都会引起实验结果的偏差。本实验通过对神经干细胞特殊基因位点进行多态性分析,不但检测了交叉污染情况,也能说明长期培养的遗传稳定性。实验结果表明,在神经干细胞体外培养的 30 个月时间内,Penta E、D18S51、D21S11、TH01、D3S1358,Penta D、CSF1PO、D16S539、D7S820、D13S317、D5S818,FGA、TPOX、D8S1179、vWA、Amelogenin 位点在不同时间段均具有相同的基因重复次数,可准确判断细胞具有稳定的遗传信息,且无任何交叉污染,各组之间并无遗传突变。
干细胞在自我更新、增殖分化、信号转导等方面与肿瘤细胞有着相似的生物学特征,尤其是在自我更新越频繁的组织中,干细胞自我更新越快,肿瘤发生率越高[15]。因此,在神经干细胞长期培养过程中,对其不同阶段的癌变可能性检测十分必要。而对细胞端粒酶的活性检测,不仅能满足以上要求,还能从侧面反应出细胞培养的稳定性。端粒重复序列扩增法(TRAP)的诞生及应用,大大提高了检测的敏感度,已成为端粒酶活性检测最常用的方法。端粒酶活性检测实验中,细胞的培养、使用细胞量、RNA 提取及 ELISA 反应条件,对实验结果均有影响。本实验结果中培养至 2、6、12、24 个月,神经干细胞的端粒酶活性均为阴性,而神经母细胞瘤 IMR-32 细胞具有较高的端粒酶活性。端粒酶能修复延长端粒,可以让端粒不会因细胞分裂而有所损耗,使得细胞分裂的次数增加。当端粒酶活性不足以抑制端粒长度的缩短,致使细胞丧失增殖能力[16]。Ostenfeld 等[17]研究表明,人神经干细胞的端粒较短,并随着细胞分裂进一步缩短,致使神经干细胞不能在体外长期传代。而肿瘤细胞端粒酶活性很高,每次肿瘤细胞分裂后缩短的端粒被端粒酶延长,致使细胞长期无限增殖。本实验结果中,神经干细胞经体外培养 12 ~ 24 个月后,端粒酶活性与之前各组并未显示显著差异,自我更新、增殖分化能力亦未见异常,可能与神经干细胞培养和传代的特殊方法有关,也可能与端粒酶测试方法的敏感度有关,具体原因有待进一步研究验证。
[1] Crane JF, Trainor PA. Neural crest stem and progenitor cells. Annu Rev Cell Dev Biol, 2006, 22:267-286.
[2] Lee JM, Bae JS, Jin HK. Intracerebellar transplantation of neural stem cells into mice with neurodegeneration improves neuronal networks with functional synaptic transmission. J Vet Med Sci, 2010, 72(8):999-1009.
[3] Sharma R, McMillan CR, Niles LP. Neural stem cell transplantation and melatonin treatment in a 6-hydroxydopamine model of Parkinson’s disease. J Pineal Res, 2007, 43(3):245-254.
[4] Bantubungi K, Blum D, Cuvelier L, et al. Stem cell factor and mesenchymal and neural stem cell transplantation in a rat model of Huntington’s disease. Mol Cell Neurosci, 2008, 37(3):454-470.
[5] Miltiadous P, Kouroupi G, Stamatakis A, et al. Subventricular zone-derived neural stem cell grafts protect against hippocampal degeneration and restore cognitive function in the mouse following intrahippocampal kainic acid administration. Stem Cells Transl Med, 2013, 2(3):185-198.
[6] Mellodew K, Suhr R, Uwanogho DA, et al. Nestin expression is lost in a neural stem cell line through a mechanism involving the proteasome and Notch signalling. Brain Res Dev Brain Res, 2004, 151(1-2):13-23.
[7] Mckay R. Stem cells in the central nervous system. Science, 1997, 276(5309):66-71.
[8] Chen SM. Detection of chromosome mutations//Zhang JT. Modern pharmacology experimental methods (part 2), Beijing: Beijing medical university and Pecking Union Medical College Joint Press, 1998:1864-1899. (in Chinese)陈世明. 染色体突变检测方法//张均田. 现代药理学实验方法(下册). 北京: 北京医科大学、中国协和医科大学联合出版社, 1998: 1864-1899.
[9] Chen SM, Zhang JT. Establishment of isolation and long-term culture of human embryonic brain neural stem cell (NSC) and discovery of a natural product (NP1) with the effects of promoting NSE cell proliferation//XIVth world congress of pharmacology - the new century of pharmacology. San Francisco, CA: American Society for Pharmacology and Experimetal Therapetutics, 2002:A128.
[10] Zheng ZH. Isolation, culture and identification of neural stem cells// Stem cell principle, technique and clinical. Zhao CH. Beijing: Chemical Industry Press, 2006:402-421. (in Chinese)郑志竑. 神经干细胞分离、培养与鉴定//赵春华. 干细胞原理、技术与临床. 北京: 化学工业出版社, 2006:402-421.
[11] Chen SM. Neural stem cells//Zhang JT, Zhang QZ. Techniques and methods of neural pharmacology. Beijing: People's Medical Publishing House, 2005:156-160. (in Chinese)陈世明. 神经干细胞//张均田, 张庆柱. 神经药理学研究技术与方法. 北京: 人民卫生出版社, 2005:156-160.
[12] Chen SM, Zhang J, Xuan DY, et al. A new method for the long culture of human neural stem cells. Chin Med Biotechnol, 2017, 12(2):189-192. (in Chinese)陈世明, 章瑾, 宣丹英, 等. 一种长期培养人神经干细胞的新方法.中国医药生物技术, 2017, 12(2):189-192.
[13] American Type Culture Collection Standards Development Organization Workgroup ASN-0002. Cell line misidentification: the beginning of the end. Nat Rev Cancer, 2010, 10(6):441-448.
[14] Masters JR, Thomson JA, Daly-Burns B, et al. Short tandem repeat profiling provides an international reference standard for human cell lines. Proc Natl Acad Sci U S A, 2001, 98(14):8012-8017.
[15] Domen J, Weissman IL. Hematopoietic stem cells need two signals to prevent apoptosis; BCL-2 can provide one of these, Kitl/c-Kit signaling the other. J Exp Med, 2000, 192(12):1707-1718.
[16] Bodnar AG, Ouellette M, Frolkis M, et al. Extension of life-span by introduction of telomerase into normal human cells. Science, 1998, 279(5349):349-352.
[17] Ostenfeld T, Caldwell MA, Prowse KR, et al. Human neural precursor cells express low levels of telomerase in vitro and show diminishing cell proliferation with extensive axonal outgrowth following transplantation. Exp Neurol, 2000, 64(1):215-226.
10.3969/j.issn.1673-713X.2017.03.015
310018 杭州,浙江奥瑞健生物技术有限公司
陈世明,Email:1279050771@qq.com
2017-02-03

