仿刺参溶菌酶在重组酿酒酵母中的表达
随 瑞 瑞, 沈 咪 娜, 李 成, 赵 钰, 车 明 月, 张 齐, 丛 丽 娜
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
仿刺参溶菌酶在重组酿酒酵母中的表达
随 瑞 瑞, 沈 咪 娜, 李 成, 赵 钰, 车 明 月, 张 齐, 丛 丽 娜
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
采用酿酒酵母MKP-0表达仿刺参溶菌酶蛋白(AjLys)。以质粒pMD18-AjLys为模板,PCR扩增将组氨酸标签His-tag克隆到AjLys基因的N末端,构建克隆载体pMD18-His6-AjLys。根据密码子偏好性,通过定点突变对AjLys蛋白第69、77和95位的3个精氨酸的密码子进行优化,得到克隆载体pMD18-His6-AjLys (Δ69,77,95)。经SpeⅠ/BglⅡ酶切,构建重组表达质粒pESC-LEU-His6-AjLys和pESC-LEU-His6-AjLys (Δ69,77,95)。基因工程菌pESC-LEU-His6-AjLys (Δ69,77,95)/MKP-0通过半乳糖诱导72 h后,Western Blot检测结果表明其成功表达了AjLys蛋白。抑菌实验结果表明,AjLys蛋白对溶壁微球菌具有一定的抑制作用。本实验成功构建了AjLys的酿酒酵母表达载体,并可在MKP-0细胞中表达了具有活性的AjLys蛋白,为AjLys的生产提供了一种具有可行性的新方法。
仿刺参;溶菌酶;酿酒酵母;密码子优化;表达
0 引 言
海洋无脊椎动物体内的i型溶菌酶是先天免疫系统中的重要防御因子[1-2]。研究发现,海参溶菌酶是一种具有糖苷酶活性和广谱、非酶抑菌活性的i型溶菌酶,能有效抑制其水产养殖过程中的有害细菌[3-4]。海参溶菌酶作为安全、无毒可替代抗生素的绿色生物制品,在海洋水产食品行业已经引起了广泛关注[5-6]。
通常,外源蛋白的表达主要采用原核表达系统,但是其存在的弊端不可忽视。目前,原核E.coli系统表达的具有抑菌活性的仿刺参溶菌酶[7-8],常沉淀成不溶性包涵体聚合物形式,纯化步骤烦琐。谷跃峰等[9]采用真核系统毕赤酵母表达了溶菌酶AjLys,但是,作为必需的诱导剂甲醇也会造成重要的毒副残留。
本实验将选择被认为是GRAS(generally recognized as safe)生物的酿酒酵母MKP-0细胞作为AjLys的表达宿主[10-11]。通过构建克隆质粒pMD18-His6-AjLys,将带有组氨酸标签的AjLys序列嵌入酿酒酵母表达载体得到pESC-LEU-His6-AjLys。同时,通过定点突变,对AjLys序列进行密码子优化,构建表达载体pESC-LEU-His6-AjLys (Δ69,77,95)。以期为以后实际生产在酿酒酵母中充分发挥仿刺参溶菌酶的活性提供理论支持。
1 材料与方法
1.1 材 料
1.1.1 菌种和质粒
大肠杆菌DH5α、溶壁微球菌(Micrococcuslysodeikticus),本实验室保存;酿酒酵母MKP-0菌株及其表达载体pESC-LEU均由大连工业大学生物工程学院于放教授馈赠;克隆载体pMD18-T,宝生物工程(大连)有限公司;全部引物由北京六合华大基因科技股份有限公司合成。
1.1.2 试 剂
限制性核酸内切酶、DpnⅠ酶、T4DNA连接酶、Taq DNA聚合酶、DNA Ladder Markers和Premixed Protein Marker (Broad)试剂,宝生物工程(大连)有限公司;PageRuler Prestained Protein Ladder,赛默飞世尔科技(中国)有限公司;KOD-Plus-Neo酶,东洋纺(上海)生物科技有限公司;质粒提取和琼脂糖凝胶电泳DNA回收试剂盒,天根生化科技(北京)有限公司;酵母蛋白质快速微量提取试剂盒,北京天恩泽基因科技有限公司;His-tag抗体、辣根过氧化物酶标记山羊抗小鼠IgG (H+L)和超敏ECL化学发光试剂盒,上海碧云天生物技术有限公司。
1.2 方 法
1.2.1 His6-AjLys基因扩增
本实验根据目的基因序列设计上下游引物。在上游引物的5′端引入SpeⅠ酶切位点(粗体标记)和6个组氨酸标签序列(His-tag)(粗线标记)。在下游引物3′端引入BglⅡ酶切位点(粗体标记)。序列如下:
AjLys上游引物P1:
5′-ACTAGTATGCACCATCATCATCATCATCAAGTTCCTTCTGATTGCCTA-3′;
AjLys下游引物P2:
5′-AGATCTTTAGTTGTTGCTCATGTCAAGACA-3′。
以pMD18-AjLys质粒为模板进行PCR扩增。反应条件为:94 ℃,5 min;94 ℃,30 s,60 ℃,30 s,72 ℃,1 min,30 cycles;72 ℃,10 min。1.5% 琼脂糖凝胶电泳检测产物。
1.2.2 构建克隆质粒pMD18-T-His6-AjLys
将扩增纯化后的AjLys片段通过T载体pMD18-T连接。Amp+抗性筛选阳性转化子,菌落PCR验证。反应条件:94 ℃,5 min;94 ℃,30 s,60 ℃,30 s,72 ℃,1 min,30 cycles;72 ℃,10 min。提取质粒,电泳检验后测序(委托北京六合华大基因科技股份有限公司)。
1.2.3 酿酒酵母密码子偏好性分析
根据Codon Usage Analyzer在线密码子分析软件,解析出仿刺参溶菌酶基因在酿酒酵母宿主中翻译时使用频率较低的密码子。
1.2.4 AjLys基因序列的密码子优化
对AjLys的精氨酸进行密码子优化(优化后的密码子用粗体表示),引物见表1。


表1 密码子优化设计的引物
以质粒pMD18-T-His6-AjLys为模板进行定点突变。PCR反应条件:94 ℃,2 min;98 ℃,10 s,60 ℃,30 s,68 ℃,90 s,30 cycles;68 ℃,7 min。DpnⅠ酶切反应体系中的质粒模板后,转化感受态细胞。得到密码子优化后的克隆载体pMD18-T-His6-AjLys (Δ69,77,95)。
1.2.5 构建酿酒酵母重组表达质粒
将pMD18-T-His6-AjLys,pMD18-T-His6-AjLys (Δ69,77,95)和酿酒酵母的表达载体pESC-LEU,用限制性内切酶SpeⅠ/BglⅡ酶切,回收纯化His6-AjLys、His6-AjLys (Δ69,77,95)片段和载体pESC-LEU线性化大片段。分别将这两个目的基因片段和载体连接,筛选具有Amp+抗性的阳性重组质粒,再进行酶切验证。将测序正确的重组质粒进行制备,用于酿酒酵母细胞转化。
1.2.6 重组表达质粒转化酿酒酵母MKP-0菌株
醋酸锂法制备酿酒酵母MKP-0感受态细胞,42 ℃热击转化重组表达质粒pESC-LEU-His6-AjLys和pESC-LEU-His6-AjLys (Δ69,77,95)[12-13]。通过亮氨酸营养缺陷型的SD固体选择培养基(SD-Leu-)筛选转化子。以P1和P2为引物对进行菌落PCR,电泳鉴定结果[14]。
1.2.7 AjLys蛋白的表达及Western Blot检测
挑取阳性转化子,接种于SD-Leu-基本选择培养基,30 ℃、230 r/min摇床振荡活化。摇瓶发酵48 h后,离心收集菌体。菌体用生理盐水清洗3次后,转入等体积的同样诱导培养基,以2%半乳糖诱导目的蛋白表达。诱导72 h后,收集菌体提取蛋白进行Western Blot检测。其中,酿酒酵母细胞通过酵母蛋白快速微量提取试剂盒进行操作,制得蛋白样品。选取未转入质粒的MKP-0作为阴性对照。
将提取的总蛋白进行13.5% SDS-PAGE电泳后,转至PVDF膜上,用含10%的脱脂奶粉的TBST缓冲液室温摇床上振荡封闭2 h。加入1∶2 000稀释的His-tag抗体,室温摇床上振荡1 h后,4 ℃平放过夜反应。1∶2 000稀释的辣根过氧化物酶标记山羊抗小鼠IgG (H+L),室温摇床上振荡孵育1 h后,再重复充分洗膜。加入超敏ECL化学发光试剂,暗室下胶片显影5 min后曝光观察蛋白表达情况。
1.2.8 AjLys蛋白抑菌活性分析
抑菌试验与实验室之前的研究方法类似[7-8],用牛津杯法测定抑菌效果。以溶壁微球菌为指示菌,取50 μL的指示菌液(OD600≈0.05),均匀涂抹在LB固体培养基上,再放入灭菌的牛津杯。将“1.2.7”中培养了72 h、经过酸洗玻璃珠剧烈振荡破壁的蛋白样品上清液,取200 μL加到牛津杯中过夜培养,检测抑菌效果。
2 结果与讨论
2.1 仿刺参AjLys基因的扩增及其克隆载体的构建
根据图1的实验方案,以pMD18-T-AjLys质粒为模板,进行质粒构建。琼脂糖凝胶电泳检测PCR产物,结果如图2所示,在400 bp附近有明显的条带,大小与目的基因(411 bp) 一致。
将His6-AjLys片段与pMD18-T连接,转化至E.coliDH5α细胞。质粒测序结果,AjLys片段与仿刺参溶菌酶的核苷酸序列(GeneBank号:EF036468.2)完全一致;同时,在AjLys片段N端加上的SpeⅠ酶切位点、起始密码子和6个组氨酸标签序列。结果表明,成功构建了仿刺参AjLys的克隆载体pMD18-T-His6-AjLys。
2.2 密码子优化
本实验通过研究酿酒密码子偏好性,发现仿刺参溶菌酶中用于编码精氨酸蛋白的密码子CGG在酿酒酵母系统中使用频率极低(<10%),将会严重影响酿酒酵母宿主对AjLys蛋白的表达。因此,在不改变氨基酸种类及顺序的前提下,对仿刺参溶菌酶基因编码精氨酸的CGG密码子进行优化(CGG→AGA)。

图1 重组质粒pMD18-T-His6-AjLys的构建流程
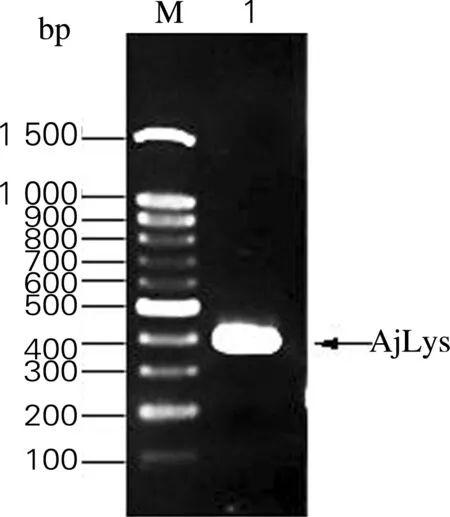
图2 琼脂糖凝胶电泳检测pMD18-T-His6-AjLys的构建结果
Fig.2 Agarose gel electrophoretic profile result of pMD18-T-His6-AjLys
以质粒pMD18-T-His6-AjLys为模板,依次对AjLys蛋白的第69、77和95位精氨酸进行定点突变,测序检测。结果表明,AjLys序列上的3个密码子成功突变,得到密码子优化后的克隆载体pMD18-T-His6-AjLys (Δ69,77,95)。
2.3 仿刺参溶菌酶酿酒酵母重组表达质粒的构建
根据图3的实验方案,将AjLys原序列及密码子优化后的AjLys (Δ69,77,95)序列分别连入酿酒酵母表达载体pESC-LEU。菌落PCR和双酶切验证阳性转化子。电泳结果如图4所示,PCR产物在约400 bp处出现明显条带(lane 1,2);质粒酶切后得到两条带,其中400 bp附近与AjLys大小一致,8 kb附近与pESC-LEU载体一致(lane 3,4)。结果表明,该溶菌酶重组表达质粒pESC-LEU-His6-AjLys及密码子优化后的重组质粒pESC-LEU-His6-AjLys (Δ69,77,95)构建成功。
2.4 重组表达质粒的转化及阳性转化子的筛选
将重组质粒pESC-LEU-His6-AjLys和pESC-LEU-His6-AjLys (Δ69,77,95)分别转化酿酒酵母MKP-0细胞筛选转化子,结果如图5所示。
电泳结果如图6所示,在约400 bp处有一条与AjLys片段大小相符的条带(lane 1,2),说明成功构建仿刺参溶菌酶的酿酒酵母表达系统MKP-0/pESC-LEU-His6-AjLys(图5(a))及MKP-0/pESC-LEU-His6-AjLys (Δ69,77,95) (图5(b))。
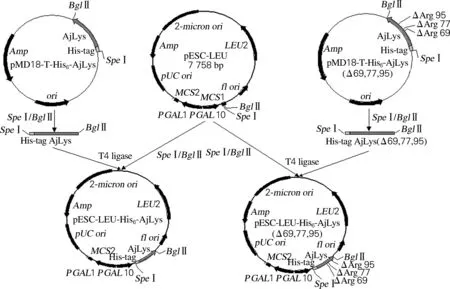
图3 重组质粒pESC-LEU-His6-AjLys及密码子优化后的重组质粒pESC-LEU-His6-AjLys (Δ69,77,95)的构建流程
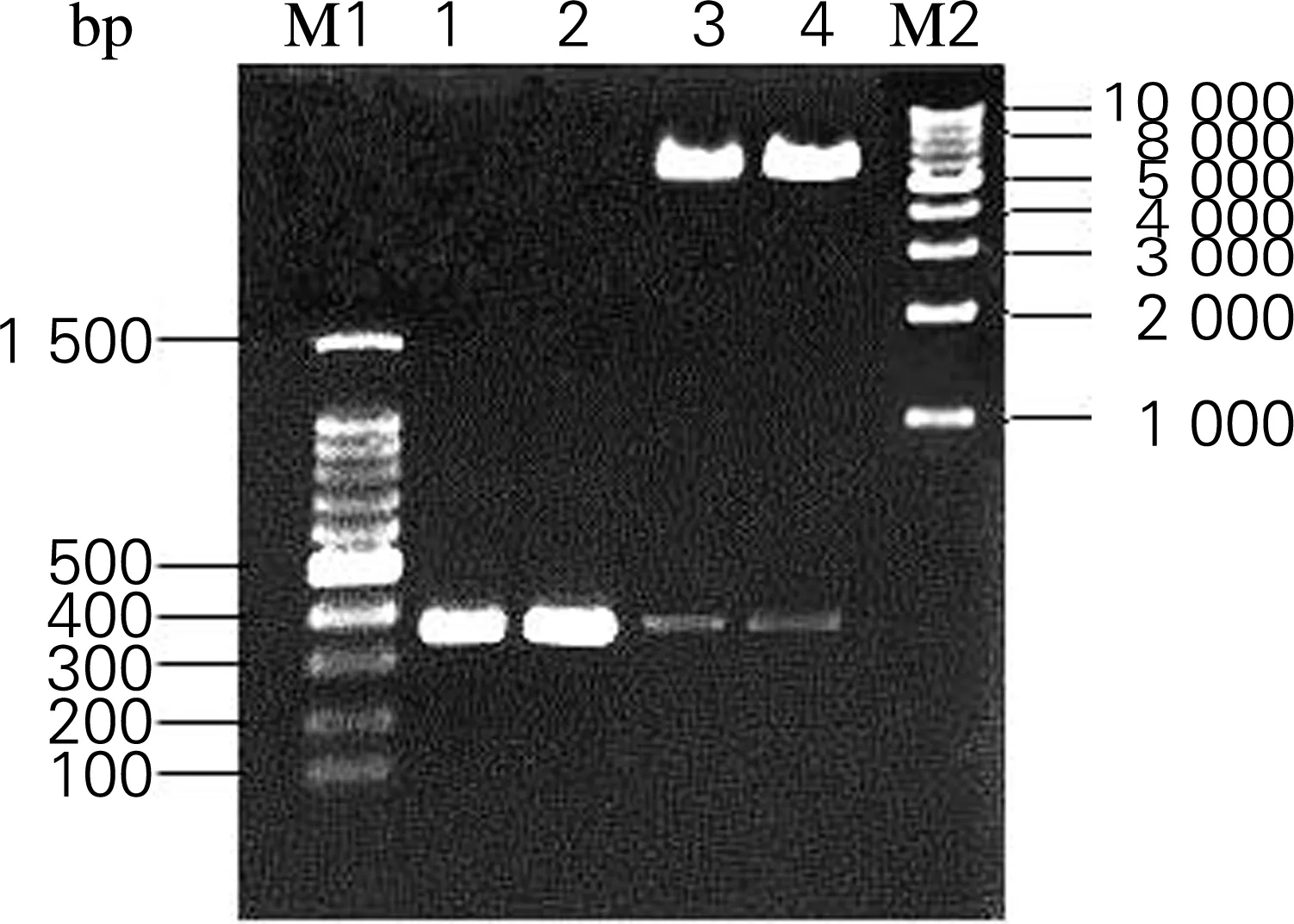
图4 琼脂糖凝胶电泳检测pESC-LEU-His6-AjLys及其密码子优化 (Δ69,77,95)质粒的构建结果
Fig.4 Agarose gel electrophoretic profile results of pESC-LEU-His6-AjLys and pESC-LEU- His6-AjLys (Δ69,77,95) after codon optimization
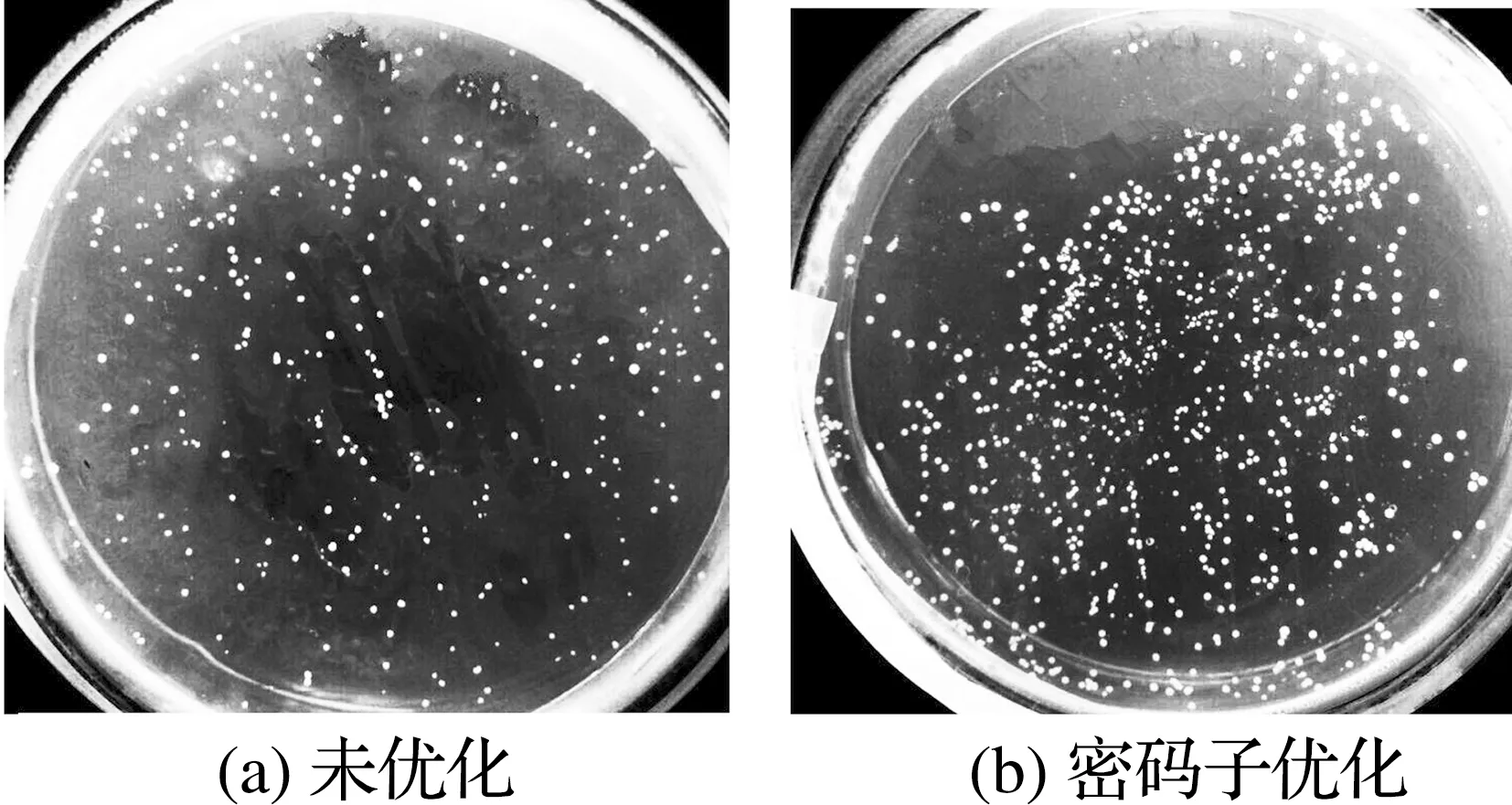
图5 转化子MKP-0/pESC-LEU-His6-AjLys(a)和MKP-0/pESC-LEU-His6-AjLys (Δ69,77,95)(b)在SD-Leu-平板上的筛选结果
Fig.5 Screening for transformants MKP-0/pESC- LEU-His6-AjLys (a) and MKP-0/pESC- LEU-His6-AjLys (Δ69,77,95) (b) on SD- Leu-plate
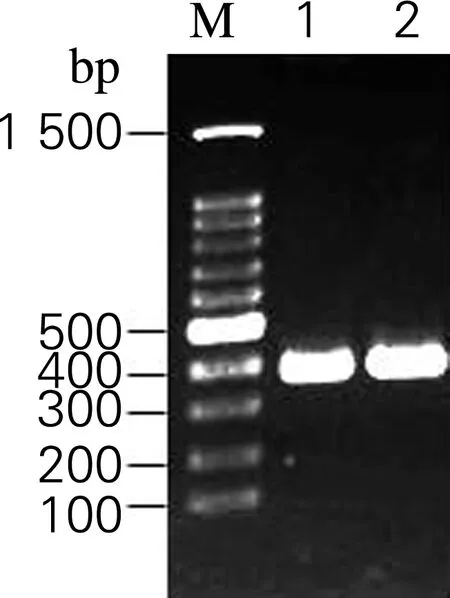
图6 琼脂糖凝胶电泳检测MKP-0/pESC-LEU-His6-AjLys and MKP-0/pESC-LEU-His6-AjLys (Δ69,77,95)转化子
Fig.6 Agarose gel electrophoretic profile of MKP-0/pESC-LEU-His6-AjLys and MKP-0/ pESC-LEU-His6-AjLys (Δ69,77,95) transformants
2.5 Western Blot检测AjLys蛋白的表达
Western Blot检测结果如图7所示。从图7可以看出,MKP-0/pESC-LEU-His6-AjLys (Δ69,77,95)诱导72 h后,在15 ku附近看到明显的蛋白条带(lane 3),说明酿酒酵母细胞MKP-0成功表达了仿刺参溶菌酶蛋白AjLys。与阴性对照(lane 1)相比,没有优化的表达系统(lane 2)没有目的蛋白表达。结果表明,增加酿酒酵母偏好使用的密码子,能显著地提高仿刺参溶菌酶基因的表达,说明异源基因表达时,宿主体系中低频率使用的密码子明显限制受体物种对外源基因表达,因此,对外源基因进行改造,以适应受体物种,是提高外源蛋白表达的一个重要途径。
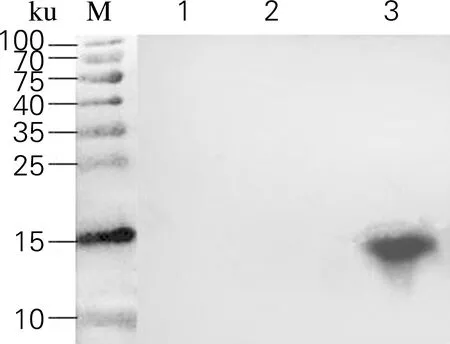
图7 Western Blot检测AjLys蛋白的表达
2.6 AjLys抑菌活性分析
采用牛津杯法测定重组仿刺参溶菌酶的抑菌活性,结果如图8所示。与未转入质粒的阴性菌株MKP-0和未经密码子优化的表达系统相比,经密码子优化的表达系统表达的蛋白对革兰氏阳性菌溶壁微球菌具有一定的抑菌作用。

1,阴性对照MKP-0;2,未经密码子优化的表达系统;3,经密码子优化的表达系统
图8 牛津杯法检测AjLys对溶壁微球菌的抑菌作用
Fig.8 The antimicrobial effect of AjLys onMicrococcuslysodeikticusdetected by Oxford cup
3 结 论
本实验采用酿酒酵母表达系统进行仿刺参溶菌酶AjLys的蛋白表达。通过对酿酒酵母密码子水平上的优化对AjLys基因进行改造,构建表达系统MKP-0/pESC-LEU-His6-AjLys (Δ69,77,95),成功表达了具有活性的仿刺参溶菌酶蛋白。
但是,本实验结果与天然的AjLys相比,在蛋白产量及抑菌活性上都存在很大差距[15]。影响此情况的因素有很多,如基因剂量、整合位点、mRNA 5′和3′非翻译区(UTR)、酿酒酵母菌的蛋白酶、培养的环境条件及自身胞内表达产物的加工和修饰等[10-11]。因此后续的实验可以通过完善培养条件,如半乳糖浓度、诱导时间、转数及温度等条件不断提高蛋白产量。今后还可以对AjLys目的基因整合到pESC-LEU载体的拷贝数、整合时AjLys两端的酶切位点、宿主菌中存在蛋白酶降解的相关基因的敲除作进一步研究。
[1] CALLEWAERT L, MICHIELS C W. Lysozymes in the animal kingdom[J]. Journal of Biosciences, 2010, 35(1): 127-160.
[2] 孙永欣,王吉桥,汪婷婷,等.海参防御机制的研究进展[J].水产科学,2007,26(6):358-361.
[3] CONG L N, YANG X J, WANG X X, et al. Characterization of an i-type lysozyme gene from the sea cucumberStichopusjaponicus, and enzymatic and nonenzymatic antimicrobial activities of its recombinant protein[J]. Journal of Bioscience and Bioengineering, 2009, 107(6): 583-588.
[4] RAMIREZ-GOMEZ F, ORTIZ-PINEDA P A, ROJAS-CARTAGENA C, et al. Immune-related genes associated with intestinal tissue in the sea cucumberHolothuiaglaberrima[J]. Immunogenetics, 2008, 60(1): 57-71.
[5] 陈艳,江明锋,叶煜辉,等.溶菌酶的研究进展[J].生物学杂志,2009,26(2):64-66.
[6] OLSEN Ø M, NILSEN I W, SLETTEN K, et al. Multiple invertebrate lysozymes in blue mussel (Mytilusedulis)[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2003, 136(1): 107-115.
[7] 王秀霞,丛丽娜,王丹.海刺参i-型溶菌酶基因的重组表达及抑菌谱分析[J].生物工程学报,2009,25(2):189-194.
[8] 常艺海,丛丽娜,卢冬,等.重组海参溶菌酶C端基因(SjLys-C)的可溶性表达和抑菌活性分析[J].农业生物技术学报,2012,20(4):443-450.
[9] 谷跃峰,丛丽娜,骆宁.海参溶菌酶基因克隆及在毕赤酵母中的表达与纯化[J].大连工业大学学报,2010,29(5):317-320.
[10] 唐香山,张学文.酿酒酵母表达系统[J].生命科学研究,2004,8(2):106-109.
[11] SAKAI A, OZAWA F, HIGASHIZAKI T. Enhanced secretion of human nerve growth factor fromSaccharomycescerevisiaeusing an advanced delta-integration system[J]. Biotechnology, 1991, 9(12): 1382-1385.
[12] 郝小夏.用醋酸锂法转化巴氏毕赤酵母表达人核心蛋白聚糖[J].山西医药杂志,2010,39(5):401-403.
[13] 房志家,陈婷,郝贺龙,等.酿酒酵母转化方法的新探索[J].实验室研究与探索,2012,31(4):5-8.
[14] 陈忠翔,房志家,陈婷,等.一种简单高效的酵母单菌落PCR方法[J].生物技术通讯,2013,24(2):225-229.
[15] 李英辉,丛丽娜,朱蓓薇.海参肠中溶菌酶的分离纯化及其酶学性质[J].大连工业大学学报,2008,27(3):193-196.
Expression ofApostichopusjaponicaslysozyme in recombinantSaccharomycescerevisiae
SUIRuirui,SHENMina,LICheng,ZHAOYu,CHEMingyue,ZHANGQi,CONGLina
(SchoolofBiologicalEngineering,DalianPolytechnicUniversity,Dalian116034,China)
Apostichopusjaponicuslysozyme (AjLys) was expressed bySaccharomycescerevisiae. The His-tag was inserted into the N terminus of AjLys gene based on pMD18-AjLys vector to construct the new plasmid pMD18-His6-AjLys. According to the analysis by Codon Usage Database inS.cerevisiae, AjLys gene was optimized by point mutation to obtain pMD18-His6-AjLys (Δ69, 77, 95) vector. The recombinant expression vectors pESC-LEU-His6-AjLys and pESC-LEU-His6-AjLys (Δ69, 77, 95) were constructed. AjLys protein was successfully expressed in the recombinant pESC-LEU-His6-AjLys (Δ69, 77, 95)/MKP-0 cell inducted by galactose, which was detected by Western Blot. The expressed AjLys protein displayed inhibitive effect on the growth of theMicrococcuslysodeikticus. The result showed that AjLys expression vector ofS.cerevisiaewas constructed successfully, and the active AjLys protein was expressed in MKP-0 cells, which provided a new method for the production of AjLys.
Apostichopusjaponicus; lysozyme;Saccharomycescerevisiae; codon optimization; expression
2015-12-23.
辽宁省教育厅一般科学研究项目(L2014217);辽宁省教育厅重点实验室项目(LZ2014029);辽宁省研究生教育创新计划项目(2014-154).
随瑞瑞(1990-),女,硕士研究生;通信作者:李 成(1985-),女,讲师.
TS254.1;Q556.2
A
1674-1404(2017)03-0162-06
随瑞瑞,沈咪娜,李成,赵钰,车明月,张齐,丛丽娜.仿刺参溶菌酶在重组酿酒酵母中的表达[J].大连工业大学学报,2017,36(3):162-167.
SUI Ruirui, SHEN Mina, LI Cheng, ZHAO Yu, CHE Mingyue, ZHANG Qi, CONG Lina. Expression ofApostichopusjaponicaslysozyme in recombinantSaccharomycescerevisiae[J]. Journal of Dalian Polytechnic University, 2017, 36(3): 162-167.

