星点设计-效应面法优化酮咯酸氨丁三醇缓释片处方
梁胜男,李晶欣,王中彦
星点设计-效应面法优化酮咯酸氨丁三醇缓释片处方
梁胜男1,李晶欣2,王中彦1*
(1. 沈阳药科大学药学院,辽宁沈阳 110016;2. 沈阳药科大学中药学院,辽宁沈阳 110016)
目的优化酮咯酸氨丁三醇缓释片处方,并对其进行体外释放度考察。方法采用羟丙甲基纤维素(HPMC)为骨架材料制备酮咯酸氨丁三醇缓释片,通过测定体外释放度,对HPMC黏度和用量、填充剂种类、润滑剂用量、制粒方法等因素进行筛选,在此基础上,结合星点设计-效应面法进行处方优化,并对模型进行验证。结果最佳处方为每片含酮咯酸氨丁三醇20 mg、HPMC K15M 45 mg、微晶纤维素10 mg、Starch1500 25 mg、微粉硅胶1 mg、硬脂酸镁1 mg,制备工艺为粉末直接压片。释药动力学符合Higuchi方程。结论采用星点设计-效应面法优化酮咯酸氨丁三醇缓释片处方,所建模型预测性良好。
药剂学;缓释片;星点设计-效应面法;酮咯酸氨丁三醇;体外释放
酮咯酸氨丁三醇(ketorolac tromethamine)是一种非甾体类强力止痛及中度抗炎解热药物,是治疗中度及剧烈疼痛的高效理想药物[1]。酮咯酸氨丁三醇通过抑制前列腺素(PG)的合成达到止痛、抗炎和镇痛作用,而非作用于阿片受体或激发体内阿片肽的释放,无成瘾性[2]。酮咯酸氨丁三醇在人体内转化为酮咯酸,酮咯酸能抑制花生四烯酸或胶原诱发的血小板聚集作用。给药途径主要有口服给药、静脉注射给药、肌肉注射给药和眼部给药。对于成人而言,其口服、肌内注射的生物利用度等同于静脉注射[3],吸收迅速(max<1.0 h),吸收率高(>87%)[4],半衰期为5.0~6.0 h。临床口服剂量为口服首次10~20 mg,后每4~6 h口服10 mg。制成缓释制剂可以实现药物的平稳释放,减少药物峰-谷现象带来的不良反应。因此,笔者采用亲水凝胶骨架材料制备了酮咯酸氨丁三醇(KT)缓释片,以体外释放度作为考察因素,对其处方工艺进行研究,结合星点设计-效应面法进行处方优化,并对其释药机制进行探讨。
1 仪器与材料
T-AⅡ单冲压片机(聊城万合工业制造有限公司),ACCULAB电子天平(赛多利斯科学仪器有限公司),XS205分析天平(梅特勒-托利多公司),ZRS-8G溶出试验仪(天津天大天发科技有限公司),UV-2201紫外-可见分光光度计(日本岛津公司)。
酮咯酸氨丁三醇(含量质量分数为100.2%,浙江车头制药股份有限公司,批号126781011),羟丙甲基纤维素K4M、K15M、K100M及Starch1500(上海卡乐康公司),乳糖(美国Foremost 公司),微晶纤维素 PH102(美国FMC公司),硬脂酸镁、微粉硅胶(安徽山河药用辅料有限公司)。
2 方法与结果
2.1 酮咯酸氨丁三醇缓释片的制备
将酮咯酸氨丁三醇、HPMC、MCC、Starch1500、微粉硅胶分别过(180±7.6) μm筛,备用。称取处方量的原料,再依次称取其他各辅料,混合均匀,直接压片,硬度控制在40~80 N,即得。
2.2 紫外分析方法的建立
2.2.1 检测波长的选择
精密称取酮咯酸氨丁三醇对照品适量,加纯化水配制成适宜浓度的样品溶液;另取处方量的辅料,加纯化水溶解后过滤,取续滤液作为空白辅料溶液。分别取上述2种溶液,在波长200~400 nm内进行紫外扫描。结果显示,酮咯酸氨丁三醇在波长323 nm处有最大吸收峰,空白辅料在此波长无吸收,对紫外检测无干扰,所以检测波长选择为323 nm。
2.2.2 标准曲线的建立
取酮咯酸氨丁三醇22 mg,精密称定,置于100 mL量瓶中,加水适量使溶解并稀释至刻度,摇匀,作为标准储备液。分别精密量取标准储备液1.0、2.0、3.0、5.0、6.0和7.0 mL置于100 mL量瓶中,加水稀释至刻度,摇匀,照《中华人民共和国药典》2015年版通则0401[5]38-40中的紫外分光光度法在波长323 nm处测定吸光度。以吸光度()对酮咯酸氨丁三醇质量浓度(,mg·L-1)进行线性回归,得标准曲线方程=5.32×10-2+5.7×10-3,=0.999 8(=6)。可见酮咯酸氨丁三醇溶液质量浓度在2~15 mg·L-1内与吸光度线性关系良好。
2.2.3 精密度试验
精密量取酮咯酸氨丁三醇标准储备液2.0、5.0和6.0 mL,分别置于100 mL量瓶中,加水稀释至刻度,摇匀,各质量浓度平行制备3份样品溶液。在波长323 nm处测定吸光度,计算相对标准偏差。结果低、中、高3种质量浓度的RSD分别为0.24%、0.17%和0.14%。
2.2.4 回收率试验
精密称取酮咯酸氨丁三醇10、16和20 mg各3份,分别置于1 000 mL量瓶中,再加入1片量的空白辅料,加水溶解并稀释至刻度,摇匀后过滤,弃去初滤液,取续滤液定量稀释,在波长323 nm处测定吸光度,计算回收率,结果见表1。
Tablet 1 Recovery of KT in releasemedium(=3)
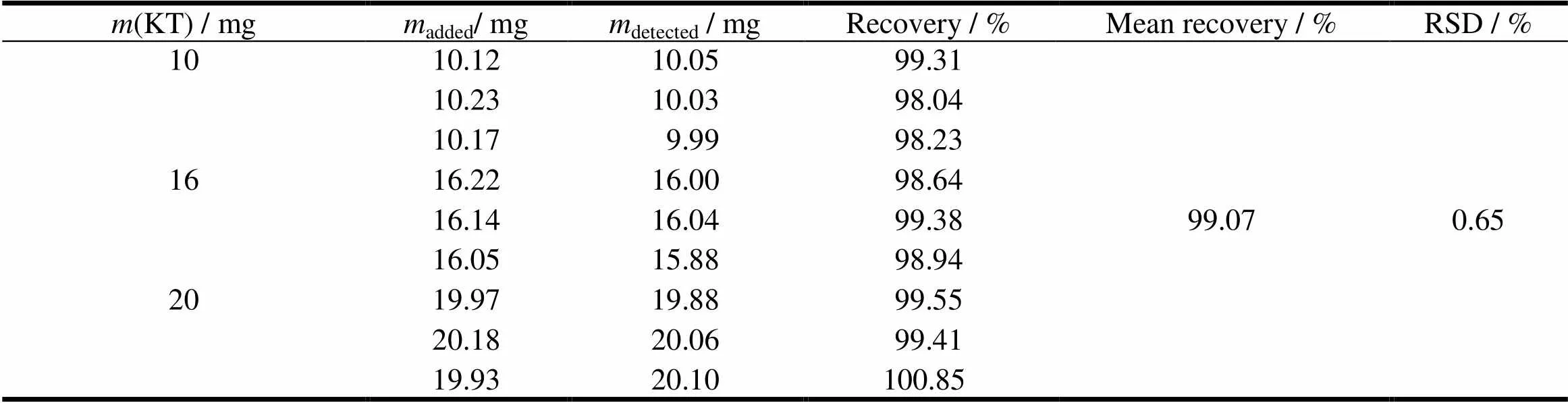
表1 酮咯酸氨丁三醇的释放度回收率结果 (n=3)
2.2.5 溶液稳定性试验
取“2.2.6”条下同一份供试溶液,分别放置0、2、4、8、12和24 h测定吸光度。结果RSD为0.37%,表明释放度供试溶液在24 h内稳定。
2.2.6 酮咯酸氨丁三醇缓释片释放度测定
取本品,照《中华人民共和国药典》2015年版通则0931第二法[5]121-124中的溶出度与释放度测定法,以水900 mL为溶出介质,转速为50 r∙min-1,依法操作,经1、2、4和8 h时,分别自溶出杯中取溶液10 mL,并即时补充同体积等温度溶出介质,将所取溶液滤过,取续滤液适量,作为供试溶液。另取酮咯酸氨丁三醇对照品适量,精密称定,加水溶解并定量稀释制成每1 mL中约含酮咯酸氨丁三醇11 μg的溶液,作为对照溶液。取供试溶液与对照溶液,照紫外分光光度法,在波长323 nm处分别测定吸光度,计算每片在不同时间的释放度。
2.3 单因素考察
2.3.1 HPMC黏度对药物释放的影响
分别选用3种不同黏度的HPMC(K4M、K15M和K100M),作为亲水凝胶骨架,用量为片质量的25%,其他辅料均相同,制备缓释片,测定释放度,释放曲线见图1。结果表明,HPMC黏度对释药速率影响不显著。根据文献报道,聚合物黏度增大到一定程度时,HPMC黏度的变化对水溶性药物的释放影响不大[6]。
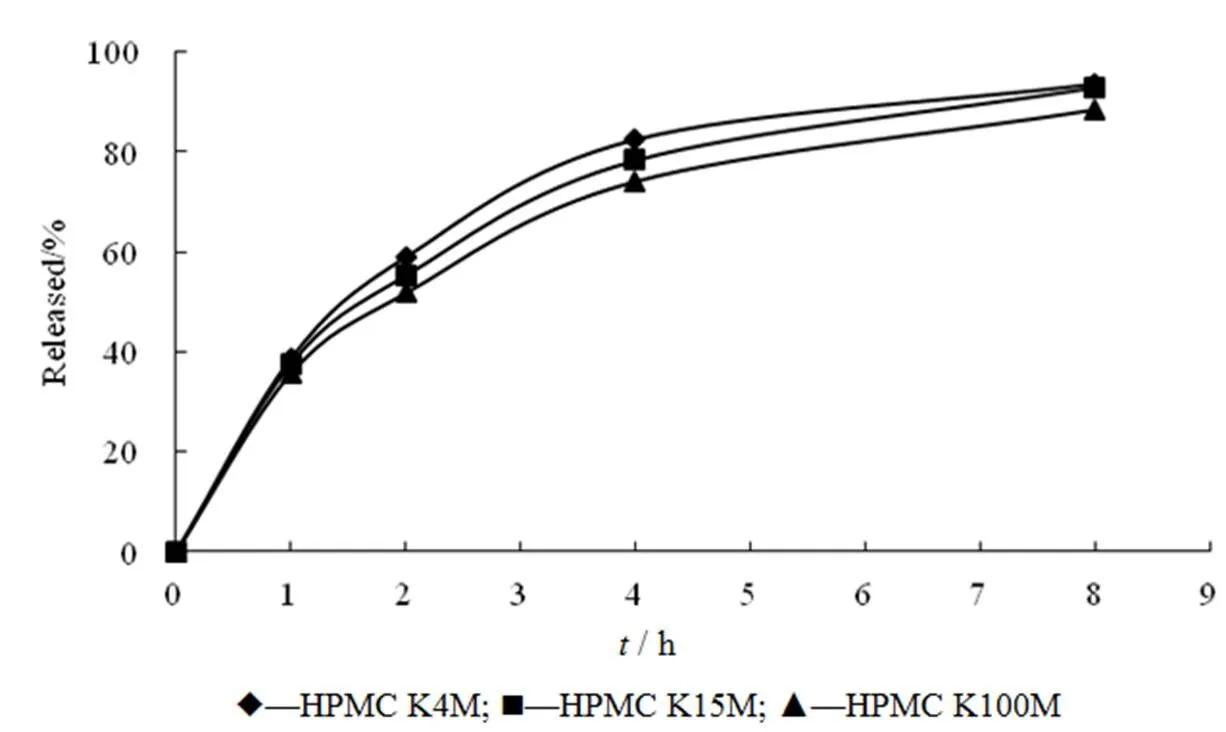
Fig. 1 The effect of theviscosityof HPMC on drug release
2.3.2 HPMC用量对药物释放的影响
选择HPMC K15M作为骨架材料,按主药和HPMC的质量比为1︰1、1︰2和1︰3,用MCC调节片质量,制备缓释片,考察HPMC用量对药物释放的影响,释放曲线见图2。结果表明,在所考察的范围内, HPMC用量对药物释放有显著性影响,随着HPMC用量的增大,药物的释放减慢;当片剂处方中HPMC用量较大时,进一步增大HPMC用量对降低药物的释放度虽有一定影响,但药物的释放速率减慢程度趋缓。

Fig. 2 The effect of the amounts of HPMC on drug release
2.3.3 填充剂种类的影响
固定其他处方组成不变,分别以MCC、Starch1500和乳糖作为填充剂,用量为片质量的50%,制备缓释片,测定释放度,考察填充剂的种类对药物释放的影响,释放曲线见图3。结果表明,填充剂种类对药物释放有显著性影响,Starch1500可有效减慢药物释放,但填充剂仅为Starch1500时,可压性较差,因此联合使用MCC和Starch1500作为填充剂。

Fig. 3 The effect of different fillers on drug release
2.3.4 润滑剂用量的影响
取相同量的药物及其他辅料,分别加入质量分数0.25%、1.0%和1.5%的硬脂酸镁,混合后压片,测定释放度,考察润滑剂用量对药物释放的影响,释放曲线见图4。结果表明,硬脂酸镁的用量在0.25%~1.5%内时,对药物释放无显著影响。

Fig. 4 The effect of the amounts of lubricant on drug release
2.3.5 制粒方法的影响
对同一处方,分别采用粉末直接压片和湿法制粒(以体积分数为90%乙醇为黏合剂)两种工艺来制备缓释片,考察制粒方法对药物释放的影响,释放曲线见图5。结果表明,两种制粒工艺对药物释放几乎没有影响。

Fig. 5 The effect of differentgranulating methodson drug release
2.4 处方优化
2.4.1 试验设计和评价指标
根据单因素考察结果可知,影响酮咯酸氨丁三醇缓释片释放的关键因素为处方中HPMC K15M用量()、Starch1500用量(),采用星点设计-效应面法进行2因素5水平优化。根据《中华人民共和国药典》2015年版缓控释制剂指导原则的规定,拟选综合评分法,体外释放度限度的确定参考布洛芬缓释胶囊的释放度:1、2、4、8 h的释放量应分别为标示量的10%~35%、25%~55%、50%~80%和75%以上,各时间点的释放量为释放度范围中间值最优,选用1、2、4、8 h四点的累计释放量()与理想值偏差之和()作为评价指标[7],综合评分值()的计算公式为=|1-25%|×1+|2-40%|×1+|4-65%|×1+|8-90%|×1[8],综合评分值最小者为最佳处方。具体因素和水平见表2,试验安排和结果见表3。
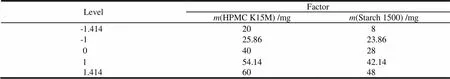
Table 2 Factor and level for central composite design
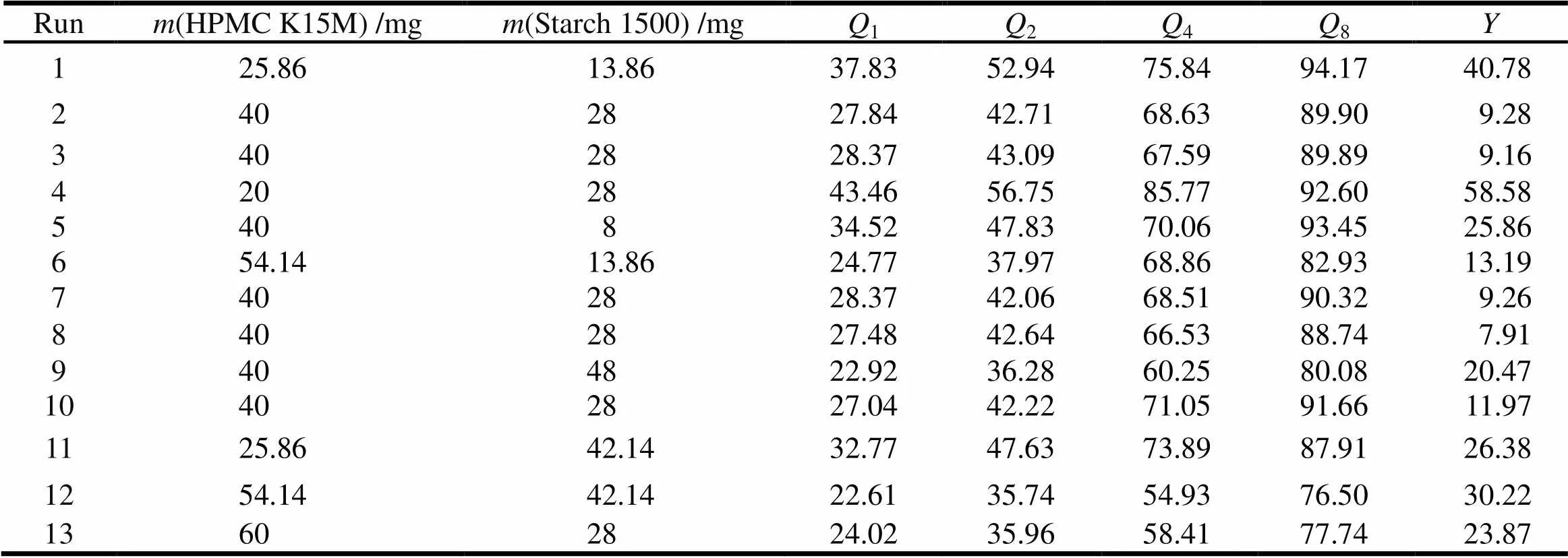
Table 3 Experiment design and results
2.4.2 数据分析与模型拟合
将表3中的数据用Design Expert8.0进行处理,以综合评分值()为指标对HPMC K15M用量和Starch1500用量的各水平进行多元线性回归,得到如下拟合方程:
=220.527 09-7.630 40-3.207 81+3.928 8×10-2+7.358 2×10-22+2.843 2×10-22(=0.972 7)。
对优选的二次方模型进行统计分析可知:AB对影响显著(<0.05),与为负相关,增大,减小;AB与为正相关,AB增大,增大。HPMC K15M()和Starch1500用量()对综合评分值()所做的效应面图和等高线图见图6、7。
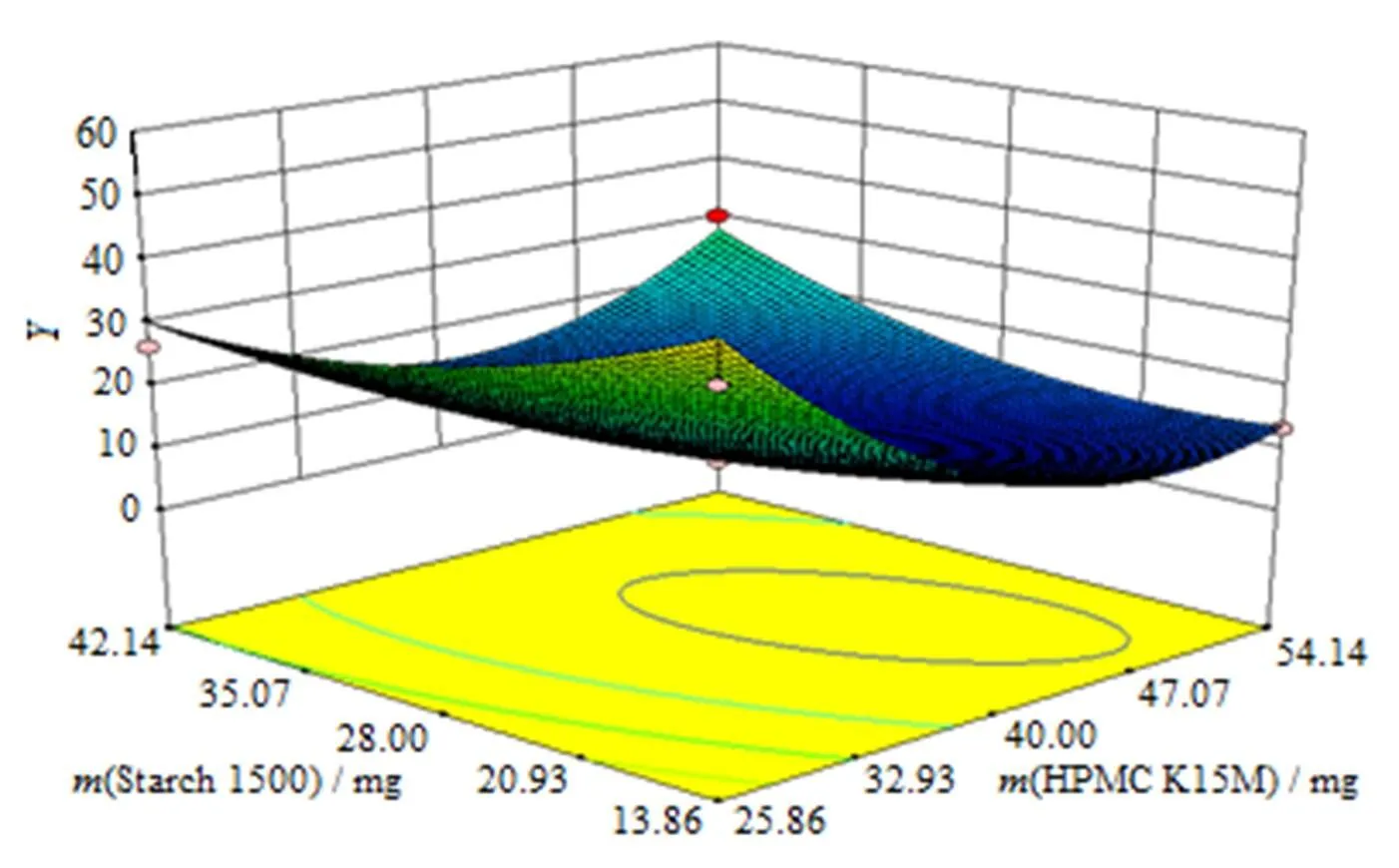
Fig. 6 Predicted response surface ofsynthetical value(Y)as a function of factor A and factor B
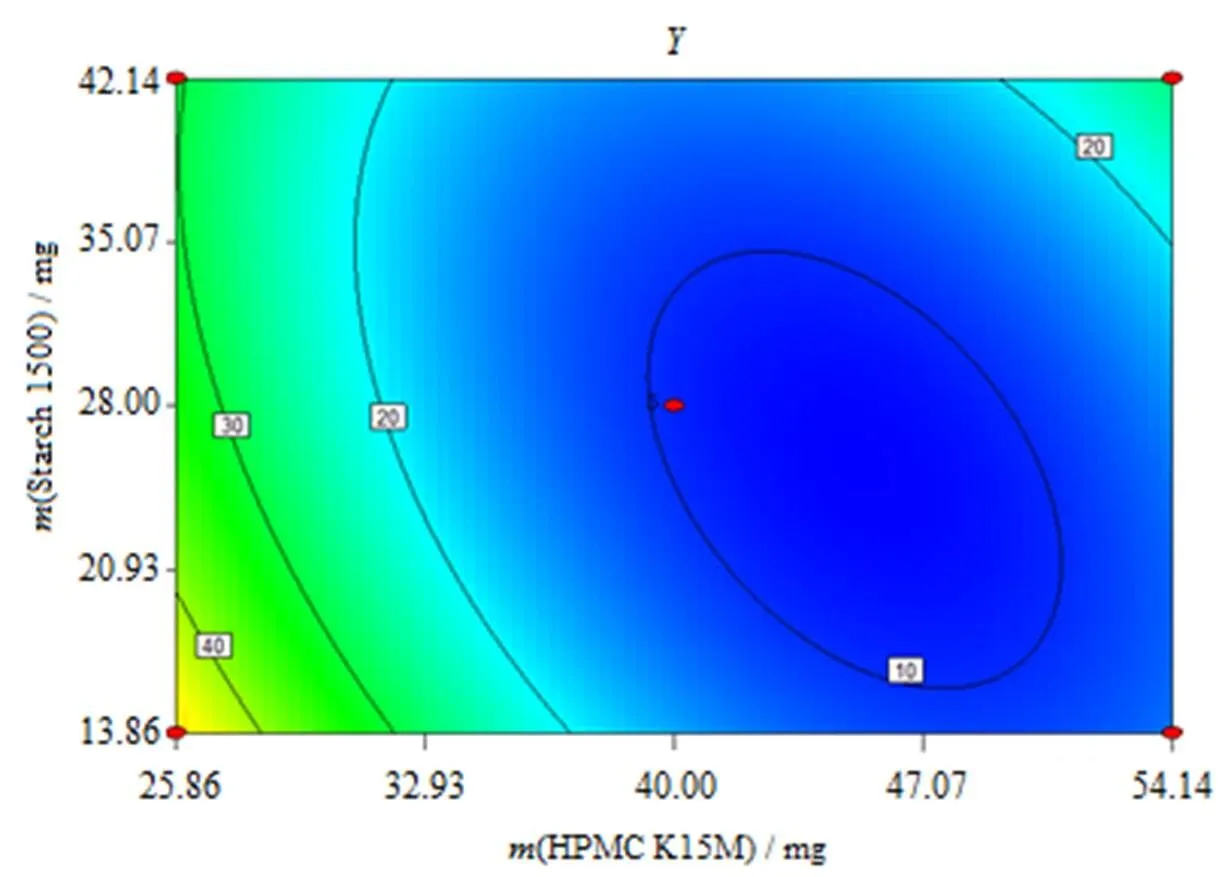
Fig. 7 Contour line of synthetical value(Y)as a function of factor A and factor B
2.4.3 模型的验证
结合二次回归模型的数学分析结果,酮咯酸氨丁三醇缓释片的最佳处方为:酮咯酸氨丁三醇为20 mg,HPMC K15M为45 mg,MCC为10 mg,Starch1500为25 mg,硬脂酸镁为1 mg,微粉硅胶为1 mg。在此条件下预测值为:7.94。按最优处方制备3批缓释片,其综合评分值实测平均值为7.40。结果表明,实测值与预测值相似,建立的数学模型预测性良好。
2.5 释药动力学模型拟合
选择优化处方的样品进行释放度试验,分别将释放度数据进行零级动力学方程、一级动力学方程、Higuchi方程的模型拟合,根据求出的相关系数分析其释药机制[9],结果见表4。Higuchi方程的拟合相关系数最大,可见该制剂体外释放符合Higuchi方程释放特征。
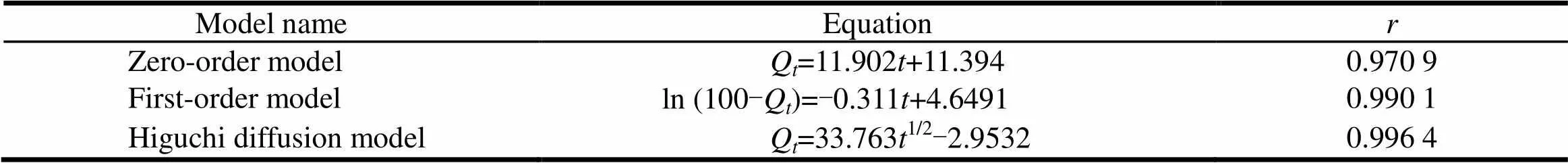
Table 4 The release pattern ofketorolac tromethamine release fitting and correlation coefficients
为进一步研究药物从骨架材质中的释放机制,采用Ritger-Peppas模型进行释药动力学拟合。
Ritger-Peppas方程表达式为:Q=kt,即lnQ=ln+ ln。式中Q是累计释放百分数,是释放速率常数,是释放机制的特征参数。当≤0.45时,药物的释放以Fick扩散为主;当≥0.89时,药物释放以骨架溶蚀为主;当0.45<<0.89时,药物的释放为药物扩散和骨架溶蚀并存的协同作用。本实验的拟合结果为lnQ=0.598 4ln+3.3295,=0.998 7,值为0.598 4,说明药物的释放是扩散和骨架溶蚀并存的协同作用。
3 讨论
a.在制剂处方和工艺筛选过程中,通常需要考察多个因素的多个水平对评价指标的影响,常用均匀设计、正交设计和效应面优化法等试验设计方法研究。均匀设计和正交设计基于线性模型,不能在给出的整个区域用一个明确的函数表达式描述因素和评价指标的关系,所以无法得到因素水平的最优取值;而效应面优化法是集数学与统计学一体的试验设计方法,适用于线性和非线性模型的拟合,可以分析回归方程,得到因素最优水平。星点设计和Box-Behnken试验设计是效应面优化法的代表。
b.体外释放度测定方法能够对产品进行有效的质量控制,经过方法学验证,证明方法准确、可靠。
c.笔者在单因素考察的基础上结合星点设计-效应面法确定最优处方,并对最优处方进行了验证,实验证明所制备的酮咯酸氨丁三醇缓释片处方合理,工艺简单,具有良好的缓释效果,释药动力学符合Higuchi方程,药物释放没有突释、时滞现象。
[1]VATSARAJ N, ZIA H, NEEDHAM T. Formulation and optimization of a sustained-releasetablet ofketorolac tromethamine[J]. Drug delivery, 2002, 9(3): 153-159.
[2]董芸芳, 耿晓慈, 刘佳, 等. 酮咯酸氨丁三醇与地佐辛注射液的配伍稳定性分析[J].中国药事, 2016, 30(3): 272-275.
[3] 张志杰. 新型非甾体止痛药—酮咯酸氨丁三醇(尼松)[J]. 中南药学, 2008, 6(3): 372-374.
[4] GENC L, JALVAND E. Preparation andevaluation of controlled release hydrophilic matrix tablets of ketorolac tromethamine using factorial design[J]. Drug Development and Industrial Pharmacy, 2008, 34(8): 903-910.
[5] 国家药典委员会编. 中华人民共和国药典: 四部[M]. 北京: 中国医药科技出版社, 2015.
[6] 李嘉煜, 董娥, 李华, 等. 盐酸二甲双胍缓释片释药因素考察及处方筛选[J]. 沈阳药科大学学报, 2003, 20(2): 88-92.
[7] 梁金英, 卢光洲, 赵繁荣, 等. 尼美舒利缓释片处方优化研究[J]. 中国药房, 2011, 22(9): 823-825.
[8] 刘晓娟, 孙玉琦, 张亚秋, 等. 盐酸曲美他嗪缓释片的研制及其体外释药特性考察[J]. 中国新药杂志, 2012, 21(5): 567-570.
[9] 林巧平, 桂彬, 谈颖, 等. 盐酸二甲双胍1 000 mg缓释片的制备及体外释药机制考察[J]. 中国药房, 2013, 24(13): 1191-1193.
Formulation optimization of ketorolac tromethaminesustained- release tablets by centralcomposite design-response surface methodology
LIANG Sheng-nan1,LI Jing-xin2,WANG Zhong-yan1*
(1.,,110016,; 2.,,110016,)
Objective To optimize the formulation of ketorolac tromethamine sustained-release tablets and investigate their release rate. Methods The ketorolac tromethamine sustained-release tablets were prepared with HPMC K15M as matrix material. Parameters including species and dosage of HPMC, filler types, amount of lubricant, and granulating method were screened by investigating thedrugrelease. Then, the central composite design-response surface methodology was used to optimize formulation and confirm the model. Results The optimum formula composed of 20 mg ketorolac tromethamine, 45 mg HPMC K15M, 10 mg MCC, 25 mg Starch1500, 1 mg aerosil, and 1 mg magnesium stearate, when usingdirect compression as the preparation technology. The releases profiles followed the Higuchi equation. Conclusion The central composite design-response surface methodology can be used to optimize the formulation of ketorolac tromethamine sustained-release tablets, and the models constructed in this study are validated to be predictive.
pharmaceutics; sustained-release tablets; central composite design-response surface methodology; ketorolac tromethamine;release
(本篇责任编辑:赵桂芝)
(2017)03–0049–09
10.14146/j.cnki.cjp.2017.03.001
R94
A
2016-07-04
梁胜男(1986-), 女(汉族), 辽宁沈阳人, 硕士研究生, E-mail liangshengnan1986@126.com;
王中彦(1965-), 男(汉族), 辽宁沈阳人, 副教授, 博士, 主要从事药物制剂研究, Tel. 024-23986292, E-mail wangzhongyanlab@163.com。
- 中国药剂学杂志(网络版)的其它文章
- SPG膜乳化法制备粒径均匀的布比卡因P(L)GA微球
- 普瑞巴林胃漂浮缓释片的处方工艺研究

