白桦五个MYB转录因子的生物信息学分析
金秋++杨淼++史美葳++任如意++魏继承


摘要:在白桦(Betula platyphylla Suk.)转录组数据库中获得5个MYB转錄因子,将其进行蛋白质分子量与等电点、核定位信号、跨膜结构域和蛋白保守结构域预测,并与拟南芥的MYB蛋白质进行氨基酸序列比对分析和系统树构建。结果表明,白桦的5个MYB转录因子都属于R2R3-MYB类蛋白;系统进化树表明白桦的5个MYB转录因子与拟南芥抗逆相关的MYB转录因子亲缘关系较近,而与非抗逆相关的转录因子亲缘关系较远,说明白桦的5个MYB转录因子可能具有植物抗逆相关功能。
关键词:白桦(Betula platyphylla Suk.);MYB转录因子;逆境胁迫
中图分类号:S792.153;Q78 文献标识码:A 文章编号:0439-8114(2017)09-1759-04
DOI:10.14088/j.cnki.issn0439-8114.2017.09.040
Bioinformatics Analysis of Five MYB Transcription Factors from Betula piatyphylla Suk.
JIN Qiu,YANG Miao,SHI Mei-wei,REN Ru-yi,WEI Ji-cheng
(College of Life Sciences and Technology,Mudanjiang Normal University,Mudanjiang 157011,Heilongjiang,China)
Abstract:5 candidate MYB transcription factors were obtained from Betula platyphylla Suk. transcriptome datebase. The theoretical molecular weight(MW), isoelectronic point(pI), nuclear localization signal,transmembrane domain and amino acid conserved domain of 5 MYB transcription factors were predicted, amino acid sequence alignment and phylogenetic tree were contructed with the MYB transcription factors from Arabidopsis. The results indicated that 5 MYB transcription factors of birch were all belonged to R2R3 type MYB members according to amino acid sequence alignment. Phylogenetic construction showed that the 5 MYB transcription factors of birch were closely with MYB transcription factors related to stress resistance from Arabidopsis, which suggested that the 5 birch MYB members may function in stress resistance.
Key words:Betula platyphylla Suk.;MYB transcription factors;stress resistance
MYB(v-myb avian myeloblastosis viral oncogene homolog)转录因子参与植物生长发育、形态建成以及非生物胁迫等多种生物学过程。MYB转录因子在防虫、耐高低温、干旱、高盐、调节开花转型关键基因表达以及调控植株主根伸长通路等过程中起重要作用[1]。它是植物界转录因子家族成员之一,对植株抗逆性起关键作用[2]。研究发现,GhMYB11基因在黄萎病菌侵染,盐、干旱和氧化胁迫反应处置后的棉花新苗叶片中表达明显上调,表明GhMYB11基因在棉花生物和非生物胁迫反应中起关键作用[3]。GmMYB042基因在大豆的茎、根、根瘤、种子、花和荚果皮中均有表达,且在大豆中受到PEG、低温、高盐和辐射的诱导[4]。木薯R2R3-MYB类转录因子MeMYB63在叶面上有高强度抗旱反应,说明该基因对干旱胁迫诱导下的表达调控起关键作用[5]。水稻R2R3-MYB类盐胁迫表明OsMPS基因有调控植物激素和细胞壁合成的功效,该基因的表达受多种植物激素的诱导[6]。拟南芥AtMYB13基因受激素诱导后强烈表达,能够提高转基因拟南芥对病原细菌(PstDC3000)的基本防卫反应。MYB15蛋白可以结合CBF基因启动子的MYB元件,继而调控抑制低温相关基因的表达[7]。拟南芥AtMYB73基因可以通过影响水杨酸和茉莉酸抵抗病原菌丁香假单孢杆菌和核盘菌,从而在干旱胁迫中发挥作用[8]。AtMYB44在HrpNEa调控拟南芥预防桃蚜过程中起重要作用[9]。AtMYB44基因通过E1N2调控拟南芥对桃蚜与菜蛾的抗虫性[9]。郑博[10]通过基因枪转化技术把拟南芥的AtMYB44基因转导到扬麦158中,得到拥有良好耐寒、耐旱和抗盐碱的优质转基因小麦。MYB转录因子在红根甘肃桃抗根结线虫机制中能够经过调控苯丙烷代谢途径增长红根甘肃桃根部花色素苷和其余类黄酮物质的含量,从而抵抗根结线虫侵染[11]。多年生黑麦草3个转录因子LpMYB1、LpMYB2和LpMYB3参与黑麦草对紫外、干旱、高盐胁迫的应答和形态建成[12]。目前,MYB转录因子对植物作用的分子机理还不完全清楚。
白桦(Betula platyphylla Suk.)为桦木属落叶乔木,可用于建筑、园林观赏以及保健药用等方面。随着对白桦研究的不断深入,其潜在经济市场价值也不断被发掘。本研究首先利用拟南芥数据库找到与植物抗逆相关的MYB转录因子,然后到白桦数据库中进行比对,找到相似性最高的白桦MYB转录因子,进行氨基酸序列比对以及系统树构建,推测白桦的MYB基因的抗逆性,从而为下一步深入研究白桦的MYB基因的功能提供基础研究数据。
1 材料与方法
1.1 试验软件和生物信息学网站
计算5种白桦MYB转录因子的理论分子量和等电点登录http://www.expasy.org/tools/protparam.html,核定位信号和跨膜域的预测利用Server 2.0软件(http://bioinfo.tsinghua.edu.cn/SubLoc/),蛋白保守结构域预测采用NCBI(http://www.ncbi.nlm.nih.gov/),数据分析所用软件为BioEdit和MEGA 5.1,MYB转录因子数据下载和DNA序列翻译成蛋白序列采用TAIR-Home-Page(https://www.arabidopsis.org/)、Home(http://birch.genomics.cn/page/species/index.jsp)。序列在线处理登录http://www.bio-soft.net/sms/。
1.2 試验方法
1.2.1 白桦MYB氨基酸序列的获得 从拟南芥数据库里找到一些抗逆相关的转录因子,将其输入到白桦基因组数据库中Home(http://birch.genomics.cn/page/species/index.jsp)进行比对,找到同源性最高的白桦MYB序列,然后使用序列处理在线工具包(http://www.bio-soft.net/sms/)进行翻译得到白桦MYB氨基酸序列。
1.2.2 白桦MYB转录因子的特征分析 预测白桦5个MYB转录因子的理论分子量和等电点登录http://www.expasy.org/tools/protparam.html。通过SbLocv1.0、TMHMM server 2.0软件(http://bioinfo.tsinghua.edu.cn/SubLoc/)预测白桦5个MYB转录因子的核定位信号和跨膜结构域。
1.2.3 白桦MYB氨基酸序列NCBI比对 将白桦MYB氨基酸序列输入到NCBI网站(http://www.ncbi.nlm.nih.gov/)上进行保守结构域分析。
1.2.4 白桦MYB氨基酸序列的多重序列比对分析 采用Bio Edit软件对白桦MYB氨基酸序列和拟南芥抗逆相关的氨基酸序列进行多重序列比对分析,进行白桦基因与拟南芥抗逆基因的同源性比较。
1.2.5 系统发育树的构建 采用MEGA 5.1软件将白桦MYB氨基酸序列和拟南芥抗逆相关的MYB氨基酸序列进行系统发育树构建,并以拟南芥非抗逆相关的MYB氨基酸序列为外群,通过系统进化亲缘关系远近预测白桦MYB转录因子的功能。
2 结果与分析
2.1 白桦MYB转录因子的基因特征
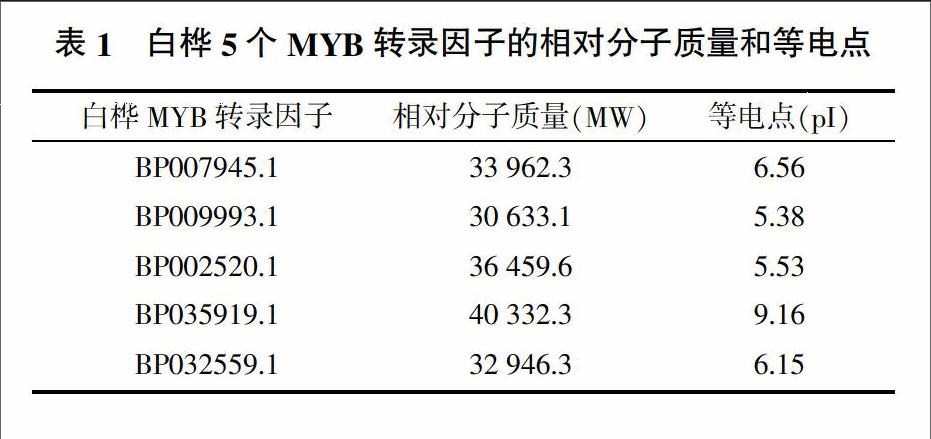
白桦5个MYB转录因子的相对分子质量和等电点如表1所示。将白桦5个MYB转录因子进行核定位信号预测,结果显示BP007945.1、BP009993.1、BP002520.1和BP032559.1属于核蛋白,BP035919.1属于细胞质蛋白。
跨膜域预测分析如图1所示。从图1中可以看到,BP007945.1、BP009993.1、BP002520.1和BP032559.1无跨膜结构域,而BP035919.1有跨膜结构域。
2.2 白桦MYB转录因子的保守结构域分析
在NCBI上将白桦的5个MYB转录因子进行保守结构域分析,结果如图2所示,BP007945.1在白桦氨基酸序列的17~60位和70~113位各有一个高度保守的SANT结构域;BP009993.1在白桦氨基酸序列的18~60位和70~113位各有一个高度保守的SANT结构域;BP002520.1在白桦氨基酸序列的20~62位和72~113位各有一个高度保守的SANT结构域;BP035919.1在白桦氨基酸序列的17~60位和70~111位各有一个高度保守的SANT结构域,同时在224~285位和224~340位各存在一个类似RNA酶(RNase_H_like)的家族保守结构域;BP032559.1在白桦氨基酸序列的17~60位和69~108位各存在一个高度保守的SANT结构域;白桦5个MYB转录因子具有这些保守结构域说明他们都属于典型的SANT家族基因。
2.3 白桦MYB氨基酸序列比对分析
通过Bio Edit软件对白桦5个R2R3型MYB转录因子氨基酸序列进行同源性分析,结果见图3。如图3所示,这5个MYB转录因子与拟南芥的AtMYB93和AtMYB74都具有典型的R2R3-MYB结构域。
2.4 系统进化树分析
为了研究白桦MYB蛋白质的进化关系,用MEGA 5.1软件构建了MYB转录因子蛋白质的进化树,结果(图4)表明,BP007945.1与拟南芥AtMYB60距离最近,之后与AtMYB96聚在一起;BP009993.1与拟南芥AtMYB13和AtMYB14距离最近,其次与AtMYB15聚在一起;BP002520.1与拟南芥AtMYB72距离最近,之后AtMYB10聚在一起;BP035919.1与拟南芥AtMYB8距离最近,之后再与AtMYB12聚在一起。从聚类关系可以看出,白桦的5个MYB转录因子与拟南芥抗逆相关基因亲缘关系较近,与非抗逆基因MYB46和AtMYB2、AtMYB62等抗逆基因亲缘关系较远,说明这白桦这5个MYB转录因子可能具有抗逆性。
3 小結与讨论
本试验通过白桦5个MYB转录因子氨基酸序列与拟南芥的MYB转录因子比对,经过软件Bio Edit和MEGA 5.1分析,构建系统进化树,结果表明白桦的5个R2R3型MYB转录因子可能具有抗逆性。水稻OsmB3R-2基因在拟南芥中过表达后转基因植株对冻害、干旱和高盐的耐受性显著提高[6]; Rahaie等[13]研究证明小麦TaMYBsduI转录因子是高盐和干旱胁迫下的调控子,MdSIMYB1过表达能增强转基因小麦抗逆境能力。可见,MYB转录因子在植物的生长发育过程中起着重要的调控作用。
参考文献:
[1] 田双梅.进拟南芥转录因子AtMYB44促抗病耐热及抑制开花作用[D].南京:南京农业大学,2012.
[2] 刘 蕾,杜 海,唐晓凤,等.MYB转录因子在植物抗逆胁迫中的作用及其分子机理[J].遗传,2008,30(10):1265-1271.
[3] 李 菲,柳展基,王立国,等.棉花转录因子基因(GhMYB11)的克隆与表达分析[J].农业生物技术学报,2015,23(2):161-169.
[4] 杜 海,冉 风,马珊珊,等.GmMYB042基因对类黄酮生物合成调控作用[J].作物学报,2016,42(1):1-10.
[5] 荣 晶.木薯干旱胁迫相关R2R3-MYB转录因子MeMYB63的基因特性及启动子分析[D].海口:海南大学,2014.
[6] SCHMIDT R,SCHIPPERS J H,MIEULET D,et al.MULTIPASS,a rice R2R3-type MYB transcription factor,regulates adaptive growth by integrating multiple hormonal pathways[J].Plant J,2013,76(2):258-273.
[7] 许 瑞.RNA介导的启动子DNA甲基化在调控拟南芥盐胁迫应答中的作用研究[D].济南:山东农业大学,2010.
[8] 徐 钰.转录因子AtMYB13抑制拟南芥防卫反应的研究[D].南京:南京农业大学,2009.
[9] 吕贝贝.MYB44对HrpNEa诱导拟南芥抗虫防卫信号传导的调控作用[D].南京:南京农业大学,2012.
[10] 郑 博.基因枪法介导拟南芥AtMYB44基因转化小麦的研究[D].合肥:安徽大学,2013.
[11] 魏 潇.红根甘肃桃抗根结线虫相关MYB转录因子基因的克隆与定位[D].北京:中国农业科学院,2010.
[12] 凌 瑶,李成磊,吴 琦.多年生黑麦草MYB转录因子基因的克隆及序列分析[J].河南农业科学,2012,41(8):171-176.
[13] RAHAIE M,XUE G P,NAGHAVI M R,et al. A MYB gene from wheat (Trhicum aestivvm L.) is up-regulated during salt and drought stresses and differentially regulated between salt-tolerant and sensitive genotypes[J].Plant Cell Reports,2010(29):835-844.
——论诗人白桦“树”的情结

