电针重置超前性光暗周期转移小鼠的节律特征及其对SCN内相关钟基因表达的影响*
陈莎莎, 王颖, 魏大能, 薛红
(成都中医药大学,四川 成都 610075)
电针重置超前性光暗周期转移小鼠的节律特征及其对SCN内相关钟基因表达的影响*
陈莎莎, 王颖, 魏大能, 薛红
(成都中医药大学,四川 成都 610075)
为了探索电针重置超前性光暗周期转移模型小鼠的时相特征及视交叉上核(Suprachiasmaticnucleus,SCN)多种节律相关基因及转录因子的表达,将符合筛选标准的44只C57BL/6J小鼠完全随机分为空白组(n=10)、模型组(n=12)、捆绑组(n=12)和电针组(n=10)4组。其中,模型组、捆绑组和电针组运用超前性光暗周期转移法进行造模,连续10 d。造模结束后,模型组小鼠于ZT18时相点处死取材;电针组小鼠恢复正常光暗交替(Light and Dark,LD)状态,并于ZT16时相点选取“肝俞”和“至阳”穴进行电针治疗,连续3次,每天1次;捆绑组采用与电针组相同的方法进行平行捆绑。捆绑及治疗结束后,处死动物并剥取SCN,采用PCR Array检测各组动物SCN内节律相关基因及部分节律相关转录因子相对表达量。实验结果显示:①电针重置昼夜节律结果:造模后,模型组、捆绑组及电针组与造模前比较峰相位、起始活动时间均显著超前,昼夜活动节律周期缩短(P<0.05);再同步期,电针组峰相位、起始活动时间后移,与造模期及空白组比较具有统计学差异(P<0.05);再同步第1天及第2天电针组小鼠的昼夜活动节律周期与空白组和造模前比较有统计学差异(P<0.05),再同步第3天与空白组和造模前比较无统计学差异(P>0.05)。② SCN节律相关基因及转录因子变化:与空白组比较,模型组小鼠的SCN节律相关基因表达上调8个(Aanat、Crx、Epo、Nkx2-5、Pax4、Prf1、Rora、Stat5a),下调4个(Egr1、Per1 、Per3、Prokr2) ;与模型组比较,捆绑组节律相关基因上调3个 (Esrra、Mat2a、Per3),下调11个(Cartpt、Crx、Epo、Kcnma1、Mtnr1b、Nkx2-5、Nms、Pax4、Prf1、Prkacb、Prkca);与模型组比较,电针组节律相关基因上调6个(Egr1、Esrra、Mat2a、Per1、Per3、Prokr2),下调21个(Aanat、Arntl、Cartpt、Crx、Csnk1e、Epo、Kcnma1、Mtnr1b、Myod1、Nkx2-5、Nms、Opn3、Pax4、Prf1、Prkacb、Prkca、Prkcb、Prokr2、Rora、Rorb、Slc9a3、Tgfb1)。以上实验结果提示电针可缩短超前性光暗周期转移小鼠的昼夜节律重置时间,加速紊乱昼夜节律的恢复,这可能是通过对SCN内Per1、Egr1、Aanat、Prokr2等节律相关基因的调控作用实现的。
电针;超前性光暗周期转移;节律;SCN;钟基因
节律是与人体生理病理状态密切相关的基本生命现象,无论是整体还是组织细胞都保持周期接近24 h的节律性活动,稳定有序的昼夜节律的是维持机体健康的重要条件之一。一旦外环境的时间信息发生急性转移或长期处于倒转时相的工作和休息制度后, 就会导致各种生理节律紊乱,从而引发一系列疾病。目前,越来越多的证据表明疾病的发生发展与昼夜节律紊乱密切相关。如跨时区飞行、轮班工作制度,以及环境、温度、光照、噪声等引起的节律紊乱不仅仅表现出睡眠-觉醒周期改变,还会表现出食欲欠佳、腹痛腹胀等消化道症状,疲劳乏力,注意力下降、精力不集中,工作效率低下等。早有实验结果证实,针灸具有明确的调整生物节律作用,能够调整慢性疲劳综合征[1-3]、荷乳腺癌小鼠自发性活动节律[4],改善吗啡成瘾小鼠昼夜节律[5],调节抑郁小鼠体温及褪黑激素节律[6]等,但其调节机制尚需进一步研究,尤其是对SCN的调节作用。随着时间生物学的研究日趋深入,人体的节律系统及其相关调控机制也日趋完善,其中Clock、Arntl、Cry1 和Cry2、CK1e、Per1、Per2和Per3、一对孤儿核受体Rev-Erba和RORa等节律基因构成了最基本的转录和翻译负反馈调节部分[7]。而这些节律基因及其表达产物间形成了昼夜节律转录/ 翻译反馈环路,参与调控机体昼夜节律。然而,SCN节律相关基因研究重点关注基因主要集中在Per、Cry、Arntl等基因,其它节律相关基因是否参与电针重置生物钟基因调节,目前尚未深入研究。本课题将C57BL/6J 近交系小鼠复制成超前性光暗周期转移模型,从行为学、分子生物学等角度研究SCN节律相关基因参与电针重置紊乱节律作用机制,以探讨电针对节律相关基因的调控作用,为针灸调整节律紊乱临床运用提供实验依据。
1 实验材料
1.1 实验动物
选用同批次12~14周龄的 C57BL/6J 近交系小鼠。为避免雌性动物动情周期对节律可能造成的影响干扰实验结果,故统一选用雄性小鼠进行实验。动物购自中国食品药品鉴定研究院,SPF级,实验动物许可证号:scxk(京)2009-0017。本次实验方案获得了成都中医药大学动物实验伦理委员会批准。
1.2 主要器械和仪器
①小动物自发性活动自动记录系统:成都中医药大学时间生物医学实验室;②Clocklab 数据采集分析系统:ACT-500,美国 Clocklab 公司;③基因扩增仪:mastercycler epgradient-5341,德国埃普多夫公司;④FLUKO F6/10超细匀浆机:德国FLUKO公司;⑤Eppendorf Centrifuge离心机:5417R,德国Eppendorf公司;⑥Thermo Scientific微量紫外分光光度计:Nano drop 2000,美国Thermo公司 ;⑦Themal Cycle热循环仪:C1000,美国伯乐公司;⑧数显双列四孔水浴锅:HH-S4,江苏省金坛市医疗仪器;⑨韩式穴位神经刺激仪:YZB/苏0362-2007,南京济生医疗科技有限责任公司;⑩华佗牌无菌针灸针(0.25 mm×13 mm):标准号GB2024-1994,苏州医疗用品有限公司。
1.3 主要试剂
①RNeasy Mini Kit(50):RNA提取试剂盒(No.74104),德国Qiagen公司;②RNase Free DNase Set:去除基因组DNA,德国Qiagen公司;③RT2 First Stand Kid(50):逆转录cDNA试剂盒(No.330404),德国Qiagen公司;④RT2 SYBR Green ROX qPCR Mastermix(24):德国Qiagen公司;⑤RT2 Profiler PCR Array盘:PAMM-153ZA,德国Qiagen公司。
2 实验方法
2.1 动物筛选
实验动物置于成都中医药大学时间生物学测试室隔离单元鼠笼中,并放入隔离单元内,鼠笼底部铺干燥清洁级垫料,鼠笼内含转轮可供实验动物自由活动。隔音、避光、恒温[(23±1)℃]、通风、相对湿度60%±5%,动物自由进食饮水(全价颗粒鼠饲料由四川省医学科学院实验动物研究所提供),光-暗控制下连续监测动物自发性活动3 d,其平均转轮次数大于10 000次/d的动物合格留用。
2.2 动物分组
利用SPSS 17.0软件产生的随机数字将筛选出的44只动物分为空白组(n=10)、模型组(n=12)、电针组(n=10)、捆绑组(n=12)4组。
2.3 动物驯化
实验开始时先LD驯化同步,即06:00-18:00光照,18:00-次日06:00暗置,使动物的转轮活动与外界正常的光暗周期同步,光暗驯化10 d。驯化10 d后开始造模。
2.4 造模方法
实验动物经过10 d光暗周期同步后参考相关文献[8],将模型组、捆绑组、电针组动物进行10 d的超前性光暗周期转移(Advances of light/dark cycle),即每2 d提前8 h开灯,连续5次,持续改变光照制度10 d后节律紊乱模型建立成功。律紊乱模型的标准为:起始活动时间与关灯时间的相位偏移超过1 h[9]。
实验过程将分为3个组成部分,分别是:LD光暗周期同步10 d为同步期(Entrained)即造模前;采用超前性光暗周期转移方法造节律紊乱模型10 d为造模期;造模完成后光暗周期恢复到造模前光照条件,并根据不同组别给予相应干预手段,此时间段为再同步期(Re-entrained)。
2.5 干预方法
1)空白组:不造模。持续采用光暗交替LD光照制度,不予其他处理,自由进食饮水。
2)模型组:仅造模。实验动物LD同步后开始造模,采用超前性光暗周期转移的常规方法,每2 d提前8 h开灯,循环5次,持续改变光照制10 d,复制成节律紊乱动物模型。
3)捆绑组:造模不电针。造模成功后,于动物起始活动点后4 h,即ZT16,将动物固定于自制固定器上,以平衡捆绑刺激造成的影响。捆绑组动物每次捆绑固定时间与电针组捆绑时间相同15 min。捆绑完成后将动物放回笼内,自由进食饮水。
4)电针组:造模并电针。造模成功后,于ZT16时间点将动物固定于自制固定器上,固定后进行电针操作,参照余曙光主编的《实验针灸学》[10]小鼠穴位定位图,选取动物两侧“肝俞”和“至阳”穴位[11]进行针刺,“肝俞”左右两侧穴位交替使用,每次取单侧,“至阳”每次均进行针刺,肝俞穴连接正极,至阳穴连接负极。针刺后按照说明书要求连接韩式电针仪HANS-200,选择电针仪经针模式,频率2/15 Hz,电流0.2 mA,每次电针15 min,电针每日1次,连续电针3次。电针后将动物放回笼内,自由进食饮水。
选穴依据:①阴阳消长节律是人体生理节律的基本形式,“阳主动”,调节阳气即可调整人体的活动状态。②督脉总督一身之阳气,6条阳经均与之交会,为阳脉之海,调一经可达调全身阳气之功。③至阳为督脉阳气隆盛之处,有振奋全身阳气,疏通经血,安各五脏,攻补兼施之功。④肝俞为肝经俞穴,中医理论为为,背俞穴是脏腑之气输注于背腰部的腧穴,与脏腑有密切关系。肝癌病位在肝,治疗肝脏相关疾病,选穴肝俞,体现了“腧穴所在,主治所及”的局部选穴原则。
2.6 行为学数据采集方法
使用成都中医药大学时间生物学实验室研制的小动物自发性活动记录系统和美国Clocklab 生物节律数据采集分析系统自动监测和记录每只动物的自发性活动昼夜节律数据。Clocklab生物节律数据采集分析系统作出观察周期内动物自发性活动直方图、周期、起始活动时间点、峰相位。对动物自发性活动昼夜节律相关参数进行造模前后、干预前后对比分析。动物从LD驯化期第1-10天代表同步期,第11-20天代表造模期,第21-23天为再同步期。
2.7 样本采集
动物第3次电针(或捆绑固定)后2 h处死动物,参考George Paxinos[12]小鼠大脑立体定位图谱,以视交叉为标志,切取其脑部视交叉上核组织块,放入无菌冻存管内并迅速放至-80 ℃冰箱保存。
2.8 PCR Array法检测各组动物SCN内生物钟基因的表达
2.8.1 RNA提取 ①SCN组织加入600 μL裂解液;②匀浆1 min后离心,14 000 r/min,3 min,吸上清;③加入φ=70%乙醇,600 μL,混匀并离心,12 000 r/min,1 min,吸上清;④加入350 μL RW1并离心,12 000 r/min,1 min;⑤弃下液,加入DNase 80 μL/份室温静置15 min;⑥加RW 1 350 μL,离心,12 000 r/min,1 min;⑦弃下液,加入500 μL RPE,离心,12 000r/min,1 min;⑧弃下液,加入500 μL RPE,离心,12 000 r/min,2 min;⑨离心,14 000 r/min,1 min;⑩保留吸附柱,加30 μL RNA Free water,离心,12 000 r/min,1 min;弃吸附柱,保留离心管;Nano drop 2 000微量紫外分光光度计分析纯化测定RNA质量浓度及质量。当RNA质量浓度>125 ng/μL时,测定260 nm/280 nm的吸光度比值,数值为1.8~2.1者留用于下一步实验。
2.8.2 逆转录cDNA ① 将RT2 First Stand Kid试剂盒中试剂短离心15 s;②按照表1配置基因组DNA去除反应物,混匀后短离心;③将基因组DNA去除反应放入热循环仪,42 ℃保温5 min,5 min后迅速置于冰上至少1 min;④配置逆转录反应,如表2;⑤混匀步骤②④反应物;⑥放入热循环仪,42 ℃,15 min;95 ℃,5 min;⑦每个反应中加入91 μL RNase-free water,混匀。

表1 基因组DNA去除反应物配置表Table 1 Genomic DNA elimination mix

表2 逆转录反应配置表Table 2 Reverse-transcription mix
2.8.3 配制PCR Array反应体系(避光) ①RT2 SYBR Green ROX qPCR Mastermix短离心15 s;②放入42 ℃恒温水浴锅,1 min;③室温,静置15 min;④配制PCR反应混合物:RT2 SYBR Green ROX 1 350 μL;cDNA合成反应物 102 μL;无RNA酶纯净水1 248 μL;总体积2 700 μL,混匀;⑤取出RT2 Profiler PCR Array盘,每孔加入25 μL PCR Array反应物。
2.8.4 进行Real-Time PCR 反应 PCR仪温度条件:95 ℃,1 min,循环数1;95 ℃,15 s,循环数40;60 ℃,1 min,循环数40,95 ℃,15 s,循环数1;60 ℃,1 min,循环数1;95 ℃,15 s,循环数1;温度变化速率调整为35%。
2.9 PCR Array数据采集方法
PCR 反应完成后,设置荧光阈值190,基线范围为3~15,导出数据整理为Excel表格格式。利用RT2 Profiler PCR Array Data Analysis version 3.5检测PCR Array结果质量:①基因组DNA污染≥35,说明染色组DNA污染很少,不会影响到基因表达检测结果,数据可用。②PCR重复性对照:每块RT2 Profiler PCR Array的CTPPC的均值在20±2者合格。③计算ΔCT值:AVG CTRTC-AVGCTPPC≤5,说明逆转录没有收到明显抑制,数据合格。
在PCR Array 数据分析页面,导入CT值数据后开始进行数据分析。软件根据2-ΔΔCT方法自动计算Fold change结果。
2.10 数据分析方法

2.10.2 RT2 Profiler PCR Array数据分析方法 在RT2 Profiler PCR Array Data Analysis version 3.5数据分析页面有CT值均值,2△△CT值,倍数变化值(Fold-change),以及P值等数据结果分析。其中倍数变化值及P值将用于之后的数据分析以及图形分析。变化倍数表示与对照组比较的表达倍数改变,倍数变显示基因表达上调、下调倍数。CT值均值表示每组动物每个PCR反应管内的荧光信号到达预定的阈值时所经历的循环数的平均数,倍数变化值2-△△CT也就是PCR的相对定量,与对照组相比较,倍数变化大于2倍。
3 结 果
3.1 节律紊乱模型建立
造模后,利用Clocklab计算出动物每天的峰相位时间,并分别计算出造模前、后峰相位以及峰相位转移时间。结果表明,空白组造模前后相位偏移值小于1 h,模型组造模前后相位偏移均大于1 h,依据节律紊乱模型的判断标准:起始活动时间与关灯时间的相位偏移超过1 h[9],判定造模成功(见表3,图1)。



图1 动物造模自发性活动直方图Fig.1 The actograme of phase advanced mice
3.2 电针对节律紊乱小鼠自发性活动节律的影响
3.2.1 电针对节律紊乱小鼠自发性活动峰相位的影响 造模前各组动物峰相位比较无统计学差异(P>0.05)。造模后模型组、捆绑组、电针组峰相位均显著超前,与各组造模前及空白组峰相位比较均有统计学差异(P<0.05)。捆绑组再同步时期峰相位较该组造模时比较无统计学差异(P>0.05),电针组峰相位后移与造模时比较具有统计学差异(P<0.05)。结果表明节律紊乱小鼠峰相位超前,自然恢复可使峰相位逐渐恢复,但电针干预可显著加速峰相位恢复速度(表4)(为同时观察造模对SCN节律相关基因改变,模型组小鼠造模第10天于ZT18时相点处死取材,故无模型组再同步期数据,下同)。
h

组别n同步造模再同步空白组1021.99±0.921.98±2.3221.93±0.69模型组1221.75±1.348±5.33#Δ捆绑组1220.99±2.349.5±4.92#Δ11.66±8.24#Δ电针组1020.87±3.119.98±5.35#Δ15.9±7.17#Δ*
1)#:与空白组比较(P<0.05);Δ:与造模前比较(P<0.05);*与造模时比较(P<0.05)
3.2.2 电针对节律紊乱小鼠自发性活动起始活动时间的影响 造模前各组动物起始活动时间比较无统计学差异(P>0.05)。造模后模型组、电针组、捆绑组起始活动时间显著提前,具有统计学差异(P<0.05)。电针组再同步时期起始活动时间点较造模时显著延迟(P<0.05),而捆绑组相较造模和再同步起始活动时间无显著差异(P>0.05)。说明节律紊乱小鼠起始活动时间提前,自然恢复不能显著改善超前的起始活动时间,电针能显著恢复节律紊乱小鼠的起始活动时间(表5)。
3.2.3 电针对节律紊乱小鼠自发性活动周期的影响 造模前各组动物周期比较均无统计学差异(P>0.05)。造模后模型组、捆绑组、电针组周期均显著缩短,与造模前及空白组周期比较均具有统计学差异(P<0.05)。捆绑组再同步3 d周期与空白组和造模前比较有统计学差异(P<0.05)。电针组再同步第1天及第2天周期与空白组和造模前比较有统计学差异(P<0.05),再同步第3天与空白组和造模前比较无统计学差异(P>0.05)。说明节律紊乱小鼠周期缩短,自然恢复不能显著恢复其周期,电针可促进节律紊乱小鼠周期恢复(表6)。
h

1) 与空白组比较,#P<0.05;与造模前比较ΔP<0.05;与造模时比较,*P<0.05
h

1)与空白组比较,#P<0.05;与造模前比较,ΔP<0.05
综上所述,电针在调整节律紊乱小鼠峰相位、起始活动时间及周期的作用优于捆绑组。电针可显著使超前的峰相位后移,提前的起始活动时间恢复,缩短的周期恢复至造模前水平。
3.3 各组SCN节律相关基因及节律相关转录因子表达量的变化
本实验将测定84个SCN节律相关基因,其中包括节律基因,节律相关转录因子,感光蛋白,环磷酸腺苷反应元件结合蛋白信号分子(cAMP- response element binding protein signaling , CREB)等。与空白组比较,模型组造模后小鼠生物钟相关基因表达上调的有8个,下降的有4个基因(见图2);造模后8个表达上调的基因为Aanat、Crx、Epo、Nkx2-5、Pax4、Prf1、Rora和Stat5a,8个上调基因中捆绑组有5个基因表达显著下调(Crx、Epo、Nkx2-5、Pax4和Prf1),电针干预后,有7个基因表达显著下调(除Stat5a);4个模型组表达下调的基因(Egr1、Per1 、Per3和Prokr2),在自然恢复后,仅有一个表达上调(Per3),而电针后均显著上调(见图3、图4)。

图2 超前性光暗周期转移后SCN节律相关基因及节律相关转录因子表达量的变化Fig.2 Different clock-related gene expression in the SCN between control and phase advanced mice

图3 自然恢复后SCN内部分生物钟基因及节律转录因子表达量的影响Fig.3 Different clock-related gene expression in the SCN between natural recovery and phase advanced mice
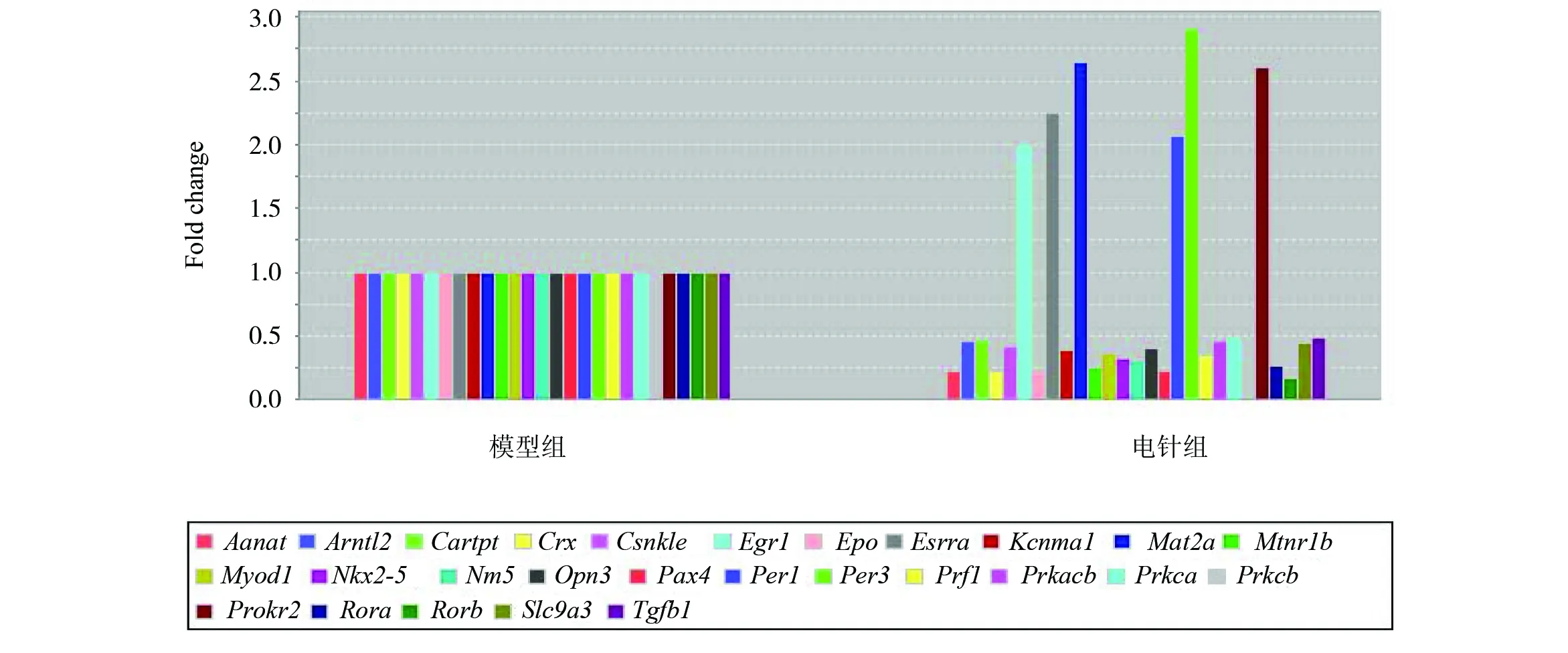
图4 电针干预后节律紊乱小鼠SCN内部分生物钟基因及节律转录因子表达量的变化Fig.4 Different clock-related gene expression in the SCN between EA and phase advanced mice
4 讨 论
昼夜节律是一种最常见的生命节律现象,主要包括入睡和睡眠-觉醒[13],体温[14],血压[15],激素分泌[16],消化液分泌[17]以及免疫应答[18]等。而这种正常的节律模式是生命活动正常进行的基础,正是因为人体的节律系统与外环境节律保持同步,才能够维持机体生命活动的正常有序。一旦这种节律同步活动被打破,很容易引发或者加重一系列节律紊乱相关疾病。电针作为一种外源性授时因子,可以促进节律紊乱的恢复。在本研究中,超前性光暗周期转移小鼠的时相特征主要表现为节律超前,而电针在节律紊乱小鼠重置昼夜节律地过程中起到良性调整作用。与捆绑组比较,电针组显著增强了节律紊乱小鼠昼夜节律地恢复效率,加快了峰相位恢复速度、起始活动时间重置速度和自发性活动周期的恢复。由此可知,电针能够作为一种加速因素使机体重置到外部环境的节律影响因子存在。
下丘脑的视交叉上核是节律系统的核心振荡器,也称之为“主钟”(master clock),副钟广泛分布于组织、器官中[19],环境中光照信号对节律的调整就是通过SCN而实现的。SCN约20 000个拥有自主节律周期的细胞构成,即使单个细胞也展现出代谢率和基因表达的高度节律性。SCN对节律的调控是通过对节律相关基因及其表达产物间形成的昼夜节律转录/翻译反馈环路进行的。其中,周期基因1(Period gene 1,Per1)是周期基因家族成员之一,在视交叉上核调控生物节律,节律紊乱会导致Per1基因表达下降。而电针可能通过上调节律紊乱小鼠SCN内Per1生物钟基因的表达从而影响整个生物钟转录-翻译反馈环路,使其节律调控功能恢复平衡,从而实现对紊乱性节律的调整作用;早期生长反应基因1(early growth response-1,Egr1),属于即刻早期基因家族,是哺乳动物节律相关转录因子,Egr1通过参与细胞周期素依赖性激酶( Cyclin-dependent kinases , CDKs)参与细胞周期调控[20],并且与Per1与Per2密切相关,节律紊乱后Egrl表达水平降低,且在电针后明显升高,可能也是电针调整生物节律的分子机制之一。芳基烷化胺N-乙酰转移酶(Arylalkylamine N-acetyltransferase,Aanat)是催化乙酰化作用的血清素,在褪黑激素合成过程中是一个最主要的限速酶,与睡眠相位后移症候群显著相关[21]。本实验观察了电针对节律紊乱小鼠SCN内Aanat水平,实验发现节律紊乱小鼠SCN内Aanat表达与空白组小鼠比较显著升高,针刺后明显降低,而捆绑组无显著变化。这一结果表明电针干预小鼠相较自然恢复小鼠而言能抑制Aanat的表达,这可能是电针通过抑制节律紊乱小鼠SCN内Aanat这一褪黑激素限速酶表达从而提高褪黑激素的分泌而较快的使紊乱的节律恢复至正常水平的分子机制之一;前动力蛋白受体2(Prokineticin receptor 2,Prokr2)属于蛋白编码基因,是SCN节律输出因子。Prokr2 mRNA在SCN上的表达具有节律性,Prokr2的节律相位与光照相关。分子和遗传研究证明,Prokr2由生物钟所调控。本实验结果提示Prokr2表达水平的降低有可能是节律紊乱小鼠自发性活动昼夜节律紊乱的分子机制之一。Prokr2 主要作为哺乳动物SCN 节律输出信号分子发挥其节律调控功能。本研究发现电针可以明显增高节律紊乱小鼠SCN 内Prokr2水平,捆绑组小鼠Prokr2水平改变却不明显。这提示电针可能是通过调控节律紊乱小鼠SCN 信号分子Prokr2的输出这一环节从而实现对节律紊乱小鼠自发性活动昼夜节律输出的调整作用,这也是电针节律调整作用的分子机制之一。
综上,本实验通过观察到SCN内这几种钟基因及其相关因子的表达量的变化,发现针可缩短超前性光暗周期转移小鼠的昼夜节律重置时间,加速紊乱昼夜节律的恢复,这可能是通过对SCN内Per1、Egr1、Aanat、Prokr2等节律相关基因的调控作用实现的。
[1] 诸毅晖. 电针调整慢性疲劳综合征昼夜节律的研究[D]. 成都:成都中医药大学,2008. CHU Y H. Therapeutic effects of electroacupuncture for chronic fatigue syndrome (CFS)[D] . Chengdu:Chengdu University of Traditional of Chinese Medicine,2008.
[2] 吴曦.慢性疲劳综合征患者病理节律特征及其电针调整机制研究[D]. 成都:成都中医药大学论文,2006. WU X. Corrective effects and of electroacupuncture for chronic fatigue syndrome (CFS)[D] . Chengdu: Chengdu University of Traditional of Chinese Medicine,2006.
[3] 诸毅晖,梁繁荣,吴曦,等.电针对慢性疲劳综合征患者唾液CS、MT昼夜节律的调整机制[J].山东医药,2007,47(28):18-20. CHU Y H,LIANG F R,WU X,et al.Mechanism of electric acupuncuture on saliva CS and MT circadian rhythm in chronic fatigue syndrome[J].Shandong Medical Journal, 2007,47(28):18-20.
[4] 李胜吾,薛红,吴佳,等.荷乳腺癌小鼠自发性活动节律变化特征及不同时相点电针对其效应的研究[J].成都中医药大学学报,2012,35(1):9-13. LI S W,XUE H,WU J,et al. Characteristics of activity rhythm of mice bearing breast tumor by electroacupuncture on changqiang ( GV 1) and baihui ( GV 20)[J].Journal of Chengdu Universty of TCM, 2012,35(1):9-13.
[5] 贾亚妹,王俊娟,刘文,等.电针、埋线调整吗啡成瘾C57BL/6J小鼠昼夜节律的变化研究[J].成都中医药大学学报,2014 (4):17-21. JIA Y M,WANG J J,LIU W,et al.Research of electro-acupuncture and catgut implantation regulate the changes of circadian rhythm of morphine-addiction mice[J]. Journal of Chengdu Universty of TCM,2014 (4):17-21.
[6] 姚海江,宋洪涛,莫雨平,等.电针对慢性应激诱导的抑郁模型大鼠体温及褪黑素昼夜节律的影响[J] .中国针灸,2014 (7):685-689. YAO H J,SONG H T,MO Y P,et al.Effects of electroacupuncture on circadian rhythm of temperature and melatonin in depression rats model induced by chronic stress[J].Chinese Acupuncture & Moxibustion, 2014 (7):685-689.
[7] FRENKEL L, CERIANI M F. Circadian plasticity: from structure to behavior[J]. Int Rev Neurobiol, 2011,99:107-138.
[8] FILIPSKI E,DELAUNAY F,KING V M,et al. Effects of chronic jet lag on tumor progression in mice[J]. Cancer Research,2004,64(21):7879-7885.
[9] PILORZ V, CUNNINGHAM P S, JACKSON A,et al. A novel mechanism controlling resetting speed of the circadian clock to environmental stimuli[J]. Current Biology,2014,24:766-773.
[10] 余曙光,徐斌.实验针灸学[M].北京:人民卫生出版社,2012. YU S G,XU B. Experimental acupuncture science[M]. Beijing:People’s Medical Publishing House Co,Ltd,2012.
[11] 王颖,贾亚妹,陈莎莎,等.电针不同穴位对小鼠自发性活动节律的影响[J].成都中医药大学学报,2015,38(1):1-4. WANG Y,JIA Y M,CHEN S S,et al.Effect of activity rhythm of mice by electroacupuncture different acupoint[J].Journal of Chengdu University of Traditional Chinese Medicine,2015,38(1):1-4.
[12] PAXINOS G, FRANKLIN K B J. The mouse brain in stereotaxic coordinates[M]. San Diego:Academic Press,2001.
[13] WULFF K, PORCHERET K, CUSSANS E, et al. Sleep and circadian rhythm disturbances: Multiple genes and multiple phenotypes[J]. Curr Opin Genet Dev,2009,19:237-246.
[14] CAJOCHEN C. High sensitivity of human melatonin, alertness, thermoregulation, and heart rate to short wavelength light[J]. J Clin Endocrinol Metab,2005,90:1311-1316.
[15] AGARWAL R. Regulation of circadian blood pressure: from mice to astronauts[J]. Curr Opin Nephrol Hypertens,2010,19:51-58.
[16] OSTER H, DAMEROW S, HUT R A, et al. Transcriptional profiling in the adrenal gland reveals circadian regulation of hormone biosynthesis genes and nucleosome assembly genes[J]. J Biol Rhythms,2006,21:350-361.
[17] FROY O. Metabolism and circadian rhythms-implications for obesity[J]. Endocr Rev,2010,31:1-24.
[18] KELLER M. A circadian clock in macrophages controls inflammatory immune responses[J]. Proc Natl Acad Sci U S A, 2009,106:21407-21412.
[19] ATON S J, HERZOG E D. Come together, right…now: Synchronization of rhythms in a mammalian circadian clock[J].Neuron, 2005, 48(4):531-534.
[20] DHAVAN R I, TSAI L H. A decade of CDK5[J].Nat Rev Mol Cell Biol,2001,2(10):749-759.
[21] BLOMEKE B, GOLKA K, GRIENFAHN B,et al.Arylalkylamine N-acetyltransferase (AANAT) genotype as a personal trait in melatonin synthesis[J]. J Toxicol Environ Health A, 2008,71(13/14):874-876.
Mechanism of clock-control gene in SCN involved in resetting circadian rhythm with electro-acupuncture on advances of light/dark cycle model mice
CHENShasha,WANGYing,WEIDaneng,XUEHong
(Chengdu University of Traditional Chinese Medicine, Chengdu 610075, China)
This study was to investigate the time phase of circadian rhythm of advances of light/dark cycle model mice, the effect of electro-acupuncture (EA) on their activity rhythms and the molecular regulating mechanism on the clock genes of suprachiasmatic nucleus (SCN). 44 male C57BL/6J mice were divided into 4 groups which were the blank group(n=10), the model group(n=12), the binding group(n=12) and the electro-acupuncture group (n=10) . We housed mice in LD cycle for 10 days. The control group was kept 12 h∶12 h LD of 20 days, and then SCN collected at ZT18. Then 8 hours advance of light onset every 2 days of 5 times. The model group was collected tissue at ZT18 when model successful. The binding group binds as the same time with the electro-acupuncture group. Electro-acupuncture group was treated at ZT16, on Zhiyang (GV 9) and Ganshu (BL 18) with acupuncture needle one time a day of three days. The SCN were collected at ZT18 at the third day. At last, samples of SCN were measured by PCR Array method to test the gene expression level. The experiment results are:① After the model was established, phase positions and onset of activity rhythms were advanced and period was shorten compared with the control group (P<0.05). After resynchronization, the phase positions and onset of activity rhythms of the electro-acupuncture group were delay respectively compared with the control group and the model group. The period at the 1stand 2ndday after resynchronization of the electro-acupuncture group had significant differences with the control group and itself before.② Compared with the control group, there were 8 genes upregulated(Aanat、Crx、Epo、Nkx2-5、Pax4、Prf1、Rora、Stat5a) and 4 genes decreased(Egr1、Per1 、Per3、Prokr2) of the model group. There were 3 genes upregulated(Esrra、Mat2a、Per3) and 11 genes decreased(Cartpt、Crx、Epo、Kcnma1、Mtnr1b、Nkx2-5、Nms、Pax4、Prf1、Prkacb、Prkca) of binding group compared with model group; after electro-acupuncture there were 6 upregulated(Egr1、Esrra、Mat2a、Per1、Per3、Prokr2) and 21 decreased(Aanat、Arntl、Cartpt、Crx、Csnk1e、Epo、Kcnma1、Mtnr1b、Myod1、Nkx2-5、Nms、Opn3、Pax4、Prf1、Prkacb、Prkca、Prkcb、Prokr2、Rora、Rorb、Slc9a3、Tgfb1). The results indicate electro-acupuncture can regulate onset of activity rhythms and period. Regulating the expressions of some clock genes in SCN of the circadian rhythm disturbance mice was probably one of the molecular mechanisms of electro-acupuncture to regulate the activity rhythms of circadian rhythm disturbance animals.
electro-acupuncture; advances of light/dark cycle; circadian rhythm; SCN; clock genes
2016-08-10 基金项目:国家自然基金面上项目(81373739);四川省教育厅项目(15ZB0089)
陈莎莎(1987年生),女;研究方向:时间针灸学;E-mail:ceciliacss@163.com
薛红(1971年生),女;研究方向:时间针灸学;E-mail:cdxuehong@126.com
10.13471/j.cnki.acta.snus.2017.02.003
R245.9+7;R446.7
A
0529-6579(2017)02-0013-09

