右美托咪定对长时间腹腔镜手术所致肝脏缺血再灌注损伤的影响
王 斌, 张铁铮
(1. 第四军医大学西京医院 麻醉科, 陕西 西安, 710032; 2. 沈阳军区总医院 麻醉科, 辽宁沈阳, 110000)
右美托咪定对长时间腹腔镜手术所致肝脏缺血再灌注损伤的影响
王 斌1, 张铁铮2
(1. 第四军医大学西京医院 麻醉科, 陕西 西安, 710032; 2. 沈阳军区总医院 麻醉科, 辽宁沈阳, 110000)
目的 评价右美托咪定对长时间腹腔镜手术所致肝脏缺血再灌注损伤的影响。方法 选取择期经达芬奇手术机器人进行结直肠肿瘤根治术的患者70例,采用随机数字表法将其分为对照组和试验组。试验组在麻醉诱导前及全麻维持期静脉泵注右美托咪定,对照组给予等量生理盐水泵注。于气腹充气前1 min(T1)和排气后30 min(T2)、60 min(T3)、2 h(T4)检测ALT、AST; 测定血浆IL-8、TNF-α、丙二醛(MDA)、超氧化物歧化酶(SOD)浓度。 结果 与对照组比较,试验组T2、T3、T4时ALT、AST显著降低,血浆IL-8、TNF-α、MDA浓度显著降低, SOD水平显著升高(P<0.05)。2组患者术后住院时间比较无显著差异(P>0.05)。结论 右美托咪定可减轻长时间腹腔镜手术所致肝脏缺血再灌注损伤。
右美托咪定; 再灌注损伤; 腹腔镜; 结直肠肿瘤根治术
腹腔镜手术中常需CO2建立气腹,以维持必要的操作空间,研究[1-3]证实长时间的腹内压升高会严重影响肝脏、肠道等内脏血流的灌注,在气腹期间内脏器官血流量减少,而解除气腹后血流 恢复会容易出现缺血再灌注损伤(IRI)[4-7]。随着医疗技术进步,一些复杂的手术也可以采取腹腔镜进行操作,而这需要较长时间,气腹时间可达3~4 h, 甚至更长,有研究[8]表明气腹引起的IRI严重程度是与气腹时间的长短成正比的。右美托咪定是高选择性α2肾上腺素能受体激动剂,很多研究[9-11]表明其具有抗IRI及器官保护作用。本研究评价右美托咪定对长时间腹腔镜手术所致肝脏缺血再灌注损伤的影响,现报告如下。
1 资料与方法
1.1 一般资料
选取择期经达芬奇手术机器人进行结直肠肿瘤根治术的患者70例(平均手术时间在4 h左右,气腹压力10~15 mmHg), 性别不限,年龄18~70岁,体质量指数18~25 kg/m2, ASA分级Ⅱ~Ⅲ级。采用随机数字表法将其分为对照组(生理盐水)和试验组(右美托咪定)各35例。本研究已获本院医学伦理委员会批准,患者或其家属签署知情同意书。2组患者一般情况比较,差异无统计学意义(P>0.05), 见表1。

表1 2组患者一般情况比较
1.2 治疗方法
术前常规禁食水8 h, 无术前用药。入手术室后常规监测ECG、BP和SpO2, 开放上肢静脉通路,输注乳酸钠林格氏液8 mL/kg, 局麻下桡动脉穿刺置管(肝素抗凝保留,供采集血样及监测动脉有创血压)。所有手术均在气管插管全身麻醉下进行,全麻诱导采用咪达唑仑0.03 mg/kg、芬太尼3 μg/kg、丙泊酚2 mg/kg、罗库溴铵0.1 mg/kg, BIS值达到40~65时进行气管插管。麻醉维持采用丙泊酚靶控输注2.0 μg/mL, 微量泵注瑞芬太尼10~25 μg/(kg·h), 每40 min追加罗库溴铵0.15 mg/kg, 维持BIS值40~65。术中根据BIS及血流动力学来调整丙泊酚和瑞芬太尼的泵注速度。采用容量控制通气模式,潮气量设定为6~8 mL/kg, 维持气道压在30 cmH2O以内, p(CO2)维持在35~40 mmHg。术中监测ECG、HR、BP、SpO2、PEtCO2和出入量。根据失血情况,若血红蛋白80 g/L酌情给予血液制品。每组均于气腹排气后停止泵注丙泊酚和瑞芬太尼,静脉注射止吐药昂丹司琼8 mg, 给予地佐辛镇痛。术毕,待患者自主呼吸完全恢复,咳嗽反射恢复,循环系统稳定,呼唤可睁眼时拔除气管导管,待患者稳定后送外麻醉恢复室。
试验组在麻醉诱导前,静脉泵注右美托咪定1.0 μg/kg共10 min, 全麻维持期持续静脉泵注右美托咪定0.5 μg/(kg·h), 对照组给予生理盐水泵注。于气腹充气前1 min(T1)和排气后30 min(T2)、60 min(T3)、2 h(T4)分别抽取桡动脉血样5 mL, 离心后取上清液, -80 ℃保存。检测患者肝脏功能的谷丙转氨酶(ALT)、谷草转氨酶(AST); 测定血浆IL-8、TNF-α、丙二醛(MDA)、超氧化物歧化酶(SOD)浓度。
1.3 统计学分析
采用SPSS 19.0统计学软件进行分析。计量资料以均数±标准差表示,组间比较采用成组t检验,组内比较采用重复测量设计的方差分析,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 2组患者各时点炎性反应和脂质过氧化反应指标比较
2组患者T1各项指标血清含量无显著差异(P>0.05)。与T1时比较, 2组在T2、T3、T4时血浆IL-8、TNF-α、MDA浓度显著升高, SOD水平显著降低(P<0.05); 与对照组比较,试验组在T2、T3、T4时血浆IL-8、TNF-α、MDA浓度显著降低, SOD水平显著升高(P<0.05), 见表2。
2.2 2组患者各时点ALT和AST的比较
2组患者T1时ALT和AST血清含量无显著差异(P>0.05)。与T1时比较, 2组在T2、T3、T4时血浆ALT、AST浓度显著升高(P<0.05); 与对照组比较,试验组在T2、T3、T4时血浆ALT、AST浓度显著降低(P<0.05), 见表3。对照组和试验组的患者术后平均住院时间都在12 d左右,差异无统计学意义(P>0.05)。
3 讨 论
本研究结果显示,与气腹充气前(T1)比较, 2组患者在气腹排气后30 min(T2)、1 h(T3)、2 h(T4)的ALT、AST都显著升高(P<0.05), 说明2组患者在气腹排气后肝脏都受到了IRI, 这也与一些既往研究是一致的[12-14]。但试验组患者在T2、T3、T4时间点的ALT、AST显著低于对照组,说明右美托咪定可减轻患者肝脏的缺血再灌注损伤。

表2 2组患者各时点炎性反应和脂质过氧化反应指标比较
与T1比较, *P<0.05; 与对照组比较, #P<0.05。
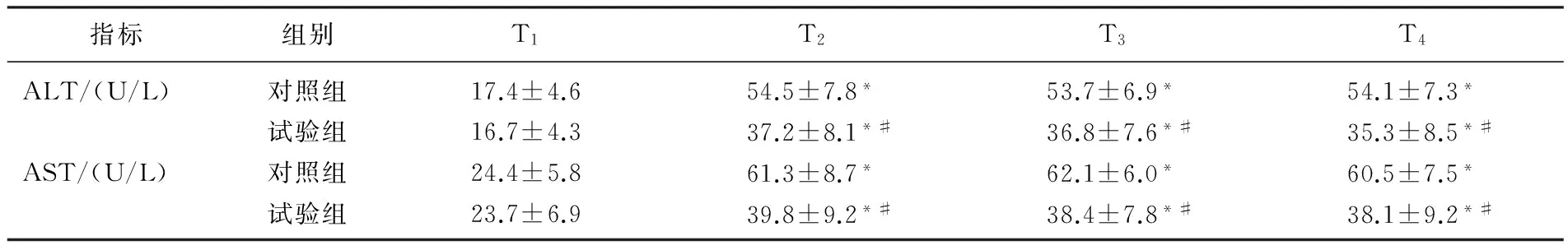
表3 2组患者各时点ALT和AST的比较
与T1比较, *P<0.05; 与对照组比较, #P<0.05。
右美托咪定是高选择性α2肾上腺素能受体激动剂,除产生镇静、催眠作用外,还具有镇痛、抑制交感兴奋、抗焦虑、稳定血流动力学和利尿的效应,主要用于ICU镇静和临床麻醉辅助用药,其不良反应主要是低血压和心动过缓。很多研究[9-11]表明其具有抗IRI及器官保护作用。
患者肝脏在气腹期间处于缺血状态,造成细胞缺氧和髙能磷酸化合物分解,代谢产物蓄积。在恢复血流后处于氧化应激状态,产生大量的氧自由基。氧自由基主要通过脂质过氧化作用损伤细胞[5], 氧自由基可与生物大分子,特别是细胞膜上的不饱和脂肪酸反应从而形成脂质过氧化物,脂质过氧化物不稳定,降解生成丙二醛(MDA), MDA可使DNA、蛋白质发生交联和聚合,造成细胞的损伤[8, 15]。机体受到氧化应激的损伤刺激后激发自身内源性防御机制,其中最重要的是以超氧化物岐化酶(SOD)为代表的抗氧化酶体系[16-17], 由于大量氧自由基产生,以SOD为代表的抗氧化酶急剧消耗,从而使这种平衡被打乱,使IRI对机体损害加剧。与对照组比较,试验组在T2、T3、T4时MDA浓度显著降低, SOD水平显著升高(P<0.05), 说明右美托咪定可以抑制患者在IRI中出现的脂质过氧化反应。
炎症反应是造成IRI的另一重要机制,目前比较肯定的是中性粒细胞介导的炎症反应。激活的中性粒细胞释放大量的细胞因子和炎性介质,如IL-8、TNF-α、IL-6等,从而导致炎性反应的失控[18]。肿瘤坏死因子-α(TNF-α)是在缺血再灌注损伤中最早出现、最敏感的炎症因子之一, TNF-α可以促进机体一系列的炎症反应和病理生理过程,包括损伤血管内皮细胞、增加血管通透性、诱发IL-6、IL-8等其他炎症因子的释放等[19]。目前认为由TNF-α、IL-6诱发的炎症反应在很大程度上是通过诱导产生以IL-8为代表的趋化因子所介导的。IL-8是中性粒细胞主要的趋化和活化因子,且在炎症反应中起更直接的介导作用[20]。与对照组比较,试验组在T2、T3、T4时血浆IL-8、TNF-α浓度显著降低(P<0.05), 说明右美托咪定可以抑制患者在IRI中出现的炎性反应。
综上所述,右美托咪定可减轻长时间腹腔镜手术所致肝脏缺血再灌注损伤,可能与其抑制炎性反应和脂质过氧化反应有关。
[1] Diebel L N. Effect of increased intra-abdominal pressure on hepatic arterial, portal venous, and hepatic microcirculatory blood flow[J]. J Trauma, 1992, 33(2):279-283.
[2] Eleftheriadis E. Splanchnic ischemia during laparoscopic cholecystectomy[J]. Surg Endosc, 1996, 10(3): 324-326.
[3] Sanchez-Etayo G. Effect of intra-abdominal pressure on hepatic microcirculation: implications of the endothelin-1 receptor[J]. J Dig Dis, 2012, 13(9): 478-485.
[4] Glantzounis G K. Laparoscopic surgery-induced changes in oxidative stress markers in human plasma[J]. Surg Endosc, 2001, 15(11): 1315-1319.
[5] Glantzounis G K. Alterations in plasma oxidative stress markers after laparoscopic operations of the upper and lower abdomen[J]. Angiology, 2005, 56(4): 459-465.
[6] Baysal, Z. , et al. , Evaluation of total oxidative and antioxidative status in pediatric patients undergoing laparoscopic surgery[J]. J Pediatr Surg, 2009, 44(7): 1367-1370.
[7] Yagmurdur H. The effects of etomidate, thiopental, and propofol in induction on hypoperfusion-reperfusion phenomenon during laparoscopic cholecystectomy[J]. Acta Anaesthesiol Scand, 2004, 48(6): 772-777.
[8] Sammour T. Systematic review of oxidative stress associated with pneumoperitoneum[J]. Br J Surg, 2009, 96(8): 836-850.
[9] Wang Z X. Dexmedetomidine reduces intestinal and hepatic injury after hepatectomy with inflow occlusion under general anaesthesia: a randomized controlled trial[J]. British Journal of Anaesthesia, 2014, 112(6): 1055-1064.
[10] 郝楠楠, 陈晖, 雷志礼. 右美托咪定对脏器缺血/再灌注损伤的保护作用机制[J]. 国际麻醉学与复苏杂志, 2013, 34(10): 909-913.
[11] Guler L. Comparison of the Effects of Dexmedetomidine vs. Ketamine in Cardiac Ischemia/Reperfusion Injury in Rats - Preliminary Study[J]. Adv Clin Exp Med, 2014, 23(5): 683-689.
[12] Hoekstra L T. Effects of prolonged pneumoperitoneum on hepatic perfusion during laparoscopy[J]. Ann Surg, 2013, 257(2): 302-307.
[13] Li J. Two clinically relevant pressures of carbon dioxide pneumoperitoneum cause hepatic injury in a rabbit model[J]. World J Gastroenterol, 2011, 17(31): 3652-3658.
[14] Gupta R. Effects of varying intraperitoneal pressure on liver function tests during laparoscopic cholecystectomy[J]. J Laparoendosc Adv Surg Tech A, 2013, 23(4): 339-342.
[15] Del R D, Stewart A J, Pellegrini N. A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress[J]. Nutr Metab Cardiovasc Dis, 2005, 15(4): 316-328.
[16] Dhalla N S. Status of myocardial antioxidants in ischemia-reperfusion injury[J]. Cardiovasc Res, 2000, 47(3): 446-456.
[17] Granger D N. Role of xanthine oxidase and granulocytes in ischemia-reperfusion injury[J]. Am J Physiol, 1988, 255(6 Pt 2): H1269-1275.
[18] Blancke F. Systemic inflammation and reperfusion injury in patients with acute myocardial infarction[J]. Mediators Inflamm, 2005, 2005(6): 385-389.
[19] Spielmann S. Early detection of increased tumour necrosis factor alpha (TNFalpha) and soluble TNF receptor protein plasma levels after trauma reveals associations with the clinical course[J]. Acta Anaesthesiol Scand, 2001, 45(3): 364-370.
[20] Butler J. Systemic inflammatory responses to cardiopulmonary bypass: a pilot study of the effects of pentoxifylline[J]. Respir Med, 1993, 87(4): 285-288.
Effect of dexmedetomidine on liver ischemia reperfusion injury induced by long time laparoscopic surgery
WANG Bin1, ZHANG Tiezheng2
(1.DepartmentofAnesthesia,XijingHospitalAffiliatedtoTheFourthMilitaryMedicalUniversity,Xi′an,Shaanxi, 710032; 2.DepartmentofAnesthesia,GeneralHospitalofShenyangMilitaryCommand,Shenyang,Liaoning, 110000)
Objective To evaluate the effect of dexmedetomidine on liver ischemia reperfusion injury induced by long time laparoscopic surgery. Methods Seventy patients with radical resection of colorectal cancer were randomly divided into control group and experimental group. In experimental group, dexmedetomidine was infused before anesthesia induction and in duration of general anesthesia, while the equal volume of normal saline was given in control group. At 1 min before inflation (T1), at 30 min (T2), 60 min (T3), 2 h (T4) after exhaustion, the levels of plasma alanine aminotransferase (ALT), aspartate transaminase(AST), malondialdehyde (MDA) and superoxide dismutase (SOD), and tumor necrosis factor-α(TNF-α) and interleukin-8 (IL-8) were detected. Results Compared with control group, the levels of plasma ALT, AST, MDA, TNF-αand IL-8 decreased significantly and the level of plasm SOD increased significantly at T2, T3, T4in experimental group (P<0.05). There was no significant difference in the time of postoperative hospitalization between the two groups (P>0.05). Conclusion Dexmedetomidine can reduce liver ischemia reperfusion injury induced by long time laparoscopic surgery.
dexmedetomidine; reperfusion injury; laparoscope; radical resection of colorectal cancer
2016-12-18
军队后勤科研重点项目(BWS12J008)
R 614
A
1672-2353(2017)09-103-03
10.7619/jcmp.201709026

