生物免疫传感器检测迟缓爱德华氏菌研究*
王淑娴, 曲梁静, 刁 菁, 王晓璐, 叶海斌, 魏鉴腾
(1.山东省海洋生物研究院 病害与渔药研究中心,山东 青岛 266104;2.中国科学院 兰州化学物理研究所 中国科学院西北特色植物资源化学重点实验室和甘肃省天然药物重点实验室,甘肃 兰州 730000;3.青岛市资源化学与新材料研究中心,山东 青岛 266000)
生物免疫传感器检测迟缓爱德华氏菌研究*
王淑娴1, 曲梁静1, 刁 菁1, 王晓璐1, 叶海斌1, 魏鉴腾2,3
(1.山东省海洋生物研究院 病害与渔药研究中心,山东 青岛 266104;2.中国科学院 兰州化学物理研究所 中国科学院西北特色植物资源化学重点实验室和甘肃省天然药物重点实验室,甘肃 兰州 730000;3.青岛市资源化学与新材料研究中心,山东 青岛 266000)
迟缓爱德华氏菌(E.tarda)是最为严重的水产动物致病菌之一,准确、即时的检测手段是预防控制该菌传播的关键所在。通过量子点(QDs)标记E.tarda单克隆抗体(Ab),利用生物免疫传感器技术实现E.tarda的快速、特异性检测。结果显示,QDs-Ab的荧光通过加入氧化石墨烯(GO)产生淬灭,构建了捕获目标细菌的探针,GO最适淬灭浓度为60 μg/L。细菌捕获探针中加入E.tarda后,能够检测到重新恢复强度的橙色荧光。针对E.tarda设计的生物免疫传感器的特异性,选取灿烂弧菌、溶藻胶弧菌、副溶血弧菌和嗜水气单胞菌作为对照,结果显示,对照组不能明显引起荧光强度的改变,而实验组却能显著提高荧光强度。本研究建立的基于荧光能量共振转移(FRET)的具有高灵敏度和特异性的生物传感器检测方法在细菌的早期诊断中有良好的应用潜质。
生物免疫传感器; 迟缓爱德华氏菌; 氧化石墨烯; 量子点; 荧光能量共振转移
0 引 言
迟缓爱德华氏菌(Edwardsiella tarda,E.tarda)是一种革兰氏阴性菌,兼性厌氧菌,体短,杆状,可运动,属于Enterobacteriaceae家族,长度为2~3 μm,直径为 1 μm[1]。该菌宿主广泛,包括鱼类、鸟类、爬行类以及人类[2,3]。E.tarda感染人后能够引起肠胃疾病以及其他症状,比如肌坏死和伤口感染等。在水产养殖业,E.tarda被认为是最为严重的致病菌之一,因为它能广泛地感染海水以及淡水鱼,包括牙鲆、罗非鱼、鳗鱼以及斑点叉尾鱼[4,5]。E.tarda感染鱼类后,导致宿主产生一种被称为E.tarda的系统性疾病,该病在牙鲆中的症状表现为出血、败血病、皮肤损伤以及肝肠肾的坏死等[6,7]。为有效控制E.tarda病原的扩散, 准确、即时的检测手段是预防控制该菌传播的关键。
目前,由于生物传感器技术的快速、简单、高灵敏度以及良好的重现性,使得这种方法越来越受到人们的关注[8~13]。人们将纳米技术应用到生物传感器的研究中提高生物检测的灵敏度和特异性[14,15]。多种纳米材料,包括半导体量子点(QDs)、金属或半导体纳米线、碳纳米管(CNTs)、纳米结构的导电聚合物在光学和电传感器的应用中已经有了广泛报道[16~19]。作为迄今为止最薄、最硬材料的石墨烯迅速成为相关领域研究的明星[20~24]。氧化石墨烯(GO)是石墨烯的一种重要的衍生物,主要通过化学方法剥离石墨得到。相对石墨烯,GO不但具有平面结构,且含有较多的含氧功能基团(环氧基、羟基、羧基)。这使得GO能够容易分散到各种溶剂中,极大扩展了GO在材料、化学及传感器领域的应用范围。GO自身具有荧光性质,可以制备荧光分析探针,构建荧光传感器。同时GO通过荧光能量共振转移(FRET)和非辐射偶极—偶极相互作用能有效淬灭荧光体(染料分子,QDs及上转换纳米材料)的荧光。在基于FRET的系统中,QDs由于其固有的光学性质,例如:高量子产率,高漂白阈值,良好的化学稳定性,窄发射峰等已经被广泛地用作有效能量转移供体[8,25,26]。
本文建立了一种新的检测方法,通过QDs标记E.tarda单克隆抗体(Ab),实现E.tarda的快速、特异性检测。
1 检测方法
检测方案见图1。首先将抗体与生物素连接,再将链霉素共价修饰的发橙色荧光的QDs通过链霉素—生物素相互反应与抗体连接起来得到量子点—抗体(QDs-Ab)。QDs-Ab的荧光通过加入GO产生了淬灭,从而构建了捕获目标细菌的探针。一旦这种细菌捕获探针暴露于E.tarda中,由于抗原抗体共价反应,QDs-Ab将被释放出来,从而能够检测到重新恢复强度的橙色荧光。利用这一新型检测方法,能够快速、特异地检测E.tarda。
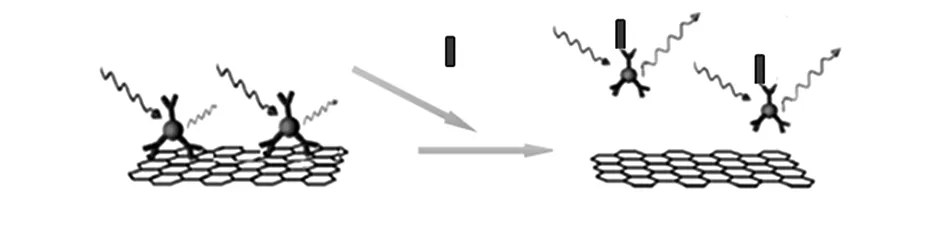
图1 GO生物免疫传感器用于E.tarda快速检测方法示意
2 材料与过程
2.1 材 料
NaH2PO4·2H2O,Na2HPO4·12H2O,NaCl,购自国药集团化学试剂有限公司;生物素N—羟基琥珀酰亚胺酯,N,N—二甲基甲酰胺购自Sigma公司;E.tarda由本实验室保种;Ab购自Santa Cruz生物技术有限公司;GO购自苏州恒球石墨烯科技有限公司;QDs标记的链霉亲和素—605(SA-QDs)购自武汉珈源量子点公司。
2.2 仪 器
紫外可见吸收光谱数据由UV—2550紫外—可见光分光光度计测定;荧光光谱数据由F96PRO荧光分光光度计收集。
2.3 过 程
2.3.1 制备菌悬液
将E.tarda传代培养3次,28 ℃过夜培养,吸取1 mL菌液,灭菌生理盐水梯度稀释后用血球计数板计数。
2.3.2 生物素—抗体制备
Ab的浓度为0.1 g/L。用N,N—二甲基甲酰胺将生物素N—羟基琥珀酰亚胺酯配制成2.5 g/L的溶液,将0.8 μL溶液迅速加入10 μL Ab溶液中,冰浴2.5 h。过量未反应和水解的生物素用微量透析管4 ℃搅拌透析8 h去除,换液1~2次。生物素—抗体的终浓度用紫外—可见光分光光度计测定为0.2 g/L。
2.3.3 QDs-Ab制备
将1 μmol/L的量子点标记的链霉亲和素—605与合适浓度的生物素—抗体在10 mmol/L PBS溶液中混合,避光轻柔震荡15 min。加入过量的生物素封闭QDs-Ab,再用微量透析管4 ℃搅拌避光透析8 h,换液1~2次。
2.3.4 荧光检测
该反应体系包括适当浓度的QDs-Ab,GO和E.tarda,由15 mmol/L的PBS(pH 8.0,15 mmol/L NaCl)缓冲液配制,终体积为0.6 mL。溶液的荧光发射光谱,在15 min后测定。所有的光学测量在室温环境条件下进行,激发波长(λex)为350 nm。
3 结果与讨论
在最近的研究中,GO由于其独特的电子、机械和热能性在生物检测领域受到广泛关注[28]。而QDs一直因为各种杰出的光学特性,包括高量子产率、广激发光谱、窄发射光谱和耐光漂白性[29]成为荧光共振能量转移(FRET)能量供体的热门选择。该免疫传感器是基于FRET技术建立起来的,其中QDs和GO分别是能量供体和受体。
本文利用GO能够淬灭QDs荧光的性质研究了FRET技术的性能。当发橙色荧光的QDs-Ab靠近GO时,GO的超强淬灭能力即发挥作用。图2为当加入不同浓度的GO时,FRET免疫传感器的荧光光谱,其中,GO的浓度为0,1,3,5,10,15,30,45,60,75 μg/L(从上到下)。当GO的浓度从5 μg/L增加至75 μg/L时,荧光强度显著下降。当GO的浓度小于1 μg/L时,荧光淬灭的效果不甚明显,这可能是由于GO与QDs-Ab之间没有完全吸收造成的。ΔF值随着GO浓度的增加而升高,当GO浓度超过75 μg/L时,ΔF值进入平台期,这表明QDs-Ab被完全吸附在GO上,如图3所示。当细菌捕获探针体系中加入E.tarda后,过量的GO将不利于QDs-Ab的解吸附。本研究中GO的最适浓度为60 μg/L。
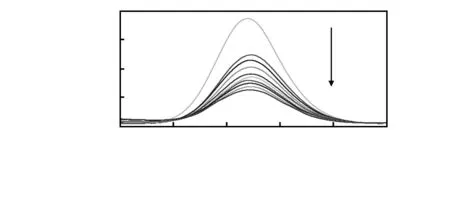
图2 加入不同浓度的GO后QDs-Ab (1 nmol/L)的荧光光谱
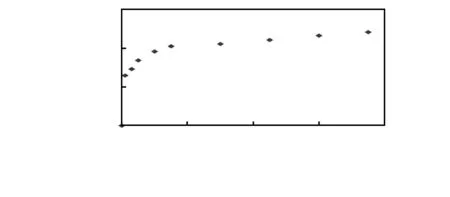
图3 在605 nm处QDs-Ab随GO浓度变化的荧光淬灭曲线
QDs-Ab与GO之间通过π-π非共价键的相互作用使得QDs-Ab能够靠近GO表面。QDs-Ab的高效荧光淬灭现象可以被视为QDs-Ab与GO之间有效的FRET直接结果。QDs-Ab与GO之间极强的相互作用以及GO的高度稳定性和水溶性使得GO成为一种极好的淬灭剂[12]。超高的淬灭效率能够导致一个很高的信噪比,可实现目标检测的高灵敏性。利用QDs-Ab与GO之间的FRET原理,初步构建了一个高度灵敏的细菌检测方法。在最适条件下,利用“打开”式荧光检测模型可以检测E.tarda。图4为加入不同浓度细菌后,Ab-QDs-GO荧光强度变化情况。其中,E.tarda的浓度为0,2×102,2×103,2×105,2×107CFU/mL(从下到上)
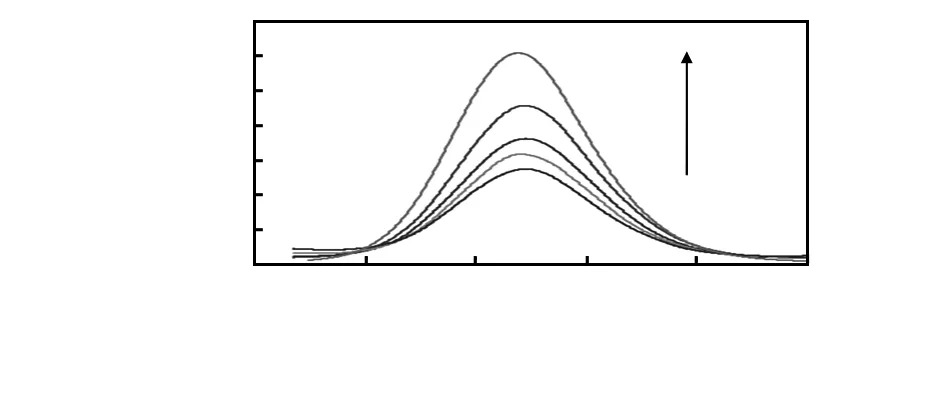
图4 加入不同浓度E.tarda后Ab-QDs-GO的荧光图谱
在评价一种新型免疫传感器的潜在应用性能时,特异性指标是一个非常重要的因素。因此,为了检测针对E.tarda设计的FRET传感器的特异性,本研究选取了灿烂弧菌、溶藻胶弧菌、副溶血弧菌和嗜水气单胞菌作为对照,如图5所示。图中曲线从上到下,依次为Ab-QDs-GO-E.tarda;Ab-QDs-GO-灿烂弧菌;Ab-QDs-GO-溶藻胶弧菌;Ab-QDs-GO-副溶血弧菌;Ab-QDs-GO-嗜水气单胞菌;Ab-QDs-GO。结果显示,对照组不能明显引起荧光强度的改变,而实验组却能显著提高荧光强度。检测结果说明,该FRET免疫传感器可以特异性地检测E.tarda。
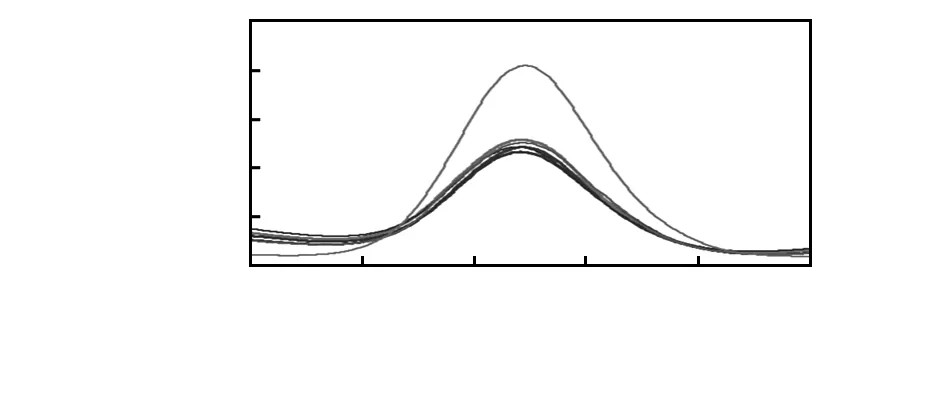
图5 加入不同种细菌后Ab-QDs-GO的荧光图谱
3 结 论
由于水溶性的GO对QDs具有超强的淬灭作用,本研究建立了一种基于FRET的具有高灵敏度和特异性的生物传感器检测方法,该方法能够快速、灵敏、特异性地检测E.tarda。基于GO的生物传感器构建简单并且有一些显著的优点:1)GO对QDs的超强淬灭效率导致背景很低,使本文方法具有很好的灵敏性和选择性。2)由于GO可以作为不同种QDs的能量受体,因此,该检测方法不像其他常规能量转移系统,不需要特殊配对的能量供体和受体。通过改变抗体,该检测方法可以实现任意细菌的检测,在细菌的早期诊断中有良好的应用潜质。
[1] Woo P T K,Bruno D W.Fish diseases and disorders[M].2nd ed. Volume 3:Viral,bacterial and fungalinfections.In Edwardsiella Septicaemias.
[2] Ling S H M,Wang X H,Xie L,et al.Use of green fluorescent protein(GFP)to track the invasive pathways of Edwardsiella tarda in the in vivo and in vitro fish models[J].Microbiology,2000,146:7-19.
[3] Nelson J J,Nelson C A,Carter J E.Extraintestinal manifestations of Edwardsiella tarda infection:A 10-year retrospective review[J].J La State Med Soc,2009,161:103-106.
[4] Matsuyama T,Kamaishi T,Ooseko N,et al.Pathogenicity of motile and non-motile Edwardsiella tarda to some marine fish[J].Fish Pathol,2005,40:133-135.
[5] Thune R L,Stanley L A,Cooper R K.Pathogenesis of gram-negative bacterial infections in warmwater fish[J].Annu Rev Fish Dis,1993,3:37-68.
[6] Mohanty B R,Sahoo P K.Edwardsiellosis in fish:A brief review[J].J Biosci,2007,32:1331-1344.
[7] Rashid M M,Nakai T,Muroga K,et al.Pathogenesis of experimental edwardsiellosis in Japanese flounder Paralichthys olivaceu-s[J].Fish Sci,1997,63:384-387.
[8] Boeneman,K B,Mei C,Dennis A M,et al.Sensing caspase 3 activity with quantum dot-fluorescent protein assemblies[J].J Am Chem Soc,2009,131:3828-3829.
[9] Lee S,Ryu J H,Park K,et al.Polymeric nanoparticle-based activatable near-infrared nanosensor for protease determination in vivo[J].Nano Lett,2009,9:4412-4416.
[10] Mu C J,LaVan D A,Langer R S,et al.Self-assembled gold nanoparticle molecular probes for detecting proteolytic activity in vivo[J].ACS Nano,2010,4:1511-1520.
[11] Zhang M,Yin B C,Wang X F,et al.Interaction of peptides with graphene oxide and its application for real-time monitoring of protease activity[J].Chem Commun,2011,47:2399-2401.
[12] Chen L,Zhang X W,Zhou G H,et al.Simultaneous determination of human enterovirus 71 and coxsackievirus B3 by dual-color quantum dots and homogeneous immunoassay[J].Anal Chem,2012,84:3200-3207.
[13] Zhang C L,Gao D,Zhou G H,et al.Label-free homogeneous immunosensor based on FRET for the detection of virus antibody in serum[J].Chem Asian J,2012,7:1764-1767.
[14] Cui Y,Wei Q,Park H,et al.Nanowire nanosensors for highly sensi-tive and selective detection of biological and chemical species[J].Science,2001,293:1289-1292.
[15] Wu G,Datar R H,Hansen K M,et al.Bioassay of prostate-specific antigen(PSA)using microcantilevers[J].Nat Biotechnol,2001,19:856-860.
[16] Alivisatos P.The use of nanocrystals in biologicaldetection[J].NatBiotechnol,2004,22:47-52.
[17] Zhang J,Lakowicz J R.A model for DNA detectionby metal-enhanced fluorescence from immobilizedsilver nanoparticles on solid substrate[J].J Phys Chem:B,2006,110:2387-2392.
[18] Zhang C,Yeh H,Kuroki M T,et al.Singlequantum-dot-based DNA nanosensor[J].Nat Mater,2005,4:826-831.
[19] Welsher K,Liu Z,Daranciang D,et al.Selective probing and imaging of cells with single walled carbon nanotubes as near-infrared fluorescent molecules[J].Nano Lett,2008,8:586-590.
[20] Zhao X H,Kong R M,Zhang X B,et al.Graphene-DNA zyme-based biosensor for amplified fluorescence“Turn-On”detection of Pb2+with a high selectivity[J].Anal Chem,2011,83:5062-5066.
[21] Jiang J H,Chang H X,Tang L H,et al.Graphene fluorescence resonance energy transfer aptasensor for the thrombin detec-tion[J].Anal Chem,2010,82:2341-2346.
[22] Gilje S,Han S,Wang M,et al.A chemical route to graphene for device applications[J].Nano Lett,2007,7:3394-3398.
[23] Stankovich S,Dikin D A,Dommett G H B,et al.Graphene-based composite materials[J].Nature,2006,442:282-286.
[24] Xu Y X,Bai H,Lu G W,et al.Flexible graphene films via the filtration of water-soluble noncovalent functionalized graphene sheets[J].J Am Chem Soc,2008,130:5856-5857.
[25] Medintz I L,Clapp A R,Brune l F M,et al.Proteolytic activity monitored by fluorescence resonance energy transfer through quantum-dot-peptide conjugates[J].Nat Mater,2006,5:581-589.
[26] Shi L F,Paoli V D,Rosenzweig N,et al.Synthesis and application of quantum dots FRET-based protease sensors[J].J Am Chem Soc,2006,128:10378-10379.
[27] Shi L F,Rosenzweig N,Rosenzweig Z.Luminescent quantum dots fluorescence resonance energy transfer-based probes for enzymatic activity and enzyme inhibitors[J].Anal Chem,2007,79:208-214.
[28] Song J L,Yin Z Y,Yang Z J,et al.Enhancement of photogenera-ted electron transport in dye-sensitized solar cells with introduction of a reduced graphene oxide-TiO2junction[J].Chem-Eur J,2011,17:10832-10837.
[29] Mei B C,Susumu K,Medintz I L,et al.Polyethylene glycol-based bidentate ligands to enhance quantum dot and gold nanoparticle stability in biological media[J].Nat Protoc,2009,4:412-423.
Research of immuno-biosensor for Edwardsiella tarda detection*
WANG Shu-xian1, QU Liang-jing1, DIAO Jing1, WANG Xiao-lu1, YE Hai-bin1, WEI Jian-teng2,3
(1.Mariculture Institute of Shandong Province,Shandong Province Key Laboratory for Disease Control of Mariculture,Qingdao 266104,China; 2.Key Laboratory of Chemistry of Northwestern Plant Resources and Key Laboratory for Natural Medicine of Gansu Province,Lanzhou Institute of Chemical Physics, Chinese Academy of Sciences,Lanzhou 730000,China; 3.Center of Resource Chemical & New Material,Qingdao 266000,China)
Edwardsiella tarda has been recognized as one of the most serious aquatic animal pathogens.Real-time and accurate means of detection is the key for prevention and control of spread of Edwardsiella tarda.In this present work,a novel detection strategy is designed to realize rapid and specific determination of Edwardsiella tarda by labeling Edwardsiella tarda monoclonal antibody(Ab)with QDs.The results show that the fluorescence of these QDs-Ab bioconjugates is quenched by GO to produce a bacterium capture probe. And the optimal quenched concentration of Graphene oxide is 60 μg/L.When the bacterium capture probe is exposed to the targets of Edwardsiella tarda, orange color fluorescence is turned on by releasing the QDs-Ab due to the antibody antigen combination.The specificity of the FRET sensor towards Edwardsiella tarda is examined by comparing with controls such as Vibrio splendidus,Vibrio alginolyticus,Vibrio parahaemolyticus and Aeromonas hydrophila with the same condition.The control group can not cause obvious fluorescence alteration,while the experimental group results in significant fluorescence enhancement.Therefore,the sensor has good potential to expand its application to the early diagnosis determination of bacterium.
immuno-biosensor; Edwardsiella tarda(E.tarda); graphene oxide(GO); quantum dots(QDs); FRET
2016—06—12
山东省科技发展计划资助项目(2014GHY115024)
10.13873/J.1000—9787(2017)06—0038—04
TP 212.3
A
1000—9787(2017)06—0038—04
王淑娴(1982-),女,通讯作者,硕士,助理研究员,主要从事水产动物病害防治与检测工作,E—mail:wangsx_2008@yeah.net。

