大鼠非酒精性脂肪肝模型的建立
杨威,徐闯,陈媛媛,郑家三,张洪友,夏成
(黑龙江八一农垦大学动物科技学院,大庆 163319)
大鼠非酒精性脂肪肝模型的建立
杨威,徐闯,陈媛媛,郑家三,张洪友,夏成
(黑龙江八一农垦大学动物科技学院,大庆 163319)
利用不同高脂饲料配方建立大鼠非酒精性脂肪肝病(NAFLD)模型,为非酒精性脂肪肝的研究提供参考依据。大鼠饲喂单纯高脂饲料以及分别含有去氧胆酸、丙基硫氧嘧啶的高脂高胆固醇饲料,经6周的实验周期。结果显示,单纯饲喂高脂饲料大鼠(H6)呈现出显著的体重增加以及肝脏脂肪浸润。饲喂添加去氧胆酸盐的高脂饲料后大鼠肝脏胆固醇水平显著降低,但血液丙氨酸转氨酶(ALT)和丙氨酸转氨酶(AST)水平显著高于H6大鼠。丙基硫氧嘧啶介导甲状腺机能减退脂肪肝模型(HP6)组大鼠呈现前期体重生长缓慢后期的体重减轻且高的血清甘油三酯(TC)、低密度脂蛋白胆固醇(LDL-c)、ALT。四环素刺激下的甲状腺机能减退大鼠(HPT6)呈现严重肝脏病变以及低下肝脏脂肪蓄积和高水平的血清ALT。表明HP6大鼠存在进行性非酒精性脂肪肝的发生。而在四环素刺激下,甲状腺机能减退大鼠存在进行性肝纤维化以及肝脏疾病晚期的可能。为非酒精性脂肪肝研究提供了有力的基础数据。
高脂饮食;非酒精性脂肪肝;丙硫氧嘧啶;去氧胆酸盐;盐酸四环素
近年来,人类脂肪肝的发病呈不断上升趋势,对人类的健康和生活质量造成严重威胁。非酒精性脂肪肝病作为最常见的肝脏疾病之一,根据其严重程度不同可从简单的肝脏脂肪沉积到非酒精性脂肪肝炎,最后可发展为肝脏纤维以及肝硬化和肝细胞癌[1-2]。数据显示,大约10%~24%人群患有非酒精性脂肪肝,而20%~30%的非酒精性脂肪肝患者将发展成非酒精性脂肪性肝炎。非酒精性脂肪肝与肥胖、糖尿病、甲状腺功能减退、胰岛素抵抗有关,数据显示,80%的非酒精性脂肪肝是由肥胖引起[3,4]。目前一致认为高脂饮食与肥胖和胰岛素抵抗有关,但高脂饮食与脂肪肝发生相关性仍有争议,因此,研究拟建立高脂饮食的大鼠非酒精性脂肪肝模型,为非酒精性脂肪肝研究提供基础。
目前高脂饮食大鼠非酒精性脂肪肝模型研究较为广泛,且模型建立方法多样,但常用的方法仍为高脂诱导,且大部分研究同时添加了丙基硫氧嘧啶、胆盐等药物刺激,此外还有部分研究采用四环素建立脂肪肝动物模型[5-6]。丙基硫氧嘧啶比甲巯基咪唑致畸作用小,被认为更适合用于治疗甲状腺机能亢进的药物[7]。而研究表明丙基硫氧嘧啶能引起肝细胞损伤并增加慢性酒精摄入病人肝细胞需氧量,引起29.4%的病人因服用丙基硫氧嘧啶而的暴发性肝衰竭死亡[8]。四环素作为一种口服广谱抗生素药物被广泛用于细菌感染以及家畜的食品添加剂,但易引起食物残留[9-10]。此外四环素被认为可引发肝脏线粒体损伤而介导肝脏脂肪沉积[11]。因此,研究采用含有上述不同药物的高脂饲料建立大鼠非酒精性脂肪肝模型,通过对其效果评价,旨在为大鼠非酒精性脂肪肝的研究提供参考依据。
1 材料与方法
1.1 实验动物及分组
36只八周龄雄性Wistar大鼠随机分成6组:对照组(C6),6只,大鼠饲喂正常饲料;高脂饲喂组(H6),6只,大鼠饲喂高脂饲料;高脂去氧胆酸盐饲喂组(HD6),6只,大鼠饲喂含有0.2%去氧胆酸盐高脂饲料;盐酸四环素组(CT6),于实验前1天大鼠腹腔注射盐酸四环素(100 mg·kg-1体重),之后饲喂正常饲料;甲状腺减退高脂组(HP6),6只,大鼠饲喂含有0.1%丙基硫氧嘧啶的高脂饲料;盐酸四环素处理的甲状腺减退高脂组(HPT6),6只,于实验前1天大鼠腹腔注射盐酸四环素(100 mg·kg-1体重),之后饲喂含有0.1%丙基硫氧嘧啶的高脂饲料。各组大鼠的实验周期为6周。相关饲料配方如表1所示。

表1 实验所需饲料成分Table 1Detailed composition of the diets used in the experiments
1.2 样品采集
实验期间每周对大鼠进行体重测量。实验结束前,大鼠禁食10 h至14 h之后,断颈处死,后腔静脉采血,分离血清于-80℃保存。取出大鼠肝脏,生理盐水清洗后,肝脏组织固定于4%甲醛中用于伊红美蓝染色(HE)染色。
1.3 血清及肝脏生化分析
血清甘油三酸酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-c)、高密度脂蛋白胆固醇(HDL-c)、丙氨酸转氨酶(ALT)、天冬氨酸氨基转移酶(AST)利用自动生化分析仪(Beckman Coulter Synchron DXC800,Beckman Coulter.Inc.,USA)检测。肝脏TG、TC利用酶生化试剂盒检测(天根生化科技有限公司,北京)。
1.4 统计分析
使用SPSS19.0分析软件对各组间进行单因素方差分析,P<0.05认定为差异显著。所有数据结果用平均数±标准误的形式表示。
2 结果
2.1 实验期大鼠体重变化
试验选用的雄性Wistar大鼠初始体重180~200 g,随机分为6组。如图1所示,各组间大鼠初始体重无差异。实验第2周C6、CT6、H6和HD6大鼠体重明显高于丙基硫氧嘧啶饲喂组HP6和HPT6大鼠。实验第6周H6大鼠体重显著高于其他各组,而C6、CT6 和HD6大鼠体重差异不明显,而HP6和HPT6组大鼠体重显著低于其他组。
2.2 血清、肝脏部分生化指标分析
如表2所示,喂食高脂饲料6周后,H6组大鼠表现为典型的非酒精性脂肪肝,肝脏中TG和TC含量著高于C6大鼠,H6大鼠血液TG、TC、LDL-c、AST水平高于C6大鼠,但差异不显著。HDL-c被认为是血脂异常的主要标志,但H6大鼠血液HDL-c水平显著低于其他各组。饲喂含有去氧胆酸盐高脂饲料的HD6大鼠血液ALT和AST水平以及肝脏TG含量显著高于H6大鼠,但肝脏中TC显著低于H6大鼠。饲喂含有丙基硫氧嘧啶高脂饲料的HP6大鼠血清TC、HDL-c、LDL-c、ALT以及肝脏TG含量显著高于H6大鼠,但HP6大鼠肝脏TG含量低于H6大鼠,且两组间血清TG含量无显著差异。与C6相比,给予盐酸四环素刺激的CT6大鼠血清呈现了高水平HDL-c,但其他血液和肝脏指标与C6大鼠无显著差异。HPT6血液TG、TC、LDL-c及肝脏TG含量显著低于HP6大鼠,但血液ALT高于HP6大鼠,表明HPT6大鼠存在严重的肝损伤。
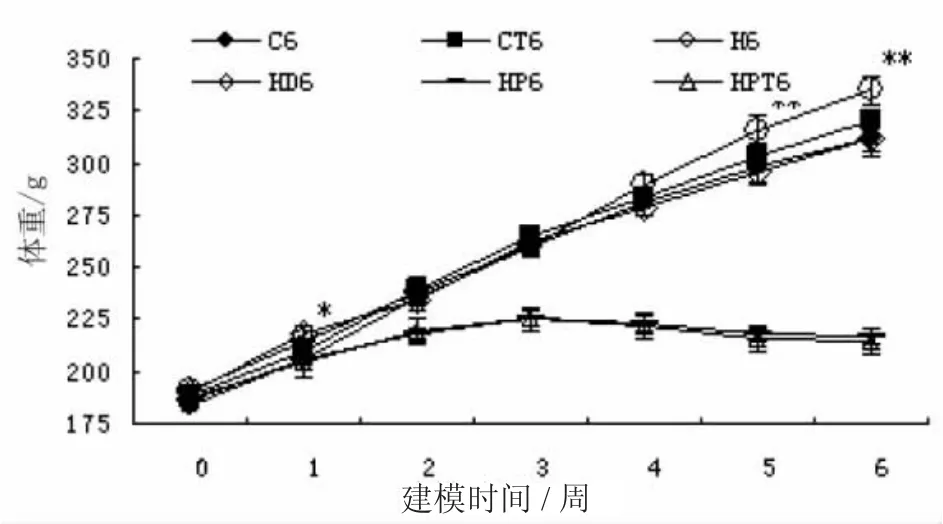
图1 各实验组大鼠体重变化Fig.1Body weight measurements of the rats in each group weekly

表2 血清和肝脏生化指标分析Table 2Analysis of biochemical parameters in the serum and liver
2.3 肝脏病理HE染色观察
大鼠肝脏经HE染色,结果如图2所示,C6大鼠肝脏结构纹理正常,CT6大鼠肝细胞呈现微粒性脂肪滴,细胞间隙充满红细胞。高脂饲喂的H6、HD6、 HP6、HPT6大鼠肝脏细胞存在不同程度的小泡或大炮性脂肪变性。此外HPT6大鼠肝脏呈现不同程度的纤维化以及囊肿的形成。
3 讨论

图2 肝脏组织病理学分析Fig.2Representative liver histopathology
非酒精性脂肪肝是人类最常见的肝脏疾病之一,大约10%~24%的人患有非酒精性脂肪肝,而其中80%的非酒精性脂肪肝患者是肥胖的。一项针对发达国家非酒精性脂肪肝疾病研究显示,习惯性高脂饮食与脂肪肝发病率的关系极为密切。研究通过给大鼠饲喂含10%猪油及1%胆固醇的高脂饲料建立非酒精性脂肪肝大鼠模型。与对照组大鼠相比,H6大鼠在第6周显示典型的非酒精性脂肪肝,包括体增重增加和明显的肝细胞脂肪浸润。H6大鼠肝脏中高水平的TC则与高浓度的胆固醇摄入以及胆固醇排泄受阻有关。胆汁是胆固醇的主要代谢途径,禁食大约12小时可能导致大鼠(无胆囊动物)肝脏高浓度的TC。然而,肝脏中TG、TC水平升高会促进氧化应激并导致脂肪肝[12]。血清HDL-c是机体清除细胞及血管胆固醇的主要工具,可以有效的预防冠心病和动脉粥样硬化性疾病的发生,而本实验中H6大鼠低水平的血清HDL-c可能成为增加动脉粥样硬化的危险因素[13]。
去氧胆酸作为利胆药已被广泛用于预防和溶解胆结石[14],它能通过降低肠道胆固醇的吸收降低乳糜微粒胆固醇含量方式调节胆固醇水平[15]。与H6相比,HD6组大鼠肝脏胆固醇含量低下,可能是由于去氧胆酸降低的了肠道的胆固醇吸收所致。此外去氧胆酸也能通过加快肝脏胆固醇经胆汁排出从而降低了肝脏胆固醇水平[16]。研究指出去氧胆酸能够促进胰岛素抗药性,而胰岛素抵抗能够促进肝脏游离脂肪酸转化为甘油三酯,从而导致HD6大鼠肝脏TG升高[17]。HD6血液高HDL-c的水平也反应了去氧胆酸有效的改善了胆固醇代谢。ALT和AST作为肝损伤指标,两者的不同之处在于ALT主要在肝脏中产生,而AST除见于肝脏也见于心脏,骨骼、肾脑、和红细胞中。因此HD6大鼠血清高浓度的AST表明去氧胆酸引起高脂饮食下大鼠全身性反应,而近期多项临床研究指出去氧胆酸能够引起血液AST含量升高,但其机制仍未被阐明[18]。
丙基硫氧嘧啶作为减少甲状腺释放的药物常用于治疗甲状腺机能亢进症[19],但因其可引发严重的肝损伤,包括肝功能衰竭和死亡,丙基硫氧嘧啶不再被推荐作为孕妇和儿童甲亢的首选治疗药物。但丙基硫氧嘧啶已被广泛用于诱导甲状腺功能减退实验动物模型。甲状腺激素通过促进肝脏羟甲基戊二酰辅酶A合成来增加肝脏胆固醇合成,但其主要作用还是促进肝脏胆固醇经胆汁排出。因此,甲状腺功能减退的患者血清中会呈现高的胆固醇水平[20],而研究HP6组大鼠血清中的TC和LDL-c含量显著高于H6大鼠。虽然高浓度的ALT与非酒精性脂肪性肝炎、进行性纤维化无特异性相关性。但高水平ALT仍被作为非酒精性脂肪性肝炎和其他慢性肝病的诊断指标[21]。研究中HP6大鼠高水平的血清ALT也预示着严重肝脏损伤的存在。而HP6大鼠肝脏低下的TG是否与严重肝脏损伤有关仍需进一步验证。
研究利用盐酸四环素建立大鼠肝脏损伤模型,结果显示CT6肝脏和血液生化指标与健康组差异不显著,但HPT6大鼠血液TG、TC、LDL-c及肝脏TG含量显著低于HP6大鼠,且血液ALT高于HP6大鼠,此外HPT6大鼠严重的肝脏病理变化,包括囊肿和纤维化等,都预示了HPT大鼠进行性肝硬化的可能[22]。
4 结论
单纯饲喂高脂饲料大鼠(H6)6周可建立大鼠脂肪肝模型。去氧胆酸盐能有效降低高脂饲料导致大鼠肝脏胆固醇水平,但HD6大鼠呈现严重的肝功损伤。利用丙基硫氧嘧啶介导甲状腺机能减退脂肪肝模型,HP6大鼠前期体重生长缓慢后期的体重减轻且高的血清甘油三酯(TC)、低密度脂蛋白胆固醇(LDL-c)、ALT,则预示HP6大鼠进行性非酒精性脂肪肝的发生。而在四环素刺激下,HPT6大鼠呈现严重肝脏病变以及低下肝脏脂肪蓄积和高水平的血清ALT,预示进行性肝纤维化以及肝脏疾病晚期的可能。
[1]Nobili V,Svegliati-Baroni G,Alisi A,et al.A 360-degree overview of paediatric NAFLD:recent insights[J].J Hepatol,2013,58:1218-1229.
[2]Fujita K,Nozaki Y,Wada K,et al.Dysfunctional Very-Low-Density Lipoprotein Synthesis and Release Is a Key Factor in Nonalcoholic Steatohepatitis Pathogenesis[J]. Hepatology,2009,50:772-780.
[3]Musso G,Gambino R,De Michieli F,et al.Dietary habits and their relations to insulin resistance and postprandial lipemiainnonalcoholicsteatohepatitis[J].Hepatology,2003,37:909-916.
[4]Marchesini G,Bugianesi E,Forlani G,et al.Nonalcoholic fatty liver,steatohepatitis,and the metabolic syndrome[J]. Hepatology,2003,37:917-923.
[5]杨英昕,毕秀丽,朱培庭.非酒精性脂肪肝动物模型研究纂要[J].中医药学刊,2005,23(4):647-651.
[6]于鑫,张琦,陈媛媛,等.高脂饮食构建大鼠脂肪肝模型的研究现状及分析[J].黑龙江八一农垦大学学报,2016,28 (1):25-27.
[7]Hackmon R,Blichowski M,Koren G,et al.The safety of methimazole and propylthiouracil in pregnancy:a systematic review[J].J Obstet Gynaecol Ca,2012,34:1077-1086.
[8]Aydemir S,Ustundag Y,Bayraktaroglu T,et al.Fulminant hepatic failure associated with propylthiouracil:A case report with treatment emphasis on the use of plasmapheresis [J].J Clin Apheresis,2005,20:235-238.
[9]Lee B H,Kim N.Quadruple or triple therapy to eradicate H pylori[J].Lancet,2012,377:877-878.
[10]Tan H L,Ma C J,Song Y H,et al.Determination of tetracycline in milk by using nucleotide/lanthanide coordination polymer-based ternary complex[J].Biosens Bioelectron,2013,50:447-452.
[11]Yu H Y,Wang B L,Zhao J,et al.Protective effect of bicyclol on tetracycline-induced fatty liver in mice[J].Toxicology,2009,261:112-118.
[12]Matsuzawa N,Takamura T,Kurita S,et al.Lipid-induced oxidative stress causes steatohepatitis in mice fed an atherogenic diet[J].Hepatology,2007,46:1392-1403.
[13]Lee S,Joo H,Kim C T,et al.High hydrostatic pressure extract of garlic increases the HDL cholesterol level via upregulation of apolipoprotein A-I gene expression in rats fed a high-fat diet[J].Lipids Health Dis,2012,11:77.
[14]王莹,刘馨宇,王沙沙,等.黄芪粗提物对小鼠急性酒精性肝损伤的保护作用[J].延边大学农学学报,2016(2):105-108.
[15]Ros E.Intestinal absorption of triglyceride and cholesterol. Dietary and pharmacological inhibition to reduce cardiovascular risk[J].Atherosclerosis,2000,151:357-379.
[16]Rubin R A,Kowalski T E,Khandelwal M,et al.Ursodiol for hepatobiliary disorders[J].Ann Intern Med,1994,121:207-218.
[17]Jung J H,Kim H S.The inhibitory effect of black soybean on hepatic cholesterol accumulation in high cholesterol and high fat diet-induced non-alcoholic fatty liver disease[J].Food Chem Toxicol,2013,60:404-412.
[18]Nishida C,Uto H,Oketani M,et al.Clinical significance of alanine aminotransferase levels and the effect of ursodeoxycholic acid in hemodialysis patients with chronic hepatitis C[J].J Gastroenterol,2010,45:326-334.
[19]Nakamura H,Noh J Y,Itoh K,et al.Comparison of methimazole and propylthiouracil in patients with hyperthyroidism caused by Graves'disease[J].J Clin Endocr Metab,2007,92:2157-2162.
[20]Ness G C,Pendleton L C,Li Y C,et al.Effect of thyroid hormone on hepatic cholesterol 7 alpha hydroxylase,LDL receptor,HMG-CoAreductase,farnesylpyrophosphate synthetase and apolipoprotein A-I mRNA levels in hypophysectomizedrats[J].BiochemBiophResCo,1990,172:1150-1156.
[21]Verma S,Jensen D,Hart J,et al.Predictive value of ALT levels for non-alcoholic steatohepatitis(NASH)and advanced fibrosis in non-alcoholic fatty liver disease (NAFLD)[J].Liver International,2013,33:1398-1405.
[22]Brunt E M.Pathology of nonalcoholic fatty liver disease [J].Nat Rev Gastroenterol Hepatol,2010(7):195-203.
Establishment of Nonalcoholic Fatty Liver Disease Model in Rats
Yang Wei,Xu Chuang,Chen Yuanyuan,Zheng Jiasan,Zhang Hongyou,Xia Cheng
(College of Animal Science and Technology,Heilongjiang Bayi Agriculture University,Daqing 163319)
To study nonalcoholic fatty liver disease(NAFLD),wistar rats were fed with different high-fat diets to develop NAFLD.In this study,wistar rats were fed with high-fat diets(with or without deoxycholic acid or propylthiouracil)for 6 weeks.Our results showed that rats fed a high-fat diet(H6)gained a significant amount of weight and severe steatosis.Compared with H6 rats,rats which fed with high-fat diets with deoxycholic acid showed decreased liver cholesterol and significant higher serum alaninetransaminase (ALT)and aspartate aminotransferase(AST).The hypothyroid rats induced by propylthiouracil had a fleshless body,significantly higher concentrations of total cholesterol(TC),low-density lipoprotein cholesterol(LDL-c)and ALT concentrations in serum. Hypothyroid rats that had a previous prepared with tetracycline demonstrated severe pathological changes in the liver,lower liver triglyceride accumulation and high serum ALT concentrations.The results suggested that propylthiouracil-induced hypothyroidism played an important role in progressive NAFLD,Hypothyroid rats that had a previous prepared with tetracycline could develop an end-stage liver disease.This find was important for NAFLD research.
high-fat diet;nonalcoholic fatty liver disease;propylthiouracil;deoxycholic acid;tetracycline
S856.4
A
1002-2090(2017)03-0015-05
10.3969/j.issn.1002-2090.2017.03.004
2016-04-01
国家自然科学基金青年项目(31502133);国家科技支撑计划(2012BAD12B03-2和2013BAD21B01)。
杨威(1985-),男,讲师,吉林大学毕业,现主要从事动物营养代谢病方面的研究工作。
夏成,男,教授,博士研究生导师,E-mail:xcwlxyf2014@163.com。

