四环素对氨氧化细菌的毒理效应研究
欧阳帆,彭丹,钟润生,王菲,陈汇威
(1.深圳信息职业技术学院交通与环境学院,广东 深圳 518172;2.筑博设计(集团)股份有限公司设备所,广东 深圳 518042)
四环素对氨氧化细菌的毒理效应研究
欧阳帆1,彭丹1,钟润生1,王菲2,陈汇威1
(1.深圳信息职业技术学院交通与环境学院,广东 深圳 518172;2.筑博设计(集团)股份有限公司设备所,广东 深圳 518042)
四环素在废水处理厂中被频繁检出,并影响废水的生物脱氮过程。本文开展了不同浓度四环素(0,0.1,3.2,10,32,64,100 mg/L)对废水中氨氧化细菌(AOB)的毒性冲击试验。从基质代谢、呼吸速率、氨氧化功能基因(amoA,hao)转录三个角度,探讨了四环素对AOB的毒性效应。研究结果表明:四环素浓度与NH4+-N降解抑制率之间呈正比例关系。AMO的活性随四环素浓度的增加表现出先增加后减小的趋势,而HAO的活性,随四环素浓度的增加逐渐减小。功能基因对四环素的毒性最敏感,且hao对四环素的敏感性要强于amoA。
四环素;AOB;sOUR;基因转录
四环素是一种广谱抗生素,具有较强的杀菌作用,自20世纪60年代以来,作为疾病治疗药物和动物促生长剂,在家禽及畜牧养殖业中被广泛应用。由于四环素难以被动物消化系统所吸收,69%~86%的四环素被排泄到动物体外[1]。目前,四环素在废水处理厂中被频繁检出,并影响废水的生物脱氮过程[2]。
氨氧化细菌(AOB)是废水处理厂脱氮过程中的重要功能细菌。废水中的氨氮(NH4+-N)在AOB的作用下逐步转化为亚硝酸盐氮(NO2--N)。其中,AOB中的氨单加氧酶(AMO)将NH4+-N氧化成为羟氨(NH2OH),羟氨氧化酶(HAO)进一步将NH2OH氧化成为NO2--N。由于AOB对环境条件(pH值,温度,溶解氧等)非常敏感[3-5],因此,废水中四环素对AOB的毒性影响值得关注。近年来,由于分子生物学技术的发展,关于污染物质对微生物毒性机理的研究可以深入到基因水平。目前,研究者们已经发现,编码AMO及HAO酶的主要功能基因是amoA和hao[6,7],并且发现,某些重金属和有机物都会影响amoA基因的转录和表达[8,9]。然而,目前关于四环素对AOB毒性机理的研究较少,而深入到基因水平的研究更是鲜有报道。
本文开展了四环素对废水中AOB的毒理效应研究,重点探讨了四环素对AOB生理代谢指标(如底物利用率,呼吸速率等)以及主要氨氧化功能基因转录的毒性影响效应,为解决四环素引起的废水处理厂生物脱氮不稳定提供理论支持。
1 实验材料及方法
1.1 AOB的富集
本试验接种污泥来自于深圳某市政污水处理厂的好氧池。该厂所用工艺为A2/O。接种污泥取回后,过筛(2 mm)以去除较粗杂质并在序批式反应器(SBR)中进行驯化培养。反应器为圆柱形有机玻璃容器,见图1,有效容积为5L,总高度0.85 m,进水口及排泥口位于反应器底部,出水口设置于反应器有效容积1/2处。进出水、曝气等操作通过时间和液位继电器进行联合控制,实现SBR反应器的自动化控制。反应器的外壁设置循环水浴层与恒温水浴锅相连,使反应器温度保持30±1℃;反应器内部底座设置曝气头与曝气泵相连,在反应阶段保证反应器内DO≤1mg/L。反应器每个周期为6h(进水15min,曝气240min,静沉95min,排水10 min),水力停留时间为12h。当出水NH4-N和NO-+2-N 浓度小于0.1 mg/L,NO3--N浓度300±30 mg/L时,将活性污泥从SBR反应器中取出,进行批式试验。
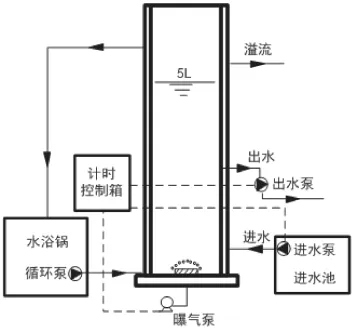
图1 SBR装置示意图Fig.1 Schematic diagram of the SBR device
试验废水为模拟废水,采用人工配制的方法。废水中不含有机物,以(NH4)2SO4为氮源,保证进水NH4+-N浓度为300 mg/L。NaHCO3作为无机碳源,配置浓度为410mg/L。采用K2HPO4-KH2PO4缓冲对控制配水pH值为8.0左右。配水中含微量元素,配方见表1。

表1 试验模拟废水微量元素配置表Tab. 1 Micronutrients of synthetic domestic waste water
1.2 批式试验
试验分别在相同的7组锥形瓶中进行。锥形瓶总容积为2L,有效容积为1.5L,其中包含0.6 L经SBR驯化后的污泥和0.9 L模拟废水。每组锥形瓶中,NH4
+-N初始浓度为300mg/L,MLSS浓度为1500mg/L,pH值为7.97-8.03。分别向7组锥形瓶中投加四环素储备液,各锥形瓶中四环素浓度分别达到:0,0.1,3.2,10,32,64及100mg/L。锥形瓶外层设有循环水浴层与恒温水浴锅相连,使锥形瓶内温度保持30±1℃。锥形瓶底部放置曝气头与曝气泵相连,在反应阶段保证烧杯内DO≤1mg/L。锥形瓶口塞医用棉,防止四环素挥发。从四环素投加时开始计时,分别在0.5、1.5、4.0、5.0、10.0和25.0h时,从7组烧杯中各取出30 mL活性污泥溶液,用于测定NH4+-N,NO2--N,NO3--N的浓度。各锥形瓶中AOB的比呼吸速率(sOUR)在反应第10 h进行测定。
1.3 AOB比呼吸速率的测定
参照Surmacz-Gorska等[10]的方法,测定活性污泥中的NH4+-N比呼吸速率(sOURNH3)来表征AOB的AMO酶活性,具体步骤参考文献[10]。以NH2OH为底物,测定活性污泥中的NH2OH比呼吸速率(sOURNH2OH)来表征AOB的HAO酶活性,具体步骤参考文献[7]。R
1.4 amoA、hao基因表达量的测定
(1)RNA的提取及cDNA的制备
选用FastRNA○SPIN Kit for Soil(Q-Biogene,CA,USA)RNA提取试剂盒提取污泥样品RNA。提取步骤参照RNA提取试剂盒说明书,提取好的RNA样品立刻进行反转录,制备成cDNA。cDNA的合成选用GoScriTM逆转录试剂盒(A5000,Promega,USA)。转录步骤参考试剂盒说明书。反应条件为:25℃恒温退火5min,42℃恒温延伸1 h。1小时后结束反应并分析cDNA的含量,富余cDNA于0~5℃长期保存。
(2)PCR扩增
以cDNA为模板,利用Authorized Thermal cycler PCR扩增仪(Eppendorf 5331,Hamburg,Germany)进行cDNA的PCR体外扩增反应。PCR体系中包括:cDNA模板10-100 ng、上游引物和下游引物各1.5 μmol/L、2 μL 250 μmol/L脱氧核糖核苷三磷酸(dNTP)、1.25 UTapDNA聚合酶(Takara,Dalian,Chian)、2.5 μL 10×loadig buffer,并用无菌超纯水补足至25 μL。PCR引物及扩增引物如表2所示。PCR程序为:94℃变性5min;随后40个循环,每个循环包含94℃变性30s,退火30s,退火温度列于表2,72℃延伸1 min;40个循环结束后,72℃延伸10 min。

表2 实验所用引物Tab. 2 Primers used in this study
(3)分子克隆
采用DNA纯化试剂盒(DNA Fra gment Purification Kit,Takara,Japan)对PCR产物进行纯化。选用pGEM-T Easy质粒载体(Promega,USA),E.coli JM109感受态细胞进行分子克隆。具体步骤参考pGEMR-T Easy Vector Systems Protocol。
(4)定量PCR(qPCR)
以cDNA为模板,采用Bio-Rad iQ5定量PCR仪(Bio-Rad Company,CA,USA)进行PCR试验。PCR反应体系为25 μL,包含基因模板10-100 ng、上游引物和下游引物各1.5 μmol/L、12.5 μL SYBR Green I mixer,超纯水补齐至25μL。qPCR运行条件与2)相同。在PCR反应结束后,绘制溶解曲线,以判断PCR试验的运行效果。曲线温度范围为65℃至95℃,每隔30s增加0.5℃,并读取一次荧光值。
标准曲线的绘制在Bio-Rad iQ5定量PCR仪(Bio-Rad Company,CA,USA)上进行。选取携带目的片段的质粒制作标准曲线。制作过程如下:采用Q5000微量紫外分光光度计(Qwell,USA)测量质粒浓度,根据质粒浓度和目的片段长度计算质粒拷贝数,计算方法详见文献[13];将含有目的片段的质粒浓度10倍逐级稀释,共稀释8个梯度,每个浓度设置3个平行;以稀释后的质粒作为模板,进行PCR试验,试验条件与(2)相同,从而得到目标基因的标准曲线,所有曲线的R2值均高于0.996。根据每个目标基因的标准曲线,以及样品中目标基因的Ct值,计算出样品中目标基因的拷贝数。
1.5 其他实验参数的测定
NH+-N浓度采用纳氏试剂分光光度法,NO-42-N采用N-(1-萘基)-乙二胺光度法,NO3--N采用紫外分光光度法,MLVSS采用重量法,具体操作步骤参考文献[14]。
2 实验结果的分析与讨论
2.1 四环素对AOB氨氧化速率的影响
如图2(a)所示,AOB对氨氮的去除率,随着四环素浓度的增加逐渐降低。当四环素浓度达到100mg/L时,AOB对氨氮的去除率达到最低值,仅为36.3%。而对于各浓度四环素,氨氮降解速率随时间的增加均呈现出逐渐减小的趋势,并在第10h达到最小值。绘制NH4+-N降解抑制率与四环素浓度的关系曲线(图2(b)),发现两者呈直线正相关关系(R2=0.8749)。
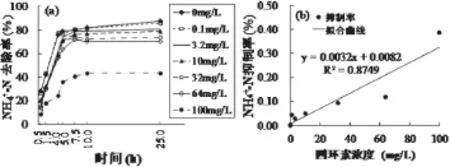
图2 (a)四环素对AOB氨氧化速率的影响;(b)NH4+-N降解抑制率与四环素浓度的关系Fig.2 (a) Influence of tetracycline on ammonia oxidizing rate of the AOB; (b) Correlation between the NH4+-Nconsume rate and
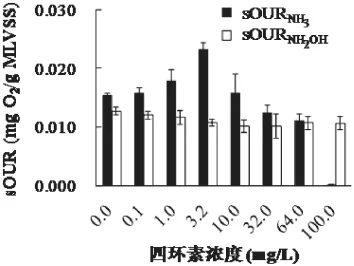
图3 四环素对AOB氨氧化呼吸速率及羟氨氧化呼吸速率的影响Fig.3 Influences of tetracycline on sOURNH3and sOURNH2OHtetracycline concentration
2.2 四环素对AOB呼吸速率的影响
如图3所示,低浓度的四环素(≤3.2 mg/L)能够促进AOB的氨氧化呼吸速率,且随四环素浓度的增加,sOURNH3的值较空白组(0mg/L)逐渐增加;高浓度的四环素(≥10.0mg/L),能够抑制AOB的氨氧化呼吸速率,随四环素浓度的增加,sOURNH3的值较空白组逐渐减小。AOB的羟氨氧化呼吸速率随四环素浓度逐渐降低,当四环素浓度为32.0 mg/L时,sOURNH2OH达到最小值,说明此时四环素对HAO酶活性的抑制率达到最大值,且随着四环素浓度的增加(64,100mg/L),sOURNH2OH保持稳定值。
2.3 四环素对amoA、hao基因表达量的影响
图4为amoA、hao基因相对于16S rRNA基因的相对表达量。其中,amoA基因的相对表达量在四环素暴露环境下发生显著的改变。当四环素浓度为0.1-10 mg/L时,amoA基因的相对表达量降低至0.01。然而,当四环素浓度为32-64mg/L时,amoA基因的相对表达量较四环素浓度为0.1-10 mg/L时有所上升。当四环素浓度为100 mg/L时,amoA基因的相对表达量接近0mg/L,说明此时amoA基因转录水平受到严重抑制。hao基因相对表达量随四环素浓度的变化,表现出与amoA相似的规律,并且hao基因的相对表达量相比于amoA基因,要低一个数量级,这说明hao基因对四环素的毒性敏感性要强于amoA基因。值得注意的是,amoA、hao基因的相对表达量均在四环素浓度为32 mg/L时达到最大值分别为0.15±0.07和0.033±0.007。
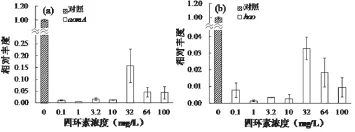
图4 四环素对amoA(a)、hao(b)基因表达量的影响Fig.4 Influences of tetracycline on the gene expressions of amoA (a) and hao (b)
3 结论
本论文研究了不同浓度四环素(0,0.1,3.2,10,32,64,100 mg/L)对废水中AOB的毒理效应。从底物降解、比呼吸速率、功能基因表达量等三个角度,探讨四环素对AOB的毒性效应。研究结果表明,四环素浓度与AOB的NH4+-N降解抑制率呈正相关性;四环素在低浓度(≤3.2mg/L)时能够促进AOB的AMO酶的活性,高浓度时(≥10.0mg/ L)能够抑制AMO酶的活性;HAO酶的活性随四环素浓度的增加逐渐减小,在四环素浓度≥32mg/L时达到最低值。amoA、hao基因的转录受四环素毒性影响表现出相同的规律,且hao基因对四环素的敏感性要强于amoA基因。
[1] 池振兴.四环类污染物毒性的微观机制研究[D].济南:山东大学, 2012. CHI Zhenxing. Investigation on the micromechanism of the toxicity of tetracyclines [D]. Jinan: Shandong University, 2012.(in Chinese)
[2] Maria M, Maria A, Pereira P, et al. Influence of tetracycline on the microbial community composition and activity of nitrifying biofilms [J]. Chemosphere, 2014, 117: 295-302.
[3] Shammas N K. Interactions of temperature, pH, and biomass on the nitrification process [J]. Journal (Water Pollution Control Federation), 1986, 52-59.
[4] Peng Y, Gao J, Wang S, et al. Use of pH as fuzzy control parameter for nitrification under different alkalinity in SBR process [J]. Water science and technology, 2003, 47(11):77-84.
[5] Kim D J, Lee D I, Keller J. Effect of tem perature and free ammonia on nitrification and nitrite accumulation in landfill leachate and analysis of its nitrifying bacterial community by FISH [J]. Bioresource Technology, 2006, 97: 459-468.
[6] Klotz M G, Stein L Y. Nitrifier genomics and evolution of the nitrogen cycle [J]. FEMS microbiology letters, 2008, 278(2): 146-156.
[7] Radniecki T, Ely R. Tra nscriptional and physiological responses of Nitrosococcus mobilis to copper exposure [J]. Journal of Environmental Engineering, 2010, 137: 307-314.
[8] Ouyang F, Zh ai H, Ji M, et al. Physiological and transcriptional responses of nitrifying bacteria exposed to copper in activated sludge [J]. Journal of Hazardous Materials, 2016, 301: 172-178.
[9] Fukushima T, Whang L M, Lee Y C, et al. Transcriptional responses of bacterial am oA gene to dim ethyl sulfide inhibition in complex microbial communities [J]. Bioresource Technology, 2014, 165: 137-144.
[10] Surmacz-Gorska J, Gernaey K, Demuynck C, et al. Nitrification monitoring in activated sludge by oxygen uptake rate (OUR) m easurements [J]. Water Research, 1996, 30(5): 1228-1236.
[11] Rotthauwe J H, Wi tzel K P, Li esack W. The ammonia monooxygenase structural gene amoA as a functional marker: molecular fine-scale analysis of natural ammonia-oxidizing populations [J]. Applied and Environmental Microbiology, 1997, 63(12): 4704-4712.
[12] Suzuki M T, Taylor L T, DeLong E F. Quantitative analysis of small-subunit rRNA genes in mixed microbial populations via 5'-nucleas e assays [J]. Applied and Environmental Microbiology, 2000, 66(11): 4605-4614.
[13] Zhang T, Zhang M, Zhang X, et al. Tetracycline resistance genes and tetracycline res istant lactose-fermenting Enterobacteriaceae in activated sludge of sewage treatment plants [J]. Environmental Science & Technology, 2009, 43(10): 3455-3460.
[14] 国家环境保护局. 水和废水监测分析方法[M]. 北京:中国环境科学出版社,2003. National Environmental Protection Bureau. Water and wastewater monitoring and analysis methods [M]. Beijing: China Environmental Science Press, 2003. (in Chinese)
Study on the responses of ammonia oxidizing bacteria to tetracycline toxicity
OUYANG Fan1, PENG Dan1, ZHONG Runsheng1, WANG Fei2, CHEN Huiwei1
(1. School of Traffic and Environment, Shenzhen Institute of Information Technology, Shenzhen 518172 , P.R.China; 2.Equipment Department, Zhubo Design Group Co. LTD, Shenzhen 518000, P.R. China)
Tetracycline was detected in the wastewater treatment plant frequently, and inhibited the nitrogen bio removal process. The effects of different concentrations of tetracycline (0, 0.1, 3.2, 10, 32, 64, 100 mg/L) on ammonia oxidizing bacteria (AOB) in wastewater were investigated in this paper. The toxic effects of tetracycline on AOB were studied from three aspects incl uding matrix metabolism, respiratory rat e and ammonia oxidi zing functional genes (amoA, hao) transcription. It was suggested that the concentration of tetracycline was positively correlated with the inhibition ratio of NH4+-N consume rate. The activity of AMO showed a trend of first increase and then decrease with the increase of tetracycline concentration, while the activity of H AO gradually decreased with the incr ease of the tetracycline concentration. The functional genes were most sensitive to tetracycline toxicity, and the sensitivity of hao to tetracycline was stronger than that of amoA.
Tetracycline; AOB; sOUR; Gene transcription
X13
:A
1672-6332(2017)01-0038-05
【责任编辑:杨立衡】
2017-03-10
广东省高等职业教育品牌专业建设项目(项目编号: 2016GZPP127);广东省一流高职院校建设计划
欧阳帆(1984-),女(汉),湖南汝城县人,博士,助教,主要研究方向:环境分子生物学、废水生物处理。E-mail:ouyangfanily@163.com

