青海省汉族PIH患者血浆EPO水平及EPO基因3′端低氧增强子区T3541G单核苷酸多态性观察
李红荣,张耀刚,吕彩霞,王香林,庄文婷,李建华
(1青海大学医学院基础医学部,西宁810016;2青海大学医学院基础医学部解剖学教研室;3甘肃武威肿瘤医院)
青海省汉族PIH患者血浆EPO水平及EPO基因3′端低氧增强子区T3541G单核苷酸多态性观察
李红荣1,张耀刚1,吕彩霞3,王香林1,庄文婷1,李建华2
(1青海大学医学院基础医学部,西宁810016;2青海大学医学院基础医学部解剖学教研室;3甘肃武威肿瘤医院)
目的 观察青海省汉族妊娠高血压(PIH)患者促红细胞生成素(EPO)基因3′端低氧增强子上T3541G单核苷酸多态性。方法 124例PIH患者为观察组,112例正常孕妇为对照组。抽取两组外周静脉血,采用ELISA法检测两组血浆EPO。采用限制性片段长度多态性聚合酶链反应方法对两组EPO SNP/T3541G进行基因型分型并测序验证。结果 观察组和对照组血浆EPO水平分别为(454.113±35.097)、(396.316±50.262)pg/mL,二者比较,P<0.05。观察组 EPO T3541位点基因型频率野生型(TT)、杂合子型(TG)和突变纯合子型(GG)分别为9.7%、74.2%、16.1%、对照组分别为42.9%、46.4%、10.7%,两组比较,P均<0.05。观察组EPO T3541位点等位基因频率T、G分别为46.8.%、53.2%,对照组分别为66.1%、33.9%,两组比较,P均<0.05)。EPO 基因SNP/T3541G多态性与PIH呈正相关(OR为0.451,95%CI:0.311~0.655),T等位基因为PIH的保护基因(OR为0.708,95%CI:0.602~0.833),G等位基因为PIH的危险因素(OR为1.569,95%CI:1.263~1.949)。结论 青海省汉族PIH患者血浆EPO水平高于健康孕妇。EPO基因SNP/T3541G多态性与PIH有关。
妊娠并发症;妊娠高血压;子癫前期;促红细胞生成素基因;单核苷酸基因多态性
妊娠高血压(PIH)是产科的常见疾病,是导致孕产妇及围产儿死亡的重要原因,国外报道发病率7%~12%、我国为9.4%、我国高原地区为24.6%、青海省为15%[1~3]。目前研究认为PIH的发病与遗传、母胎免疫失衡、胎盘滋养细胞缺血、氧化应激有关[4],但其具体发病机制目前尚不明确。有研究[2]发现,PIH患者体内存在缺血缺氧的病理损害。促红细胞生成素(EPO)可作用于骨髓造血系统,促进红细胞的增殖分化,人体中主要由肾脏产生。近年研究发现其作为新的促血管生成因子,具有促进血管生成、抵抗细胞凋亡、抗缺氧等多种生物学功能。缺氧环境下,缺氧诱导因子(HIF)可调控EPO基因大量表达[5]。EPO基因3′端低氧增强子区域存在一个SNP位点(T3541G),其多态性与EPO表达有关。在妊娠期母体血清、蜕膜、绒毛、胎肝、胚胎脑组织中EPO呈高表达[6]。目前关于EPO基因 SNP/T3541G多态性和PIH的相关性方面的报道较少。青海省大部分地区属于高原,空气中氧分压低,而妊娠使孕妇对氧的需求量增加,相对于平原地区,高原孕产妇表现为胎盘灌注不足,胎盘缺血缺氧。在缺氧环境中,机体通过上调EPO来提高机体携氧能力,改善组织缺血缺氧。本研究观察了青海省汉族PIH患者血浆EPO水平变化及EPO基因 SNP/T3541G的多态性。现报告如下。
1 资料与方法
1.1 临床资料 选择2015年10月~2016年1月间西宁市各大医院(青海省人民医院、青海大学附属医院、西宁市第二人民医院等)收治的PIH患者124例,年龄23~35(28.6±5.8)岁,红细胞数(4.06±0.46)×1012/L ,血红蛋白(121.31±14.24)g/L,均来自青海省汉族世居人群,符合 1996 年美国妇产科医师学会(ACOG)提出的PIH分类方法与诊断标准[2],排除妊娠前患有高血压、糖尿病、肾病等慢性病。另随机选取产前体检正常的孕妇112例为对照组,年龄21~32(26.4±2.2)岁,红细胞数(4.12±0.35)×1012/L ,血红蛋白(123.71±12.85)g/L;均来自青海省汉族世居人群。两组性别、年龄、红细胞数、血红蛋白等资料具有可比性。
1.2 血浆EPO检测 抽取两组外周静脉血2 mL,采用ELISA法检测两组血浆EPO。所有操作步骤均严格按照使用说明书进行。重复3次,取平均值。本研究经本院伦理委员会批准同意,所有患者知情同意并签署知情同意书。
1.3 EPO 基因SNP/T3541G多态性观察 用EDTA管采集两组患者外周静脉血2 mL,使用基因组DNA提取试剂盒(天根生化科技有限公司生产)提取全血基因组DNA。参考文献[7]合成EPO基因 SNP/T3541G位点引物(上游引物5′-ACTCTTGGCTTTTCTGTTTTCTGGG -3′和下游引物5′-TACT-GCGGTGAGGCCTTGAATGTAG-3′)。EPO SNP/T3541G多态性检测采用限制性片段长度多态性聚合酶链反应(PCR-RFLP)法,所用内切酶为AccI(New England Biolabs,Beverly,MA)。PCR总反应体积20μL:2×Taq PCR Master Mix10μL(天根生化科技有限公司生产), ddH2O 6 μL,上下游引物各1 μL,模板DNA 2 μL,PCR反应条件:95 ℃预变性5 min后进入循环,95 ℃、30 s,58 ℃、40 s,72 ℃、45 s,共32个循环,72 ℃延伸10 min 。PCR 产物为226 bp。取PCR 产物8 μL用AccI 内切酶 1μL,10×Tag Buffer 5 μL,ddH2O 6 μL,总体积20 μL,离心混匀后经37 ℃水浴锅消化5 h,酶切产物经 4%琼脂糖凝胶电泳,PCR产物被AccI 切为小片断(201 bp 和 25 bp),基因型为TT型,如果发生突变,AccI将不能切断 PCR 产物。酶切产物为一个条带(226 bp),基因型为GG型。酶切产物为三条带(226、201和25 bp)基因型为TG型。AccI的识别位点为5′…GT▼MKAC…3′,3′…CAKM▼TG…5′。K为G或T,M为A或C。将对照组和观察组基因型为TT、TG、GG型的PCR产物样品各2份送上海生物工程有限公司测序。
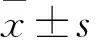
2 结果
2.1 两组血浆EPO水平比较 观察组和对照组血浆EPO水平分别为(454.113±35.097)、(396.316±50.262)pg/mL,二者比较,P<0.05。
2.2 两组EPO基因SNP/T3541G等位基因及基因型频率比较 两组EPO 基因SNP/T3541G等位基因及基因型频率比较见表1。相关性分析显示,EPO 基因SNP/T3541G多态性与PIH呈正相关(OR为0.451,95%CI:0.311~0.655,P<0.05),T等位基因为PIH的保护基因(OR为0.708,95%CI:0.602~0.833),G等位基因为PIH的危险因素(OR为1.569,95%CI:1.263~1.949)。

表1 两组EPO 基因SNP/T3541G等位基因及基因型频率比较(%)
注:与对照组相比,▲P<0.05。
3 讨论
EPO是具有多种活性的血管因子,在心脑血管疾病中具有血管保护作用[8];在肿瘤患者体内,EPO可调节瘤体血管生成。人类EPO基因定位于7q22,其3′端增强子上3 512 bp~3 740 bp之间有HIF-1和其它因子的结合部位,如肝核因子、雌激素等。许多转录因子结合在这个部位,可提高EPO基因的转录表达水平[9]。有研究表明,把低氧反应增强子通过载体转染至Hep3B等细胞,可在低氧或CoCl2刺激下大量表达EPO基因[10,11]。最新研究发现,在妊娠过程中,EPO具有促进胎盘血管生成,改善胎盘血管功能的作用;可调控胎盘滋养细胞的增殖、分化、侵袭、凋亡,完成子宫螺旋动脉重铸及胎盘血管新生,维持母胎界面平衡,保证胎盘正常血供和营养支持[12]。
EPO与PIH的相关性国内外早有报道[13~15],在PIH患者的胎盘、血液、脐带血中EPO水平明显增高。本研究发现,在青海省汉族PIH组中,突变杂合子TG及突变纯合子GG基因型频率明显高于对照组。T等位基因频率低于对照组,但G等位基因频率明显高于对照组。EPO基因SNP/T3541G与PIH呈正相关,G等位基因是PIH的危险因素。EPO基因是受HIF基因调控的缺氧诱导通路主要调控基因。在缺氧的条件下,HIF基因高表达,作用于低氧调控区使EPO表达上调十倍左右,从而使机体内红细胞和血红蛋白浓度升高,改善机体缺氧状态。HIF在妊娠绒毛和蜕膜组织中表达增强,可诱导 EPO合成增加[16],EPO促进血管生成和抗凋亡,调节胚胎发育。原因可能为EPO通过下调NF-κB的表达从而抑制滋养细胞凋亡及相关活化通路,活化的 NF -κB 通过与相应的炎症介质靶基因启动子区的κB 位点相结合而导致炎症介质相关基因的过度表达,因此EPO可通过抑制NF-κB来抑制TNF-ɑ介导的炎症因子释放,另外,EPO可增强内皮细胞功能,促进eNOS的合成,使NO合成增多,血管扩张,改善胎盘血液供应,从而对胎盘产生保护作用[17]。
研究报道,EPO基因T3541G位点突变型TG和GG型较野生型TT型相比,可促进EPO表达[18,19]。如在藏族红细胞增多患者中以TG型多见。这与本研究结果一致,PIH患者EPO基因T3541G位点突变以TG型多见,血浆EPO水平明显高于正常孕妇。对藏猪EPO基因的多态性研究[20]认为随着海拔增高,藏猪的突变型基因频率增高可能与高原低氧环境适应有关。
综上所述,青海省汉族PIH患者血浆EPO水平高于健康孕妇。EPO基因SNP/T3541G多态性与PIH有关。但本研究样本量相对较少,且没有具体检测不同基因型对EPO表达的影响,只是比较了两组血浆EPO水平。今后研究应将EPO增强子区T3541G不同基因型的基因通过载体导入到相应细胞中,区分其对EPO表达的影响,为EPO基因多态性与妊高征的相互作用提供有力证据。
[1] Suzuki Y, Matsuura A, Yamamoto T. Management of pregnancy induced hypertension [J]. Nihon Rinsho Jap Jour Clin Med, 2015,73(11):1897-1903.
[2] 曹泽毅.中华妇产科学[M].3版.北京:人民卫生出版社,2014:503-521.
[3] 谢莹莺, 李凤莲, 刘春燕,等. 青海地区子痫前期患者HLA-GmRNA及蛋白表达研究[J]. 实用妇产科杂志, 2012, 28(8):671-674.
[4] 韩云, 徐友娣. 基因多态性与妊娠期高血压疾病[J]. 国际妇产科学杂志, 2011,38(1):17-20.
[5] 季玉琴,张玉泉,李大金.促红细胞生成素及受体在妊娠维持中的作用[J]. 国际妇产科学杂志,2010,37(3):165-167.
[6] 刘海平,孔兆伟,胡扬.EPO基因3′端增强子T3541G单核酸多态性与有氧运动能力关联性研究[J]. 中国应用生理学杂志,2013,29(4):309-311.
[7] 刘海平,郑兆云,胡扬. 中国北方汉族人群EPO基因SNP/T3541G多态性研究[J].中国应用生理学杂志,2011 ,27(2):133-135.
[8] 龙小雅,崔红,韩伟娟.促红细胞生成素的神经保护作用[J].中国新生儿科杂志,2010,25(1):53-56.
[9] 萨珍, 次仁白珍, 欧珠旺姆,等. 藏族人群促红细胞生成素增强因子低氧诱导区多态性与高原红细胞增多症易感性分析[J]. 西藏医药, 2012,33(3):1-3.
[10] 苏燕, 李宏伟, 张静,等. pGL3-EPO-HRE报告基因质粒的构建及功能鉴定[J]. 基础医学与临床, 2006, 26(11):1220-1220.
[11] Schrg A, Santambrogio S, Platt JL, et al. Destruction of a distal hypoxia response element abolishes trans-activation of the PAG1 gene mediated by HIF-independent chromatin looping[J]. Nucleic Acids Res, 2015, 43(12):5810-5823.
[12] Kosinski P, Bombaopon DA, Wielgo M, et al. First trimester erythropoietin (EPO) serum concentration as a potential marker for abnormal placentation disorders. Reference values for erythropoietin (EPO) concentration at 11-13 weeks of gestation[J]. Jour Per Med, 2016, 44(2):187-193.
[13] 孙姝, 韩英, 张楠,等. 重度子痫前期脐血及羊水中促红细胞生成素含量及其与胎儿缺氧的相关性研究[J]. 中国妇幼保健, 2006, 21(11):1504-1506.
[14] 齐朝阳, 高宇琳, 黎琳欢,等. 促红细胞生成素及其受体、微血管密度在重度子痫前期胎盘中的作用[J]. 实用医学杂志, 2014,30(3):425-428.
[15] Hershkovitz R, Ohel I, Sheizaf B, et al. Erythropoietin concentration among patients with and without preeclampsia[J]. Arch Gyne Obste, 2005, 273(3):140-143.
[16] 付浩宇, 杜焕青, 董枫,等. 炎症相关因子在不明原因早期自然流产患者绒毛及蜕膜组织中的表达[J]. 中国妇幼保健, 2013, 28(24):3989-3991.
[17] Burger D, Lei M, Geogheganmorphet N, et al. Erythropoietin protects cardiomyocytes from apoptosis via up-regulation of endothelial nitric oxide synthase[J]. Card Res, 2006,72(1):51-59.
[18] 杜亚利, 郭馨云, 俞平,等. 造血相关因子在高原红细胞增多症中的作用[J]. 医学综述, 2015,21(15):2703-2706.
[19] Grebien F,Kerenyi MA. Kovacic B,et al.Stat 5 activation enables erythropoiesis in the absence of EpoR and Jak 2[J] Blood, 2008,11(9):4511-4522.
[20] 刘金凤, 商鹏, 旦增旺久,等. 藏猪促红细胞生成素(EPO)基因多态性分析[J]. 湖北农业科学, 2012, 51(12):2590-2592
青海省自然科学基金资助项目(2015-ZJ-746)。
李建华(E-mail: lijianhua@qhu.deu.cn)
10.3969/j.issn.1002-266X.2017.19.017
R714.26
B
1002-266X(2017)19-0057-03
2017-01-19)

