生理性孕酮撤退过程中小鼠子宫角组织蛋白激酶 B、糖原合成激酶3β 的表达观察
时灿灿,于明明,张先平,陈丽刚,王乾兴
(1遵义医学院细胞生物学教研室,贵州遵义 563003;2娄底市中心医院)
生理性孕酮撤退过程中小鼠子宫角组织蛋白激酶 B、糖原合成激酶3β 的表达观察
时灿灿1,于明明1,张先平2,陈丽刚1,王乾兴1
(1遵义医学院细胞生物学教研室,贵州遵义 563003;2娄底市中心医院)
目的 观察生理性孕酮撤退小鼠子宫角组织中蛋白激酶 B(Akt)及糖原合成激酶3β(GSK3β)的表达变化。方法 90只未交配健康成年雌性C57BL/6J小鼠,制作生理性孕酮撤退模型,分别在孕酮撤退0、8、12、16、20、24、32、40、48 h(48 h为小鼠生理性孕酮撤退周期)时处死10只小鼠,收集子宫角组织。采用real-time PCR法检测孕酮撤退各时点小鼠子宫角组织Akt、GSK3β mRNA,采用Western blotting法检测孕酮撤退各时点小鼠子宫角组织总蛋白激酶 B(t-Akt)、磷酸化蛋白激酶 B(Akt)及3βp-Akt及磷酸化糖原合成激酶(p-GSK3β)。结果 随孕酮撤退时间延长,Akt mRNA及蛋白相对表达量逐渐降低,孕酮撤退20 h时达到最低值,后随孕酮撤退时间逐渐延长,Akt mRNA及蛋白相对表达量逐渐升高。孕酮撤退8 h 时GSK mRNA及蛋白相对表达量高于孕酮撤退0 h时(P<0.05);随孕酮撤退时间延长,GSK mRNA及蛋白相对表达量逐渐降低,孕酮撤退24 h时达到最低值,后随孕酮撤退时间逐渐延长, GSK mRNA及蛋白相对表达量逐渐增加。孕酮撤退20 h小鼠子宫角组织 Akt 、GSK3β mRNA表达量低于孕酮撤退后0、48 h(P均<0.05)。与孕酮撤退0 h比较,孕酮撤退20 h时小鼠子宫角组织p-Akt、p-GSK3β的相对表达量均降低(P均<0.05)。与孕酮撤退8 h比较,孕酮撤退20 h时小鼠子宫角组织p-GSK3β的相对表达量降低(P<0.05)。与孕酮撤退20 h比较,孕酮撤退48 h时小鼠子宫角组织p-Akt、p-GSK3β的相对表达量均升高(P均<0.05)。结论 生理性孕酮撤退小鼠子宫角组织中存在Akt表达随时间下降后上调,GSK3β表达随时间上调后下降后再次上调。 Akt/GSK-3β信号通路可能在鼠孕酮撤退过程中起重要作用。
月经;孕酮撤退;蛋白激酶 B;糖原合成激酶3β;动物实验
在晚分泌期由于黄体功能的下降导致体内孕酮水平的降低成为孕酮撤退,孕酮撤退导致子宫内膜经历一系列生化和细胞水平上的变化,最后发生凋亡和崩解,造成子宫内膜出血、脱落,即月经发生。孕酮撤退导致子宫内膜快速崩解、脱落是月经的显著特征。月经是一个由于孕酮撤退而引发的涉及到内分泌和局部免疫系统相互作用的一个组织损伤过程[1]。目前关于子宫内膜崩解和修复过程所涉及分子机制并不明确。蛋白激酶 B/糖原合成激酶3β(Akt/ GSK3β)信号通路是细胞内重要的信号转导途径之一,在调节细胞增殖、分化、凋亡、迁移、新陈代谢和血管生成等机体生理活动中具有重要作用。最新研究发现,磷酸化-蛋白激酶 B (p-Akt)及磷酸化-糖原合成激酶3β(p-GSK3β)在正常月经周期增殖期和分泌期子宫内膜中的表达呈周期性变化[2,3],但关于其在孕酮撤退过程中的表达变化尚未见报道。本研究建立小鼠生理性孕酮撤退模型(即月经模型),模拟子宫内膜崩解和修复过程,观察Akt/GSK-3β信号通路在子宫内膜崩解和修复过程中的表达变化,现将结果报告如下。
1 材料与方法
1.1 实验动物与试剂 未交配健康成年(8~12周龄)雌性C57BL/6J小鼠90只购自重庆第三军医大学实验动物研究所,SPF Ⅱ级;光周期调控为6∶00~18∶00光照,18∶00~6∶00黑暗。温度(21 ±1)℃,自由进食和摄水。雌二醇(E2,Alfa Aesar公司,英国);孕酮(P4,Sigma公司,美国);所有引物均由上海生工生物工程技术有限公司合成。
1.2 小鼠生理性孕酮撤退模型建立方法 小鼠生理性孕酮撤退模型建立方法参照文献[4]稍作修改。主要步骤为:取90只小鼠乙醚麻醉下行双侧卵巢切除术,术后适应性恢复7 d以清除体内内源性激素,以术后第7天记为实验第0天。分别于实验第1~3天上午9∶30对小鼠皮下注射E2 100 ng;实验第4~6天不做任何处理;实验第7天上午9∶30于小鼠背部皮下埋植孕酮皮埋管,同时皮下注射P4 50 ng和E25 ng;实验第8、9天的上午9∶30分别皮下注射E25 ng;实验第9天上午11∶30取小鼠,在一侧子宫角注射20 μL过滤除菌花生油诱导子宫内膜蜕膜化,诱导蜕膜化49 h后取出孕酮皮埋管,此点记为孕酮撤退0 h。分别在孕酮撤退0、8、12、16、20、24、32、40、48 h(48 h为小鼠生理性孕酮撤退周期)时随机颈椎脱臼处死10只小鼠,收集子宫角组织,迅速放于液氮中冷冻,-80 ℃保存备用。
1.3 生理性孕酮撤退模型小鼠子宫角组织Akt、GSK3β mRNA检测 采用real-time PCR法。取生理性孕酮撤退模型小鼠子宫角组织,根据TRIzol试剂盒说明书提取总RNA,使用紫外分光光度计测定总RNA纯度和浓度,所用样品RNA的260/280比值在1.8~2.0。采用逆转录试剂盒(TaKaRa)进行逆转录生成cDNA后进行real-time PCR实验。扩增条件:95 ℃预变性30 s,95 ℃变性5 s、60 ℃退火30 s,共40个循环。Akt基因上游引物序列5′-CCCTTCTACAACCAGGACCA -3′,下游引物5′-CATGATCTCCTTGGCATCCT-3′; GSK3β基因上游引物序列5′-TGGCGTGTGATGTCAGGTAT -3′,下游引物5′-TAAGCTGGCATCTGCAACAC-3′;β-actin上游引物5′-AGGTATCCTGACCCTGAAGT-3′,下游引物5′-AGGTCTCAAACATGATCTGG-3′。以β-actin为内参。Akt及GSK3β mRNA的相对表达量以2-ΔΔCt表示。
1.4 生理性孕酮撤退模型小鼠子宫角组织总蛋白激酶 B(t-Akt)、磷酸化蛋白激酶 B(Akt)及3βp-Akt及磷酸化糖原合成激酶(p-GSK3β)蛋白检测 采用Western blotting法。取生理性孕酮撤退模型小鼠子宫角组织,提取小鼠子宫组织总蛋白后通过二喹啉甲酸( BCA) 法测定蛋白浓度,将40 μg蛋白样品进行聚丙烯酰胺凝胶电泳,常规转膜,5%脱脂牛奶室温封闭2 h,兔抗鼠一抗(1∶1 000)4 ℃孵育过夜。TBST洗涤,加入辣根过氧化酶( HRP) 标记的羊抗兔二抗( 1∶2 000) 室温孵育1 h,TBST洗涤,ECL 发光检测, 凝胶图象分析各条带的光密度值。以GAPDH为内参,以t-Akt、p-Akt及p-GSK3β的光密度与GAPDH光密度之比表示t-Akt、p-Akt及p-GSK3β的相对表达量。实验重复3次,取平均值。
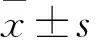
2 结果
2.1 孕酮撤退各时点小鼠子宫角组织Akt、GSK3β mRNA相对表达量比较 孕酮撤退各时点小鼠子宫角组织Akt、GSK3β mRNA相对表达量比较见表1。
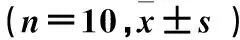
表1 孕酮撤退各时点小鼠子宫角组织Akt、GSK3β mRNA相对表达量比较
注:与孕酮撤退0 h比较,*P<0.05;与孕酮撤退8 h比较,☆P<0.05;与孕酮撤退20 h比较,#P<0.05。
2.2 孕酮撤退各时点小鼠子宫角组织t-Akt、p-Akt及p-GSK3β相对表达量比较 孕酮撤退各时点小鼠子宫角组织t-Akt、p-Akt及p-GSK3β 相对表达量比较见表2。

表2 孕酮撤退各时点小鼠子宫角组织t-Akt、p-Akt及p-GSK3β相对表达量比较
注:与孕酮撤退0 h比较,*P<0.05;与孕酮撤退8 h比较,☆P<0.05;与孕酮撤退20 h比较,#P<0.05。
3 讨论
子宫内膜在雌激素和孕激素作用下,经历了增殖、分化以及在分泌晚期孕酮撤退情况下的子宫内膜周期性的崩解、脱落和其后的再生修复过程。孕酮撤退后引起子宫螺旋动脉收缩,导致组织缺氧而引起长时间小动脉松弛和组织缺血再灌注,这又进一步引起了螺旋动脉的收缩,引起子宫内膜细胞凋亡,最终导致子宫内膜崩解和出血[5]。研究表明子宫内膜细胞凋亡是月经发生的原因,人子宫内膜细胞凋亡主要发生在晚分泌期,在月经期达到最高[6]。提示孕酮撤退后上调炎性介质引起的炎症反应诱导子宫内膜基质细胞凋亡是子宫内膜组织崩解、坏死和脱落(即月经发生)的主要生理事件之一[7~9]。但究竟是什么信号来调控子宫内膜细胞凋亡目前尚未见报道,且子宫内膜修复过程中的分子机制也还不清楚。
Akt/GSK3β信号通路为经典的抗细胞凋亡途径,同时可能参与缺血再灌注性组织损伤的修复[10]。最新研究表明,该通路参与子宫内膜细胞的增殖、凋亡及炎症反应和血管生成,对维持子宫内膜规律、周期性变化具有重要作用。蛋白激酶B(PKB/Akt)是一种丝氨酸/苏氨酸蛋白激酶,其激酶催化结构域与蛋白激酶A和蛋白激酶C具有较高的相似性。Akt激酶催化结构域苏氨酸残基(Thr308)位点磷酸化是活化Akt所必需的,其调节区域含有的第二个磷酸化位点(Ser473)磷酸化则可使Akt获得最高活性。生理条件下,Akt以低活性状态存在于细胞质,当细胞受到胞外刺激(如缺血或缺氧)时,首先活化磷脂酰肌醇-3激酶(PI3K),使其催化产生PIP3并与含有PH结构域的Akt结合,从而使其被激活成为磷酸化Akt(p-Akt)。p-Akt转位到胞质或细胞核内,通过磷酸化GSK-3β的N-端ser-9位点而使之失活,促使下游的促存活、促细胞周期转录因子表达增加以及负调控caspase活性,最终抑制凋亡[11]。本实验结果显示,孕酮撤退后子宫内膜组织中总Akt蛋白在各时间点表达量无明显差异,而Akt mRNA和p-Akt蛋白表达量从8 h开始缓慢降低,到20 h达最低点,随后又逐渐增加,至48 h恢复到一定水平;GSK3β mRNA和p-GSK3β蛋白在孕酮撤退后8 h表达最高,随后时间点表达趋势与Akt mRNA和p-Akt蛋白表达趋势一致。提示其机制可能为:①小鼠子宫内膜组织中总的Akt和GSK3β在月经周期中未出现周期性改变,与p-Akt和p-GSK3β的周期性变化不符。在人正常月经周期中的研究中也证实了这一点,即子宫内膜功能层中总Akt和GSK3β表达量在月经周期各阶段无明显差异,而p-Akt及p-GSK3β表达呈周期性变化[3,12]。这说明Akt和GSK3β的活性调节不是在转录水平进行,而是通过非转录机制进行蛋白质磷酸化而实现的信号分子的快速激活[13,14]。②在孕酮撤退后的月经发生过程(0~24 h)中,孕酮撤退12 h以前为小鼠月经发生的可逆转时期,主要进行相关细胞因子表达以诱导子宫内膜基质细胞凋亡;孕酮撤退16 h以后为不可逆时期,主要进行白细胞、上皮细胞等引发的组织崩解事件[4]。本研究结果显示,p-Akt在0 h表达最高,而p-GSK3β则在孕酮撤退8 h表达量增加,且都在随后时间点逐渐下降,至孕酮撤退20 h达到最低。说明随着孕酮撤退后小鼠体内孕酮水平的下降,Akt/GSK3β信号通路受抑制,即首先p-Akt水平下降,从而减少对GSK-3β的磷酸化作用使其活性增加,进而调控下游信号分子的表达而促进细胞凋亡,其可能机制有:激活p53表达而抑制Bcl-2、激活Bax,促进细胞凋亡[15]; GSK3β磷酸化水平的降低,可以解除p-GSK3β对NF-κB的竞争性抑制作用,一方面上调促炎性细胞因子生成,另一方面促使NF-κB p65转位入核与MMP-9启动子结合,从而促进子宫内膜组织崩解[16]。③在孕酮撤退后的子宫内膜再生和修复过程(24~48 h)中,p-Akt和p-GSK3β从孕酮撤退24 h开始表达量增加,至48 h时达到高峰,这与人子宫内膜研究结果相吻合[2],即p-Akt在分泌早期和中期表达较增殖期降低,分泌晚期又逐渐增加,但均低于蜕膜组织。说明Akt/GSK3β信号通路的激活也参与了子宫内膜再生和修复过程。其可能机制是:可竞争性抑制NF-κB活性,抑制促炎性细胞因子生成,利于修复[17];促进一氧化氮合酶(eNOS)的表达,增加子宫内膜腺体和基质细胞中的NO水平,从而促进子宫内膜增殖、血管扩张和血流灌注[17];通过促血管生成素和血管内皮生长因子(VEGF)激活Akt,抑制血管内皮细胞凋亡,启动一氧化氮合酶(eNOS),反过来促进内皮细胞迁移、血管生成[18]。
综上所述,孕酮撤退可能通过非转录机制而调控Akt磷酸化程度,负性调节GSK3β活性,进而通过其下游相关效应分子调控月经期子宫内膜炎性细胞浸润、蜕膜化基质细胞发生凋亡崩解以及后期组织重塑。
[1] Henriet P, Gaide Chevronnay HP, Marbaix E. The endocrine and paracrine control of menstruation[J]. Mol Cell Endocrinol, 2012,358(2):197-207.
[2] Toyofuku A, Hara T, Taguchi T, et al. Cyclic and characteristic expression of phosphorylated Akt in human endometrium and decidual cells in vivo and in vitro[J]. Hum Reprod, 2006,21(5):1122-1128.
[3] Salameh W, Helliwell JP, Han G, et al. Expression of endometrial glycogen synthase kinase-3beta protein throughout the menstrual cycle and its regulation by progesterone[J]. Mol Hum Reprod, 2006,12(9):543-549.
[4] Wang Q, Xu X, He B, et al. A critical period of progesterone withdrawal precedes endometrial breakdown and shedding in mouse menstrual-like model[J]. Hum Reprod, 2013,28(6):1670-1678.
[5] Cousins FL, Murray AA, Scanlon JP, et al. Hypoxyprobe reveals dynamic spatial and temporal changes in hypoxia in a mouse model of endometrial breakdown and repair[J]. BMC Res Notes, 2016,9(1):30.
[6] Li A, Felix JC, Hao J, et al. Menstrual-like breakdown and apoptosis in human endometrial explants[J]. Hum Reprod, 2005,20(6):1709-1719.
[7] Sikora J, Mielczarek-Palacz A, Kondera-Anasz Z, et al.Peripheral blood proinflammatory response in women during menstrual cycle and endometriosis[J]. Cytokine, 2015,76(2):117-122.
[8] Zelazniewicz A, Borkowska B, Nowak J, et al. The progesterone level,leukocyte count and disgust sensitivity across the menstrual cycle[J]. Physiol Behav, 2016,161(9):60-65.
[9] Graziottin A, Zanello PP. Menstruation, inflammation and comorbidities: implications for woman health[J]. Minerva Ginecol, 2015,67(1):21-34.
[10] 王建明,郑德义,贾一韬,等.MAPK及PI3K-AKT信号通路活化在小鼠胃缺血再灌注损伤中的作用[J]. 山东医药,2010,50(10):6-7.
[11] Song YH, Jeong SJ, Kwon HY, et al.Ursolic acid from Oldenlandia diffusa induces apoptosis via activation of caspases and phosphorylation of glycogen synthase kinase 3 beta in SK-OV-3 ovarian cancer cells[J]. Biol Pharm Bull, 2012,35(7):1022-1028.
[12] Khorram O, Han G. Influence of progesterone on endometrial nitric oxide synthase expression[J]. Fertil Steril, 2009,91(5 Suppl):2157-2162.
[13] Saitoh M, Ohmichi M, Takahashi K, et al. Medroxyprogesterone acetate induces cell proliferation through up-regulation of cyclin D1 expression via phosphatidylinositol 3-kinase/Akt/nuclear factor-kappaB cascade in human breast cancer cells[J]. Endocrinology, 2005,146(11):4917-4925.
[14] Burge JA, Hanna MG, Schorge S. Nongenomic actions of progesterone and 17β-estradiol on the chloride conductance of skeletal muscle[J]. Muscle Nerve, 2013,48(4):589-591.
[15] Lin CL, Tseng HC, Chen RF, et al. Intracellular zinc release-activated ERK-dependent GSK-3β-p53 and Noxa-Mcl-1 signaling are both involved in cardiac ischemic-reperfusion injury[J]. Cell Death Differ, 2011,18(10):1651-1663.
[16] Stark AK, Sriskantharajah S, Hessel EM, et al. PI3K inhibitors in inflammation, autoimmunity and cancer[J]. Curr Opin Pharmacol, 2015 ,23(8):82-91.
[17] Evans J, Salamonsen LA. Decidualized human endometrial stromal cells are sensors of hormone withdrawal in the menstrual inflammatory cascade[J]. Biol Reprod, 2014,90(1):14.
[18] Viglietto G, Amodio N, Malanga D, et al. Contribution of PKB/AKT signaling to thyroid cancer[J]. Front Biosci, 2011,16(1):1461-1487.
Expression of protein kinase B and glycogen synthase kinase 3β in mouse uterine horn during the process of physiological progesterone withdrawal
SHICancan1,YUMingming,ZHANGXianping,CHENLigang,WANGQianxing
(1DepartmentofCellBiology,ZunyiMedicalUniversity,Zunyi563003,China)
Objective To observe the expression of protein kinase B (Akt) and glycogen synthase kinase 3β (GSK3β) in the uterine tissues of mouse models in the process of physiological progesterone withdrawal.Methods We selected 90 non-mating healthy adult female C57BL/6J mice to make the physiological progesterone withdrawal models. Ten mice were killed at 0, 8, 12, 16, 20, 24, 32, 40, and 48 h (The physiological progesterone withdrawal cycle in mice is 48 h) to collect uterine horns. The gene expression levels of Akt and GSK3β were detected by real-time PCR. The protein expression levels of total Akt, phosphorylated AKT and phosphorylated GSK-3β were detected by Western blotting.Results Over the time of progesterone withdrawal, the expression of Akt mRNA and protein gradually decreased (reached the minimum at 20 h) and then gradually increased. The expression of GSK3β mRNA and protein at 8 h was higher than that at 0 h (P<0.05). Over the time of progesterone withdrawal, the expression of GSK mRNA and protein decreased (reached the minimum at 24 h) and then gradually increased. The expression of Akt and GSK3β mRNA at 20 h was lower than that at 0 and 48 h (bothP<0.05). The expression of p-Akt and p-GSK-3β at 20 h decreased as compared with that at 0 h (bothP<0.05). The expression of p-GSK-3β protein in mouse uterine tissues at 20 h decreased as compared with that at 8 h (P<0.05). The expression of p-Akt and p-GSK3β protein at 48 h increased as compared with that at 20 h (allP<0.05).Conclusions Over the time of progesterone withdrawal, the expression of Akt gradually decreases and then increases in the uterine tissues of mouse models. Meanwhile, the expression of GSK3β first increases, then decreases, and finally increases again. Akt/GSK3β signal pathway may play an important role in the process of progesterone withdrawal.
menstruation; progesterone withdrawal; protein kinase B; glycogen synthase kinase 3β; animal experiment
贵州省科技厅联合基金项目(黔科合J字LKZ-2010-33号);贵州省科学技术基金资助项目(黔科合J字-2011-2282)。
时灿灿(1987-),女,硕士研究生,主要研究方向为生殖医学。E-mail: 915939832@qq.com
王乾兴(1974-),男,博士,副教授,硕士生导师,主要研究方向为生殖医学。E-mail: 317002641@qq.com
10.3969/j.issn.1002-266X.2017.19.003
R711.3
A
1002-266X(2017)19-0009-04
2016-11-18)

