结肠癌细胞HIF-1α及MDR1 miRNA 重组慢病毒干扰体系多药耐药研究
杨光磊 胡岩芳 胡延伟 王 钊 张仕东 葛国庆
结肠癌细胞HIF-1α及MDR1 miRNA 重组慢病毒干扰体系多药耐药研究
杨光磊 胡岩芳 胡延伟 王 钊 张仕东 葛国庆
目的 研究HIF-1α及MDR1 miRNA 重组慢病毒干扰体系的多药耐药性。方法 收集结肠癌切除的标本60例,用福尔马林(10%)浸泡,制成蜡块存档标本。通过观察HIF-1α与P-gp的表达和分布情况,找出二者关联。并构建miRAN干扰体系,研究重组慢病毒干扰体系和结肠癌细胞多药耐药的关系。结果 HIF-1α的表达与患者的性别、年龄、肿瘤的位置以及肿瘤分化的程度无关(P>0.05),而与Dukes分期、淋巴结转移有关。HIF-1α表达与P-gp的表达呈显著正相关(γ=0.613,P<0.05)。LoVo 细胞对 ADR、VCR及5-Fu的敏感性均有不同程度的恢复,但沉默HIF-1α前后并无统计学差异(P>0.05),沉默 MDR1基因后,LoVo细胞对 ADR 与 VCR 的耐药性有所逆转,沉默 MDR1 基因表达对二者化疗敏感性变化无明显影响。结论 HIF-1α与P-gp的表达不受患者的性别、年龄、肿瘤位置、分化程度的影响,HIF-1α表达与P-gp的表达呈显著正相关,说明HIF-1α通过与 MDR1/P-gp 的相互作用最终参与了结肠癌多药耐药的发生。
结肠癌;HIF-1α;miRNA;P-糖蛋白;多药耐药;慢病毒载体
(ThePracticalJournalofCancer,2017,32:545~547)
结肠癌是死亡率很高的恶性肿瘤之一,对结肠癌患者的治疗主要是化疗,不同的患者对化疗敏感性不同,其中多药耐药性(MDR)是化疗最终失败的主要原因[1]。所以研究多药耐药基因及其编码的蛋白就具有重要意义[2]。P-糖蛋白(p-glycoprotein,P-gp)是1种跨膜药物转运蛋白,多种化疗药物在体内的运转都需要P-gp,P-糖蛋白能将摄入细胞内的药物排出,维持细胞药物的低浓度水平。如果P-gp 蛋白过表达则出现对化疗药物的耐药性,最终导致化疗失败。研究发现在缺氧情况下缺氧诱导因子HIF-1α表达提升[3]。HIF-1α 的过表达造成肿瘤细胞对化疗药物耐药性增强,并且HIF-1α 还会与MDR1/P-gp 相互作用并参与到结肠癌的多药耐药中,所以控制 HIF-1α 的表达水平,就可以在基因水平上实现对结肠癌多药耐药的逆转[4]。 鉴于此,本课题通过观察结肠癌组织标本中HIF-1α与P-gp的表达和分布情况,检测4种结肠癌细胞株经低氧处理后 HIF-1α与 MDR1/P-gp的表达变化情况;利用 Invitrogen 公司的 BLOCK-i TTMLentiviral PolⅡmiR RNAi表达体系构建慢病毒载体,再由pc DNATM6.2-GW/Em GFP-miR-HIF-1α(MDR1)质粒,通过BP/LR反应,将 Em GFP-miR-HIF-1α和 Em GFP-miR-MDR1 的表达框整合重组到产毒质粒p Lenti6/V5-DEST里面,然后通过慢病毒混和包装质粒的载体包装病毒,最后通过293FT细胞产毒从而构建出慢病毒载体介导的 HIF-1α 与 MDR1 2套miRNA干扰体系,研究结肠癌细胞多药耐药的相关因素,从而在临床上可以从基因层面控制癌细胞的多药耐药性。
1 材料与方法
1.1 临床资料
收集我院 2013至2015年间的结肠癌切除的标本60例,用福尔马林(10%)浸泡,制成蜡块存档标本。60例结肠癌患者中男女各30例,年龄22~88岁;Dukes分期:AB 期32例,CD 期28例;病变分布:左面31例,右面29例;癌细胞分化程度:高、中分化37例,低分化23例;其中有20例伴随淋巴结发生转移。
1.2 研究方法
(1)使用免疫组织化学染色和双标染色技术,观察HIF-1α 和 P-gp 的分布及表达,研究它们的分布及表达与临床病理参数的关系[5]。
(2)分别在常氧和低氧培养条件下,检验 HIF-1α 与 MDR1/P-gp 的表达变化情况,探讨低氧环境对HIF-1α 及 MDR1/P-gp 表达的影响[6]。
(3)采用三维培养的方法分别建立稳定感染 HIF-1α 或 MDR1 miR重组慢病毒及亲本LoVo细胞的多细胞球(MCS)培养体系,模拟肿瘤细胞生存的微环境,经低氧培养处理,建立LoVo MCS耐药模型,用流式细胞术检测各组LoVo MCS的细胞周期分布情况;再利用Western blot技术检测HIF-1α及MDR1 miR在低氧诱导下的LoVo MCS水平与相应目的基因的沉默效果并与常氧培养的正常LoVo MCS中目的基因蛋白表达情况作比较。
(4)分别在常氧、低氧条件下得到ADR、VCR、5-Fu 和 CPT-11 4种药物,用MTT法检测多药耐药性变化,并在低氧诱导的LoVo MCS多药耐药的模型水平[7],分别检测 HIF-1α和MDR1两套miR重组慢病毒感染组细胞对上述4种化疗药物耐药性的变化,找出两者之间关系。
1.3 统计学处理
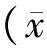
2 结果
2.1 HIF-1α的表达与结肠癌病理特征的关系
HIF-1α蛋白阳性表达率为 58.6% (35/60),阴性表达率为41.4%(25/60)。HIF-1α的表达与患者的性别、年龄、肿瘤位置及分化程度无关(P>0.05),与Dukes分期及淋巴结转移有关(P<0.05)。见表1。

表1 HIF-1α 与 P-gp的表达及与病理特征关系/例
2.2 HIF-1α与P-gp表达相关性研究
HIF-1α 与 P-gp 的相关性用Spearman 等级相关分析,SHIF-1α表达与P-gp的表达呈显著正相关(γ=0.613,P<0.05),见表2。

表2 HIF-1α与P-gp表达相关性/例
2.3 Lo Vo MCS经不同药物作用后IC50的比较
4种药物在低氧处理后的LoVo MCS中敏感性均有不同程度下降,IC50值均高于相应的常氧组(ADR、VCR、5-Fu,均P<0.01,显著耐药;CPT-11,P>0.05,差异不显著)。LoVo MCS/LVV-HIF-1α miR组中沉默HIF-1α基因后,LoVo细胞对 ADR、VCR及5-Fu的敏感性均有不同程度的恢复,但沉默 HIF-1α前后并无统计学差异(P>0.05)。对于 LoVo MCS/LVV-MDR1 miR组,沉默MDR1基因后,LoVo细胞对ADR与VCR 的耐药性有所逆转,而5-Fu与CPT-11的IC50值与低氧组相比无明显差异(P>0.05),表明沉默MDR1基因表达对二者化疗敏感性变化无明显影响。见表3。

表3 各组 LoVo MCS经不同药物作用后IC50的比较
3 讨论
1992年人类发现基因缺氧反应原件的核因子,它就是HIF-1。它广泛存在哺乳动物,包括人类的细胞中[8]。HIF-1包括HIF-1α和HIF-1β,HIF-1α和HIF-1β均属碱性螺旋-环-螺旋转录因子家族中的亚族蛋白[9]。HIF-1是由2个亚单位结合而构成异的异源二聚体[10],观察发现HIF-1β不但存在于正常细胞的细胞核和细胞质中,而且在缺氧细胞中也有表达。不同的是HIF-1α仅在缺氧细胞的核中表达,在有氧条件下被素蛋白酶系统降解。研究 HIF-1α 对肿瘤的各种影响具有深远意义[11]。肿瘤中往往存在着缺氧微环境,造成缺氧环境有3个原因,一是由于肿瘤血管结构和功能出现异常,二是由于微循环障碍导致供氧不足,三是肿瘤细胞大量繁殖,耗氧增加从而导致缺氧[12]。在这种缺氧环境下,HIF-1α与肿瘤的多种生物学特性都存在关联。HIF-1α 可以调节细胞内众多转录调控因子对缺氧做出适应性反应,从而维持肿瘤细胞的能量代谢,促进新生血管形成,促使肿瘤侵袭或转移,并诱导肿瘤耐药性增强。实验表明HIF-1α 表达与肿瘤的耐药存在密切关系[13]。因此阐明 HIF-1α 对结肠癌多药耐药的影响有助于实现逆转肿瘤耐药和提高化疗效果。
数据显示HIF-1α与MDR1/P-gp 在低氧环境下的表达明显上升,这与文献报道在结肠癌细胞中的研究结果相一致。 HIF-1α与P-gp 存在共表达和过表达现象,分析两者相关表达,可以看到HIF-1α与P-gp在结肠癌组织中的表达呈显著正相关(P<0.01),说明HIF-1α与P-gp相互关联,相互作用,并共同参与了结肠癌的多药耐药性的发生。低氧条件下诱导结肠癌亲本LoVo MCS产生MDR表型,形成有效的耐药模型,对ADR、VCR及5-Fu均产生不同程度耐药,对CPT-11的影响不大。沉默MDR1基因可以逆转由P-gp经典耐药途径介导的LoVo MCS对ADR和VCR产生的耐药;沉默 HIF-1α 基因可以有效逆转LoVo MCS对 ADR、VCR及5-Fu产生的耐药。耐药逆转机制可能与其诱导MDR1/P-gp的表达、参与细胞周期的调控、抑制细胞凋亡等多因素相关。
[1] 曹 锴,狄建彬,魏文祥,等.miRNA在结肠癌早期诊断和筛选中的作用〔J〕.世界华人消化杂志,2009,17(35):3615-3619.
[2] 汪道峰,娄 宁,李小东,等.慢病毒介导shRNA 静默CXCR4 对Eca109 细胞转移特性的影响〔J〕.中山大学学报医学科学版,2010,31(6):761-766.
[3] 汪云霞,魏亚明,王晓华,等.bmi-1shRNA 逆转录病毒表达载体的构建及稳定转染LoVo 细胞系的建立〔J〕.肿瘤防治研究,2010,37(3):269-273.
[4] 胡 斌,杨 燕,刘 嘉,等.表达HBsAg 特异性siRNA 的重组腺相关病毒载体的构建〔J〕.实用肝脏病杂志,2010,13(3):161-164.
[5] 汪晓东,曹 霖,曾天芳,等.多学科协作诊治模式下新辅助辅助化疗联合结直肠癌手术的临床效果〔J〕.中国普外基础与临床杂志,2008,15(8):615-619.
[6] Wartenberg M,Ling FC,Schallenberg M,et al.Down-regulation of intrinsic P-glycoprotein expression in multicellular prostate tumor spheroids by reactive oxygen species〔J〕.J Biol Chem,2001,276(20):17420-17428.
[7] Wartenberg M,Fischer K,Hescheler J,et al.Redox regulation of P-glycoprotein-mediated multidrug resistance in multicellular prostate tumor spheroids〔J〕.Int J Cancer,2000,85(2):267-274.
[8] Wartenberg M,Ling FC,Muschen M,et al.Regulation of the multidrug resistance transporter P-glycoprotein in multicellular tumor spheroids by hypoxia-inducible factor (HIF-1) and reactive oxygen species〔J〕.Faseb J,2003,17(3):503-505.
[9] Fukuda R,Hirota K,Fan F,et al.Insulin-like growth factor 1 induces hypoxia-inducible factor 1-mediated vascular endothelial growth factor expression,which is dependent on MAP kinase and phosphatidylinositol 3-kinase signaling in colon cancer cells〔J〕.J Biol Chem,2002,277(41):38205-38211.
[10] Kimura S,Kitadai Y,Tanaka S,et al.Expression of hypoxia-inducible factor (HIF)-1alpha is associated with vascular endothelial growth factor expression and tumour angiogenesis in human oesophageal squamous cell carcinoma〔J〕.Eur J Cancer,2004,40(12):1904-1912.
[11] Roninson IB,Chin JE,Choi KG,et al.Isolation of human mdr DNA sequences amplified in multidrug-resistant KB carcinoma cells〔J〕.Proc Natl Acad Sci USA,1986,83(12):4538-4542.
[12] Sampath J,Sun D,Kidd VJ,et al.Mutant p53 cooperates with ETS and selectively up-regulates human MDR1 not MRP1〔J〕.J Biol Chem,2001,276(42):39359-39367.
[13] Oikawa M,Abe M,Kurosawa H,et al.Hypoxia induces transcription factor ETS-1 via the activity of hypoxia-inducible factor-1〔J〕.Biochem Biophys Res Commun,2001,289(1):39-43.
(编辑:甘 艳)
Multidrug Resistance of Colon Cancer Cells HIF-1α and MDR1 miRNA LentivirusInterference System
YANGGuanglei,HUYanfang,HUYanwei,etal.
XingtaiPeople’sHospital,Xingtai,054031
Objective To study multidrug HIF-1α and MDR1 miRNA lentivirus system interference resistance.Methods60 cases of colon cancer resection specimens soaked with the formalin(10%),made of wax block archived specimens.Correlation between HIF-1α and P-gp were detected by observing their expression and distribution.Build,recombinant lentivirus relationship miRAN system interference interference system and colon cancer cells multidrug resistance.Results The gender,age,location of the tumor and the degree of tumor differentiation were independent of the expression of HIF-1(P>0.05),which was related to Dukes stage and lymph node metastasis.SHIF-1 expression was significantly positively correlated with P-gp expression(γ=0.613,P<0.05).ADR,VCR and LoVo cells on the sensitivity of 5-Fu had different degrees of recovery,but there was no significant difference between before and after silencing HIF-1 alpha(P>0.05),MDR1 gene silencing,the drug resistance of LoVo cells to ADR and VCR have reversed,silencing the expression of MDR1 had no significant effect on the change of chemotherapy sensitivity.Conclusion HIF-1α and P-gp expression are not affected by gender,age,and location,differentiation degree.HIF-1α and P-gp expression are positively correlated,and HIF-1α eventually involved in the occurrence of colon cancer multidrug resistance by interacting with MDR1/P-gp.
Colon cancer;HIF-1α;miRNA;P-gp;Multidrug resistance;Lentiviral vectors
054031 河北省邢台市人民医院
10.3969/j.issn.1001-5930.2017.04.007
R735.3+5
A
1001-5930(2017)04-0545-03
2016-05-09
2016-11-04)

