基于BP神经网络的牡蛎α葡萄糖苷酶抑制剂活性肽制备工艺优化
延海莹,刘盟梦,左思琦,李先玉,王 鹏
(中国海洋大学食品科学与工程学院,山东青岛 266003)
基于BP神经网络的牡蛎α葡萄糖苷酶抑制剂活性肽制备工艺优化
延海莹,刘盟梦,左思琦,李先玉,王 鹏*
(中国海洋大学食品科学与工程学院,山东青岛 266003)
为获得α-葡萄糖苷酶抑制率活性较好的活性肽,采用牡蛎为原料,选取中性蛋白酶和动物蛋白水解酶进行酶解。以牡蛎酶解活性肽的α-葡萄糖苷酶抑制率为评判指标,进行均匀设计实验,获得了酶解温度、加酶量和底物浓度三者与牡蛎活性肽α-葡萄糖苷酶抑制率之间的关系。将前三者作为BP神经网络的输入,后者作为输出设计神经网络,对牡蛎酶解过程进行模拟以及对牡蛎活性肽的活性进行预测,并得出最优酶解工艺参数。结果表明:酶解温度为55 ℃,酶解时间为5 h,加酶量为600 U/g,底物浓度为0.25 g/mL时,酶解产物的α-葡萄糖苷酶抑制率最大为89.22%。因此,利用BP神经网络可对牡蛎酶解非线性过程进行较好的模拟,并且对酶解产物的α-葡萄糖苷酶抑制率可进行较好预测,有利于牡蛎酶解活性肽的产业化制备。
牡蛎,活性肽,神经网络,α-葡萄糖苷酶抑制率
糖尿病是遗传和环境因素引起的常见病,目前比较成熟的治疗糖尿病的口服药物是α-葡萄糖苷酶抑制剂。其作用机理是通过抑制α-葡萄糖苷酶的活性,使寡糖无法水解为单糖,从而降低用餐后的血糖水平[1]。天然的α-葡萄糖苷酶抑制剂来源广泛,如植物、动物、食物和微生物资源[2]。
牡蛎含有丰富的蛋白肽,具有丰富的营养价值,滕瑜等[3]研究表明牡蛎提取物对实验大鼠高血糖具有一定的降低作用。李会丽等[4]研究表明牡蛎蛋白酶解液对α-葡萄糖苷酶具有抑制作用。牡蛎酶解过程中受酶解温度、酶浓度、料水比、pH等影响显著,其活性也因酶解过程条件的差异而具有非线性,不利于工业化大规模生产。因此对酶解工艺参数进行优化,得到最优酶解工艺,获得最大α-葡萄糖苷酶抑制率可以大大降低工业成本[5]。传统的实验方法例如响应面法不能充分考虑不同因素、不同水平之间的交互作用,其建立的模型往往不能充分的反映真实情况[5]。BP神经网络(ANN)模仿动物神经网络行为特征,这种网络依靠复杂的系统,通过调整内部大量节点之间相互连接的关系,从而达到处理信息的目的[6]。BP神经网络分为四个过程:模式顺传播过程、误差逆传播过程、记忆训练过程、学习收敛过程[7]。BP神经网络利用黑匣子原理使输入转化成输出,对非线性系统具有强大的处理能力[8],已广泛应用于生物原型研究、理论模型研究、网络模型与算法研究及人工神经网络应用系统研究中。在牡蛎酶解α-葡萄糖苷酶抑制剂活性方面,未见有关于BP神经网络的研究。
针对不足,本研究以牡蛎为研究对象,采用生物酶法制得活性肽,以α-葡萄糖苷酶抑制率为指标,采用BP神经网络对酶解过程进行模拟以及预测,从而研究得出较优的酶解牡蛎工艺参数,获得活性肽的制备工艺,以期为其工业化生产利用提供基础性数据。
1 材料与方法
1.1 材料与仪器
牡蛎 购于山东乳山;动物蛋白水解酶(120000 U/g)、中性蛋白酶(230000 U/g)、木瓜蛋白酶(800000 U/g)、菠萝蛋白酶(100000 U/g)、胰酶(2000 U/g)、胃蛋白酶(10000 U/g) 南宁庞博生物工程有限公司;α-葡萄糖苷酶、对硝基苯基吡喃葡萄糖苷 美国Sigma公司。
HH·S21-4-S型恒温水浴锅 上海新苗医疗器械制造有限公司;722N型可见分光光度计 上海仪电分析仪器有限公司;L5S型紫外可见分光光度计 上海元析仪器有限公司;XW-80A型旋涡混合器 德国IKA公司。
1.2 实验方法
1.2.1 酶解过程 将牡蛎去壳、洗净匀浆后,加水混匀,加酶后在恒温水浴锅中酶解,0、1、2、3、4、5 h分别取适量酶解液灭活终止反应[9]。10000 r/min离心5 min后取上清液,测定取样的酶解产物的水解度和α-葡萄糖苷酶抑制率。
1.2.2 水解度测定 采用Lowry法[10],取样品于试管中,每支试管加Folin-酚甲液5 mL,室温下反应10 min,加入Folin-酚乙液,反应30 min,于650 nm测定吸光值,根据标准曲线计算蛋白含量。
其中水解度(W)测定根据式(1):
W(%)=mi/m0×100
式(1)
式中,mi为根据标曲计算的加入15%三氯乙酸的蛋白质量,m0为根据凯氏定氮法测定的酶解液中的总蛋白质量。
1.2.3α-葡萄糖苷酶抑制率测定 采用改进的Shelly Hogan[11]方法,320 μL样品中加入80 μL的α-葡萄糖苷酶溶液,再加入400 μL 4 mmol/L的对硝基苯基吡喃葡萄糖苷溶液。开始反应,每1 min于405 nm下测定吸光值,每个样品连续测5 min取平均值,以不加α-葡萄糖苷酶所得到的体系调零,以水作为对照。
其中α-葡萄糖苷酶抑制率(A)测定根据式(2):
A(%)=[(A0-Ai)/A0]×100
式(2)
式中,A0为对照在405 nm下吸光值的平均值,Ai为样品在405 nm下吸光值的平均值。
1.2.4 单因素实验
1.2.4.1 蛋白酶对α-葡萄糖苷酶抑制活性的影响 在酶最适pH,底物浓度为0.25 g/mL,加酶量为600 U/g,酶解温度为55 ℃,酶解时间为5 h的条件下,考察木瓜蛋白酶、菠萝蛋白酶、胰酶、中性蛋白酶和动物蛋白水解酶等不同蛋白酶对α-葡萄糖苷酶抑制剂活性的影响。并根据酶解活性较好的两种酶进行复配以增加蛋白酶协同性提高牡蛎酶解活性肽活性。
1.2.4.2 底物浓度对α-葡萄糖苷酶抑制活性的影响 选取中性蛋白酶酶解,考察0.167、0.2、0.25、0.33、0.5 g/mL不同底物浓度对α-葡萄糖苷酶抑制剂活性的影响,其它酶解条件同1.2.4.1。
1.2.4.3 加酶量对α-葡萄糖苷酶抑制活性的影响 选取中性蛋白酶酶解,考察300、400、500、600、700 U/g对α-葡萄糖苷酶抑制剂活性的影响,其它酶解条件同1.2.4.1。
1.2.4.4 酶解温度对α-葡萄糖苷酶抑制活性的影响 选取中性蛋白酶酶解,考察40、55、70 ℃不同温度对α-葡萄糖苷酶抑制剂活性的影响,其它酶解条件同1.2.4.1。
1.2.4.5 酶解时间对α-葡萄糖苷酶抑制活性的影响 选取中性蛋白酶酶解,考察1、2、3、4、5 h不同酶解时间对α-葡萄糖苷酶抑制剂活性的影响,其它酶解条件同1.2.4.1。
1.2.5 酶解均匀设计实验 单因素的预实验表明,温度、加酶量和底物浓度三者对酶解过程影响较大,因此选取此三因素三水平进行均匀设计。均匀设计表如表1,在酶解0、1、2、3、4、5 h取样,测得各组的水解度以及α-葡萄糖苷酶抑制率。

表1 均匀设计表
1.2.6 神经网络设计 BP神经网络的设计通过美国MathWorks公司的MATLAB来实现。BP神经网络是一种多层前馈神经网络,由输入层、隐含层和输出层组成[12]。利用BP神经网络对酶解非线性过程进行拟合。神经网络设计的实验样本为随机选取的均匀设计32组数据,酶解温度、加酶量、底物浓度、酶解时间4个元素为输入神经元,输出神经元为α-葡萄糖苷酶的抑制率。隐含层神经元个数计算是按式(3)计算范围,用试凑法确定最佳的节点数。
式(3)
式中,n为输入层节点数,l为隐含层节点数,m为输出层节点数,a为0~10之间的常数。
设训练样本的最大训练次数为100次,网络学习速率为0.1,目标训练均方差为0.0001。建立的神经网络结构图如图1所示[13]。

图1 神经网络结构图Fig.1 The structure of neural network
1.2.7 神经网络的预测 以均匀设计的后4组实验对训练好的神经网络进行验证,其α-葡萄糖苷酶抑制剂活性预测值与实验值的相对误差,以检验神经网络预测的准确性和稳定性。单因素实验表明,影响酶解的因素主要有酶解时间、酶解温度、加酶量、底物浓度,其中底物浓度对酶解影响较小。固定底物浓度为0.25 g/mL,改变其它三个因素,考察酶解温度与加酶量的交互作用对α-葡萄糖苷酶抑制率的影响,以及酶解时间与加酶量的交互作用对抑制率的影响。在此基础上预测最优牡蛎酶解参数。
1.3 数据统计
分析所得数据均通过三次平行实验得到,用 SPSS计算平行实验之间的标准偏差以及单因素实验的显著性差异比较,利用MATLAB建立BP神经网络模型,调试和训练函数,隐含层神经元个数等优化网络结构,并进行数据处理分析和作图。
2 结果与讨论
2.1 蛋白酶对α-葡萄糖苷酶抑制活性的影响
不同蛋白酶对α-葡萄糖苷酶抑制剂活性的影响如图2所示。中性蛋白酶酶解后得到的活性肽其α-葡萄糖苷酶抑制剂活性最高。中性蛋白酶和动物水解蛋白酶没有显著性差异,但显著高于木瓜蛋白酶、菠萝蛋白酶和胰酶(p<0.05)。蛋白酶是催化水解蛋白质肽键水解的一类酶的总称,有内肽酶和外肽酶两类,两种蛋白酶共同作用可以促进蛋白质的水解[14]。因此将活性较高的中性蛋白酶和动物蛋白水解酶两种蛋白酶进行复配实验来探究这两种酶是否具有协同促进作用,是否能促进牡蛎酶解产生活性肽。在保持总加酶量为600 U/g的条件下,分别将中性蛋白酶与动物蛋白水解酶以2∶1、1∶1、1∶2的复配比进行复配[15]。复配结果如图3所示。
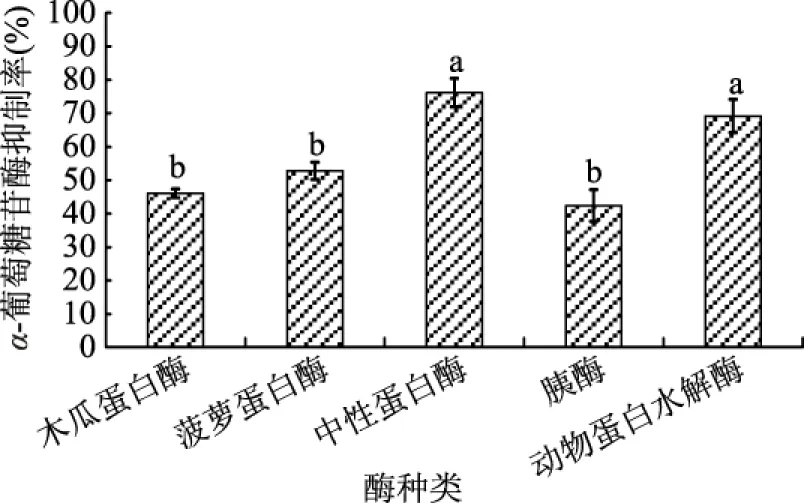
图2 不同蛋白酶处理的酶解产物的α-葡萄糖苷酶抑制率Fig.2 Effects of different enzymes on the α-glycosidase enzyme inhibition rate of enzymatic hydrolysate注:不同字母表示数据间有显著性差异(p<0.05),图3~图7同。

图3 中性蛋白酶与动物蛋白水解酶不同复配比酶解产物的α-葡萄糖苷酶抑制率Fig.3 Effects of different compound ratio of neutral protease and animal proteinenzymes on the α-glycosidase enzyme inhibition rate
从图2和图3中可以看出,两种酶进行复配后α-葡萄糖苷酶抑制率活性比单一种酶处理酶解产物的活性更高。这表明两种酶共同作用促进了彼此的水解作用,使蛋白质水解更加充分,产生了更多的活性肽。并且从图3中得出,复配比为2∶1时α-葡萄糖苷酶抑制剂活性与复配比为1∶1没有显著性差异,但显著高于复配比1∶2(p<0.05)。因此选择复配比为2∶1的中性蛋白酶与动物蛋白水解酶酶解牡蛎。
2.2 底物浓度对α-葡萄糖苷酶抑制活性的影响
不同底物浓度对α-葡萄糖苷酶抑制剂活性的影响如图4所示。底物浓度为0.25 g/mL时,α-葡萄糖苷酶抑制剂活性与底物浓度为0.20、0.33 g/mL没有显著性,但显著高于底物浓度为0.10、0.50 g/mL(p<0.05)。说明浓度过高或者过低都不利于牡蛎蛋白的水解。并且,从图4中也可以得知,不同底物浓度对牡蛎酶解活性肽的α-葡萄糖苷酶抑制剂活性影响较大,随底物浓度的增加,牡蛎酶解活性肽α-葡萄糖苷酶抑制剂活性呈先升高后下降的趋势。因此,0.25 g/mL为最适底物浓度。
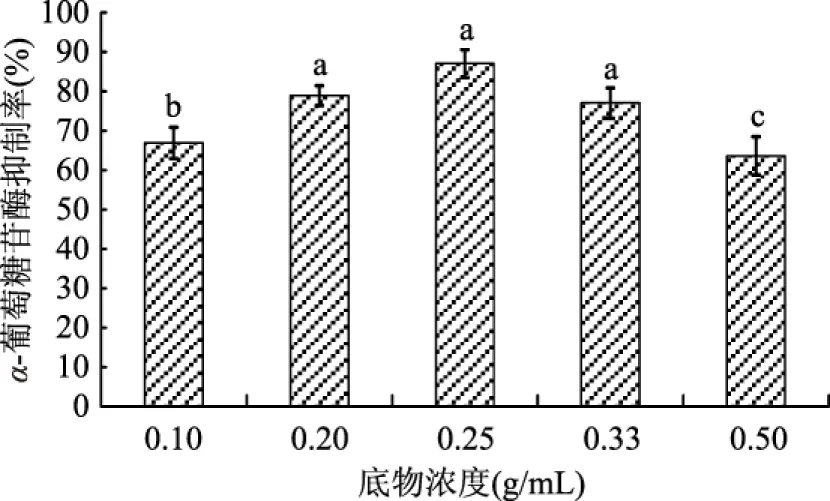
图4 不同底物浓度处理的酶解产物的α-葡萄糖苷酶抑制率Fig.4 Effects of different substrate concentration on the α-glycosidase enzyme inhibition rate of enzymatic hydrolysate
2.3 加酶量对α-葡萄糖苷酶抑制活性的影响
不同加酶量对α-葡萄糖苷酶抑制剂活性的影响如图5所示。加酶量为600 U/g时,α-葡萄糖苷酶抑制剂活性与加酶量为500、700 U/g没有显著性差异,但显著高于加酶量为300、400 U/g(p<0.05)。并且,从图5中也可以得知,不同加酶量对牡蛎酶解活性肽的α-葡萄糖苷酶抑制剂活性影响较大,随加酶量的增加,牡蛎酶解活性肽α-葡萄糖苷酶抑制剂活性呈稳定升高趋势,并趋于平稳。因此,600 U/g为最适加酶量。
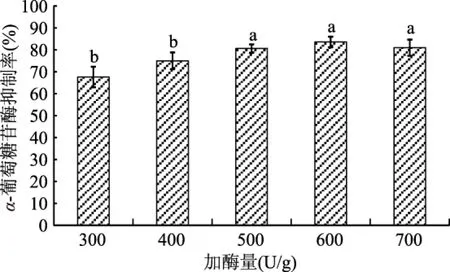
图5 不同加酶量处理的酶解产物的α-葡萄糖苷酶抑制率Fig.5 Effects of different enzyme amount on the α-glycosidase enzyme inhibition rate of enzymatic hydrolysate
2.4 酶解温度对α-葡萄糖苷酶抑制活性的影响
不同酶解温度对α-葡萄糖苷酶抑制剂活性的影响如图6所示。酶解温度为55 ℃时,α-葡萄糖苷酶抑制剂活性显著高于酶解温度为40、70 ℃时酶解产物活性(p<0.05)。并且,从图6中也可以得知,不同酶解温度对牡蛎酶解活性肽的α-葡萄糖苷酶抑制剂活性影响较大,随酶解温度的升高,牡蛎酶解活性肽α-葡萄糖苷酶抑制剂活性呈先升高后下降的趋势。因此,55 ℃为最适酶解温度。

图6 不同酶解温度处理的酶解产物的α-葡萄糖苷酶抑制率Fig.6 Effects of different enzymolysis temperature on the α-glycosidase enzyme inhibition rate of enzymatic hydrolysate
2.5 酶解时间对α-葡萄糖苷酶抑制活性的影响
不同酶解时间对α-葡萄糖苷酶抑制剂活性的影响如图7所示。不同酶解时间对牡蛎酶解活性肽的α-葡萄糖苷酶抑制剂活性影响较大,随加酶量的增加,牡蛎酶解活性肽α-葡萄糖苷酶抑制剂活性显著增加。酶解5 h时,α-葡萄糖苷酶抑制剂活性与3、4 h没有显著性差异,但显著高于1、2 h。因此,5 h为最适酶解时间。

图7 不同酶解时间处理的酶解产物的α-葡萄糖苷酶抑制率Fig.7 Effects of different enzymolysis time on the α-glycosidase enzyme inhibition rate of enzymatic hydrolysate
2.6 神经网络的建立
神经网络的学习样本来自于随机选取的均匀设计32组数据,具体如表2所示。神经网络设立隐含层个数为10个时,神经网络拟合效果较好且稳定。另外,神经网络训练后误差的变化过程如图8所示,该网络训练较快,运行25步后神经网络输出误差就可以达到设定的训练精度。该模型的相关系数可达到0.999,说明该模型拟合良好,基本可以稳定,达到0.0001的训练均方差目标。另外,神经网络方针输出值和目标值相关性好,预测值与实验值基本拟合良好,说明此神经网络已建立并且拟合良好。综合分析可知,神经网络具有较好的逼近能力。

图8 神经网络数据训练图Fig.8 Neural network data training plot
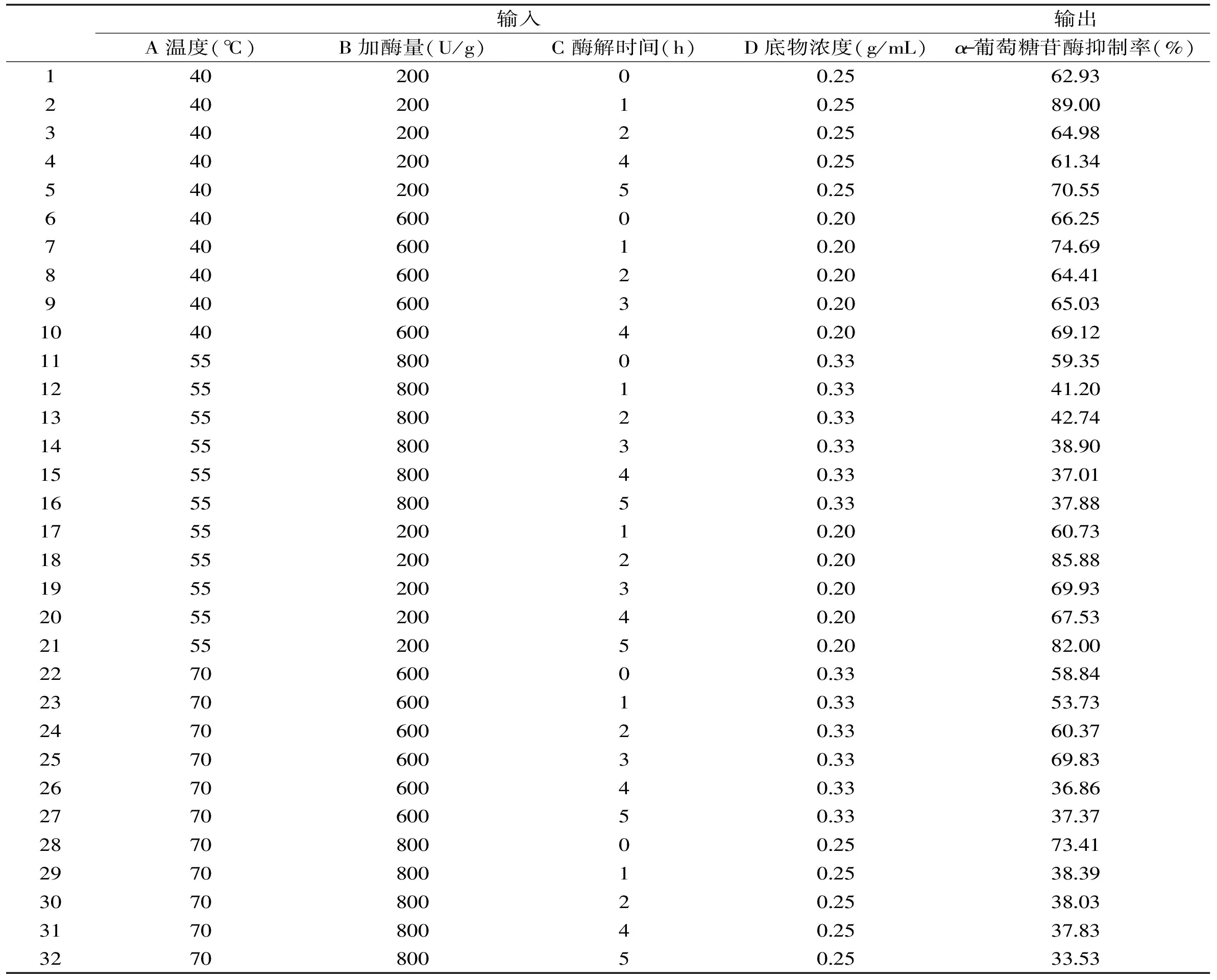
表2 神经网络学习样本

表3 神经网络预测误差
2.7 神经网络的验证
根据前面实验选取的学习样本建立和训练神经网络,并利用剩下的4组实验数据验证神经网络的准确性和稳定性,结果如表3所示,结果表明该模型预测的误差都小于1%,说明该模型拟合程度较好,因此此神经网络模型已建立并训练好,具有较好的准确性和稳定性。
2.8 神经网络的预测
利用训练好的神经网络模型对酶解过程进行仿真预测。结果如图9、图10所示。由图9可知,加酶量较少时,酶解产物的α-葡萄糖苷酶抑制率随酶解时间的增大而增大;加酶量较多时,酶解1 h时产物的α-葡萄糖苷酶抑制率活性达到最大,1 h以后则稍有降低。从图10中可以看出,在各个不同的温度,随酶解时间的增加,产物的α-葡萄糖苷酶抑制率活性呈下降趋势。因此,加酶量与酶解时间、温度与加酶量之间都有较大的交互作用,都对酶解具有较大的影响。从图9和图10中可以看出,酶解温度为55 ℃,酶解时间为1 h,加酶量为600 U/g,底物浓度为0.25 g/mL时,酶解产物的α-葡萄糖苷酶抑制率最大为89.22%。
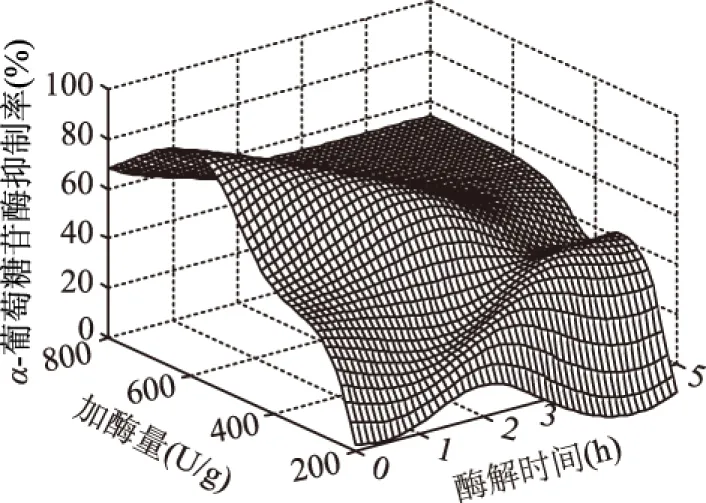
图9 神经网络预测加酶量与酶解时间对α-葡萄糖苷酶抑制率的影响Fig.9 The surface curve of the combined effect of enzyme,time-enzyme on the stopping ability on α-glycosidase enzyme inhibition rate
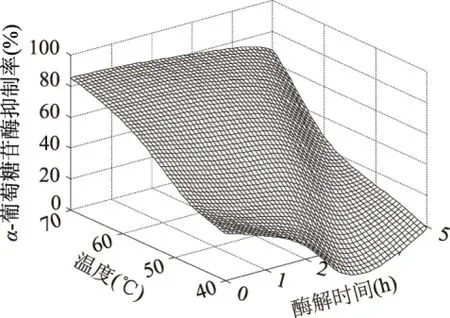
图10 神经网络预测温度与加酶量对α-葡萄糖苷酶抑制率的影响Fig.10 The surface curve of the combined effect of temperature,enzyme on the stopping ability on α-glycosidase enzyme inhibition rate
神经网络可以有效处理非线性问题,许多研究者进行过基于神经网络基础上的水产蛋白相关的研究。李琳等[5]研究了利用神经网络制备鳙鱼抗氧化肽,证明人工神经网络以其处理非线性问题的优越性可成为优化酶解过程的方便工具。张超等[16]研究了基于神经网络的鱼皮胶原蛋白制备工艺条件优化,证明通过神经网络与遗传算法寻优可较为方便地找到工艺中的较优条件。在牡蛎酶解方面,本文则针对于牡蛎酶解的α-葡萄糖苷酶抑制剂活性,通过神经网络拟合的方法,对酶解工艺参数进行了优化,并对酶解过程进行了较好的模拟。相比传统的回归分析,通过神经网络作图,可以更为直观的看到两个因素之间的交互作用。其拟合性更好,具有很好的逼近能力,能够反映因素之间的交互作用,并达到最优工艺参数优化和预测的目的。本文也为今后牡蛎的进一步开发利用和工艺参数优化提供方法依据。
3 结论
本实验选取了新鲜牡蛎为原料,用动物水解蛋白酶和中性蛋白酶进行酶解,并通过神经网络优化酶解工艺参数。得出酶解温度为55 ℃,酶解时间为1 h,加酶量为600 U/g,底物浓度为0.25 g/mL时,酶解产物的α-葡萄糖苷酶抑制率最大为89.22%。利用人工神经网络对牡蛎酶解过程进行了较好的模拟和仿真,证实了神经网络对非线性过程具有强大的处理能力,可对今后酶解最优工艺参数提供新思路和理论指导。
[1]顾觉奋,陈紫娟.α-葡萄糖苷酶抑制剂的研究及应用[J].药学进展,2009,33:62-67.
[2]朱运平,李秀婷,李里特.天然葡萄糖苷酶抑制剂来源及应用研究现状[J].中国食品学报,2011,11(4):154-159.
[3]滕瑜,王彩理.牡蛎的营养和降糖作用研究[J].海洋水产学院,2005,26(6):39-44.
[4]李会丽,黄文芊,王甜甜,等.牡蛎蛋白酶解液对α-葡萄糖苷酶的抑制作用研究[J].农产品加工·学刊,2012(11):59-60.
[5]李琳,赵谋明,李黎.利用人工神经网络优化制备鳙鱼抗氧化肽[J].四川大学学报,2006,38(1):80-85.
[6]吉建娇,张姣姣,许婕,等.人工神经网络——控制系统不依赖于模型的故障诊断方法[J].科技风,2009(13):150.
[7]贾琨钰.用于前馈神经网络的一种反向传播算法的改进[D].大连:大连理工大学,2010.
[8]王志有,于洪梅,李井会,等. BP人工神经网络紫外分光光度法同时测定三种氨基酸[J].生物数学学报,2005,20(2):240-244.
[9]刘盟梦,李银平,延海莹,等.基于BP神经网络的牡蛎抗氧化活性肽制备工艺优化[J].食品工业科技,2016(20):206-210,215.
[10]Lowry O H,Rosebrough N J,Farr A L,et al. Protein measurement with the Folin phenol reagent[J].J Biol Chem,1951,193(1):265-275.
[11]Hogan S,Zhang L,Li J,et al.Antioxidant rich grape pomace extract suppresses postpr-andial hyperglycemia in diabetic mice by specifically inhibiting alpha-glucosidase[J].Nutrition & Metabolism,2009,7(1):1-9.
[12]邹修明,孙怀江.反向传播神经网络的蛋白质质谱高通量分析方法研究(英文)[J].计算机与应用化学,2014,31(10):1153-1156.
[13]郑惠娜,周春霞,章超桦,等.基于人工神经网络的牡蛎蛋白酶解动力模型的构建[J].食品工业科技,2014,35(7):53-56.
[14]马特,宋连宝,赵辉,等.白酒窖泥中蛋白酶产生菌的筛选及复配[J].食品科学,2016(7):146-151.
[15]康俊杰,陈树俊,田津瑞,等.优质复配蛋白酶解工艺研究[J].山西农业科学,2015(7):892-896.
[16]张超,王飞飞,胡为民,等.基于MATLAB的鱼皮胶原蛋白制备工艺条件优化研究[J].中国酿造,2012,31(8):96-98.
Optimization of enzymatic processing forα-glucosidase inhibitor active peptides from oyster based on BP neural network
YAN Hai-ying,LIU Meng-meng,ZUO Si-qi,LI Xian-yu,WANG Peng*
(College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
In order to obtain active peptides with good activity ofα-glucosidase inhibition,oyster was used as raw material,and neutral protease and animal proteolytic enzyme were selected for enzymolysis. The inhibition rate of oyster peptidesα-glucosidase was used as index to design the uniform design experiment. Results showed that the temperature of enzymolysis,the amount of enzyme and the concentration of substrate were correlated with the inhibitory rate ofα-glucosidase. The three formers were used as inputs to the BP neural network and the latter was used as the output to develop neural network. The process of oyster enzymatic hydrolysis was simulated and the activity of oyster peptides was predicted. The optimal enzymolysis parameters were obtained. The results showed that the maximum inhibition rate ofα-glucosidase was 89.22% when the enzymolysis temperature was 55 ℃,the enzymolysis time was 5 h,the enzyme concentration was 600 U/g,the substrate concentration was 0.25 g/mL. Therefore,BP neural network can be used to simulate the non-linear process of oyster enzymolysis,and theα-glucosidase inhibition rate of the hydrolyzate can be well predicted,which is favorable for the industrial production of oyster enzymatic peptides.
oyster;active peptide;neural network;α-glycosidase enzyme inhibition rate
2016-12-08
延海莹(1993-),女,硕士,研究方向:水产品加工与利用,E-mail:214685496@qq.com。
*通讯作者:王鹏(1980-),男,副教授,研究方向:海洋应用微生物,E-mail:pengwang@ouc.edu.cn。
山东省重点研发计划(2015GSF115038);青岛市民生科技计划项目(16-4-2-5-nsh)。
TS254.1
B
1002-0306(2017)09-0206-06
10.13386/j.issn1002-0306.2017.09.031

