选择性单胚胎移植临床结局和可行性分析*
周立花,符免艾,李 娟
(海南省农垦总医院生殖科,海口 570311)
选择性单胚胎移植临床结局和可行性分析*
周立花,符免艾,李 娟△
(海南省农垦总医院生殖科,海口 570311)
目的 探讨行选择性单胚胎移植(eSET)的临床结局及可行性。方法 回顾性分析2014年8月至2015年10月在该院生殖科进行体外受精-胚胎移植(IVF-ET)治疗的患者资料,选择行选择性移植1枚优质胚胎106个周期为eSET组,其中获卵数大于15个为高反应组(高度OHSS风险,46个周期),获卵数5~15个为正常反应组(60个周期)。移植2枚胚胎(至少1枚为优质胚胎)的106个周期为双胚胎移植组(DET)组。比较组间一般情况、促排情况、胚胎发育情况及临床妊娠率、种植率、多胎率和早期流产率。结果 eSET组Gn量和双胎妊娠率低于DET组,注射人绒毛膜促性腺激素(HCG)日雌激素(E2)水平、获卵数、优质胚胎数和种植率均高于DET组,比较差异有统计学意义(P<0.05)。高反应组注射HCG日E2水平高于正常反应组,比较差异有统计学意义(P<0.05)。结论 eSET与DET有相似的妊娠率,但能明显降低双胎妊娠率,对于特定人群应该坚持行eSET。
促性腺素类;分裂期,卵;胚胎移植;妊娠率选择性单胚胎移植;双胎妊娠率;早期流产率
近年来,随着体外受精-胚胎移植(IVF-ET)体外培养和操作技术日趋成熟,双胎妊娠率也随之增加[1]。而双胎妊娠属高危妊娠,母亲产前、产后并发症率显著增加,早产新生儿增加,易并发呼吸器官发育异常、脑瘫和肺炎等[2]。如何有效避免双胎妊娠同时维持总体妊娠率一直是辅助生殖治疗中面临的重要挑战之一。目前,研究认为减少多胎妊娠最有效的措施就是进行选择性单胚胎移植(eSET)。虽然在我国卫生部法规允许移植2~3枚胚胎,但为了减少多胎妊娠率,降低妊娠风险,2014年开始本院生殖科开始对下列人群开始实行eSET。(1)卵巢高反应患者(获卵数大于15个):卵巢过度刺激综合征(OHSS)高度风险,根据情况,如可移植,无论胚胎质量,均移植1枚胚胎。(2)卵巢正常反应患者:以下3种情况仍建议eSET。 ①剖宫产疤痕子宫患者,双胎妊娠使孕晚期及产程中子宫破裂风险增加,第1、2次IVF助孕,无论胚胎质量,均建议移植1枚胚胎。②年龄小于35岁,首次IVF助孕,胚胎优良,内膜好,建议移植1枚胚胎。③患者身高小于150 cm,体格瘦小,首次IVF助孕,建议移植1枚胚胎。本研究回顾分析本科2014年8月至2015年10月IVF-ET治疗中eSET的临床结局,观察eSET的可行性,以期为临床提供理论依据。
1 资料与方法
1.1 一般资料 选择2014年8月至2015年10月本科接受IVF-ET治疗的eSET的106个周期为eSET组,女方年龄小于38岁,取卵后第3天选择性移植1枚优质胚胎(卵裂球数目7~9个,根据胚胎评分为Ⅰ~Ⅱ级),多余胚胎冻存。其中获卵数大于15个为高反应组(高度OHSS风险,46个周期),获卵数5~15个为正常反应组(60个周期)。选择同一时期年龄小于38岁,移植2枚胚胎(至少1枚为优质胚胎)的106个周期为双胚胎移植组(DET组)。本研究通过本院伦理委员会批准,所有患者均知情同意。
1.2 方法
1.2.1 控制性超促排卵方案 月经黄体中期开始应用长效促性腺激素(Gn)释放激素类似物(达菲林)降调节。达到降调节标准后,应用促性腺激素进行促排卵。按B超检测结果和血浆内分泌激素水平调整Gn的用量。当1个卵泡平均直径大于18 mm,或3个卵泡平均直径大于17 mm时给予人绒毛膜促性腺激素(HCG)注射,36~37 h取卵。根据精子质量、既往妊娠史,不孕年限等因素综合考虑,选择行IVF、IVF+卵细胞浆单精子显微注射(ICSI)或直接ICSI受精,取卵后第3天移植胚胎。
1.2.2 胚胎评分 胚胎卵裂期评分标准根据取卵后胚胎形态和碎片多少,将胚胎分为4级,标准如下。Ⅰ级:细胞大小均匀,形态规则,透明带完整,胞质清晰,无颗粒现象,碎片小于5%卵裂球面积;Ⅱ级:细胞大小略不均,形态略不规则,胞质可有颗粒现象,碎片10%~20%;Ⅲ级:细胞大小明显不均,有明显的形态不规则,胞质有颗粒现象,碎片大于20%~50%;Ⅳ级:细胞大小严重不均,胞质有严重的颗粒现象,碎片大于50%。若胚胎发育速度过慢或过快,即第2天小于3个卵裂球或大于或等于6个细胞,第3天小于6个细胞或大于或等于10个细胞,则卵裂期胚胎评分降级。本研究将第3天卵裂球数目7~9个及评分Ⅰ~Ⅱ级胚胎作为优质胚胎。
1.2.3 胚胎移植与结局 对高反应患者,根据患者腹胀、腹痛等症状,B超显示卵巢体积、腹腔积液量及血常规结果,如患者夫妇拒绝取消周期者,与患者沟通,移植1枚胚胎。对疤痕子宫、身高小于15.0 cm或年龄小于35岁且胚胎质量和子宫内膜均好者移植1枚胚胎。移植后14 d采血,HCG大于25 mIU/mL考虑生化妊娠,移植后28 d阴道B超见孕囊为临床妊娠。孕3个月内流产为早期流产。
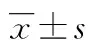
2 结 果
2.1 eSET组与DET组比较 两组的女方年龄、不孕年限、BMI比较差异均无统计学意义(P>0.05)。eSET组Gn量低于DET组,注射HCG日雌激素(E2)水平高于DET组,获卵数,优质胚胎数和种植率均高于DET组,比较差异有统计学意义(P<0.05)。两组妊娠率与早期流产率比较差异均无统计学意义(P>0.05),但eSET组双胎妊娠率明显低于DET组,比较差异有统计学意义(P<0.05),见表1。

表1 eSET组与DET组基本资料与临床结局比较

表2 eSET卵巢高反应组与正常反应组基本资料与临床结局比较

续表2 eSET卵巢高反应组与正常反应组基本资料与临床结局比较
2.2 卵巢高反应组与正常反应组比较 两组间女方年龄、不孕年限、BMI、Gn用量、ET日子宫内膜厚度比较差异均无统计学意义(P>0.05)。高反应组注射HCG日E2水平高于正常反应组,比较差异有统计学意义(P<0.05);两组的种植率、妊娠率和早期流产率之间比较差异均无统计学意义(P>0.05),见表2。
3 讨 论
为了降低辅助生殖技术中的双胎妊娠率,20世纪初欧洲开始倡导行eSET。虽然每个国家和地区eSET比率差别比较大,但均成增长趋势。美国2010年eSET占所有鲜胚移植周期的5.6%,是2004年的8倍[3],日本的eSET比率从2007年的49.9%升至2010年的73.0%,多胎妊娠率由3.0%降至1.3%[4]。我国虽然目前还遵守2001年的卫生部规范:对35岁以下,首次ART的患者实行双胚胎移植。但是很多生殖中心已经开始尝试eSET了。国内外多个研究报道,与多胚胎移植比较,eSET不仅能获得稳定的临床妊娠率,而且能明显降低多胎妊娠的风险,有更好的妊娠结局[3-5]。本研究中,由于eSET组大部分为卵巢高反应或年龄小于35岁,促排卵过程顺利,子宫内膜和胚胎质量均佳的患者,获卵数、优质胚胎数及种植率均高于DET组,两组有相似临床妊娠率,但eSET双胎妊娠率明显低于DET组。
虽然单胚胎移植可以减少双胎妊娠,但是可以造成单卵双胎的增加,甚至可以出现单卵3胎、单卵4胎[4-6]。而单绒毛膜单卵双胎比双卵双胎妊娠风险更大,如双胎输血综合征、连体畸形、先天发育缺陷、双胎之一死亡等[7]。本研究106个eSET周期中出现了2个单卵双胎的妊娠,比率为1.8%(2/106),而自然人群中单卵双胎的发生率0.40%~0.45%,本结果证实ART有增加单卵双胎的可能性。既往的研究推测单卵双胎增加的可能是由于囊胚移植或对透明带进行操作[7-8]。透明带不适宜的溶解缺口容易导致囊胚的嵌顿,任何影响透明带缺口的操作,如单精子卵细胞质内注射(ICSI),辅助孵化,胚胎植入前遗传学诊断(PGD),都有可能增加单卵双胎的可能。体外培养时间的延长导致透明带变硬,内细胞团更容易嵌顿,因此囊胚移植增加单卵双胎的可能。也有学者不同意此观点,有Meta分析认为囊胚移植并不比卵裂期胚胎移植增加单卵双胎风险[8]。本研究两个单卵双胎妊娠周期均为卵裂期胚胎移植,且均为IVF受精,未行透明带操作,与上述两个原因无明显关系。
本科行eSET周期中很大比例是由于患者在控制性超排卵中出现卵巢高反应(46/106),取卵较多,患者有OHSS风险。虽然预防OHSS最根本的方法是全胚冷冻,择期行解冻胚胎移植(FET)。但是当患者夫妇不愿意取消周期,在条件允许的情况下,一般选择eSET。曾有文献报道,高反应患者中如果HCG日E2水平大于3 000 pg/mL,就会影响子宫内膜容受性,影响胚胎种植,降低成功率[9]。Wu等[10]研究认为对于卵巢正常反应的患者,eSET是减少多胎妊娠率并能维持整体临床妊娠率的最佳选择,但是对于高反应患者,FET比eSET鲜胚移植有更高的妊娠率。本研究中,高反应组HCG日E2水平明显高于正常反应组,且平均值大于3 000 pg/mL,种植率和妊娠率低于正常反应组,虽然无统计学意义,但是有可能过高的E造成了子宫内膜容受性下降,还需要后续大样本的研究。
要提高eSET的成功率,选择1个高种植潜能的胚胎是关键。本科选择卵裂球数目为7~9个细胞,碎片较少的优质胚胎进行移植。但是单从形态学选择胚胎是不够的。多研究证明,囊胚导致部分染色体异常且质量差的胚胎在体外发生了自然淘汰,有更高的种植潜能,因此单囊胚移植比单卵裂期胚胎有更高的妊娠率[11]。但即使形态学正常的优质囊胚,22%(CI15%~31%)的为非整倍体[12]。Wathlet等[13]发现通过qPCR测定与卵母细胞接近的卵丘细胞的基因表达可以推测胚胎的发育潜能。通过微阵列分析,计算全息,qPCR等方法可以检测胚胎的整倍体性[14-15]。通过囊胚移植和植入前胚胎非整倍体检测来提高eSET成功率的是未来的工作目标。
本研究证实与双胚胎移植相比,对特定人群行eSET不会降低临床妊娠率,并且能显著降低双胎妊娠率。因此在以后的工作中,对于OHSS高风险,疤痕子宫,身高小于150 cm,年龄小于35岁,首次IVF助孕,胚胎优良,内膜好的患者要坚持行eSET,降低母婴妊娠风险,实现一对不孕夫妇获得1个足月、健康婴儿的生殖目标。
[1]Kulkarni AD,Jamieson DJ,Jones HW,et al.Fertility treatments and multiple births in the United States[J].N Engl J Med,2013,370(11):1070-1071.
[2]Morin S,Melzer-Ross K,McCulloh D,et al.A greater number of euploid blastocysts in a given cohort predicts excellent outcomes in single embryo transfer cycles[J].J Assist Reprod Genet,2014,31(6):667-673.
[3]Steinberg ML,Boulet S,Kissin D,et al.Elective single embryo transfer trends and predictors of a good perinatal outcome-United States,1999 to 2010[J].Fertil Steril,2013,99(7):1937-1943.
[4]Takehara I,Takahashi T,Hara S,et al.Dizygotic twin pregnancy after single embryo transfer:a case report and review of the literature[J].J Assist Reprod Genet,2014,31(4):443-446.
[5]Bensdorp AJ,Tjon-Kon-Fat RI,Bossuyt PM,et al.Prevention of multiple pregnancies in couples with unexplained or mild male subfertility:randomised controlled trial of in vitro fertilisation with single embryo transfer or in vitro fertilisation in modified natural cycle compared with intrauterine insemination with controlled ovarian hyperstimulation[J].BMJ,2015(350):g7771.
[6]Saravelos SH,Zhang T,Chung JP,et al.Monochorionic quadramniotic and triamniotic pregnancies following single embryo transfers:two case reports and a review of the literature [J].Assist Reprod Genet,2016,33(1):27-32.
[7]Kanter JR,Boulet SL,Kawwass JF,et al.Trends and correlates of monozygotic twinning after single embryo transfer[J].Obstet Gynecol,2015,125(1):111-117.
[8]Chang HJ,Lee JR,Jee BC,et al.Impact of blastocyst transfer on offspring sex ratio and the monozygotic twinning rate:a systematic review and meta-analysis[J].Fertil Steril,2009,91(6):2381-2390.
[9]Simón C,Garcia Velasco JJ,Valbuena D,et al.Increasing uterine receptivity by decreasing estradiol levels during the preimplantation period in high responders with the use of a follicle-stimulating hormone step-down regimen[J].Fertil Steril,1998,70(2):234-239.
[10]Wu KL,Zhao HB,Liu H,et al.Elective single blastocyst transfer is more suitable for normal responders than for high responders[J].Chin Med J (Engl),2013,126(11):2125-2128.
[11]Papanikolaou E,Kolibianakis E,Tournaye H,et al.Live birth rates after transfer of equal number of blastocysts or cleavage-stage embryos in IVF.A systematic review and meta analysis[J].Hum Reprod,2008,23(1):91-99.
[12]Forman EJ,Upham KM,Cheng M,et al.Comprehensive chromosome screening alters traditional morphology-based embryo selection:a prospective study of 100 consecutive cycles of planned fresh euploid blastocyst transfer[J].Fertil Steril,2013,100(3):718-724.
[13]Wathlet S,Adriaenssens T,Segers I,et al.Pregnancy prediction in single embryo transfer cycles after ICSI using QPCR:validation in oocytes from the same cohort[J].PLoS One,2013,8(4):e54226.
[14]Forman EJ,Hong KH,Franasiak JM,et al.Obstetrical and neonatal outcomes from the BEST Trial:single embryo transfer with aneuploidy screening improves outcomes after in vitro fertilization without compromising delivery rates[J].Am J Obstet Gynecol,2014,210(2):157.
[15]Ubaldi FM,Capalbo A,Colamaria S,et al.Reduction of multiple pregnancies in the advanced maternal age population after implementation of an elective single embryo transfer policy coupled with enhanced embryo selection:pre- and post-intervention study[J].Hum Reprod,2015,30(9):2097-2106.
10.3969/j.issn.1671-8348.2017.15.033
海南省卫生厅课题(琼卫2013自筹-20)。 作者简介:周立花(1983-),主治医师,硕士,主要从事生殖临床方面研究。△
,E-mail:hainanjuanli@163.com。
R321
B
1671-8348(2017)15-2116-03
2016-11-03
2017-01-21)

