PiCCO监测在急性呼吸窘迫综合征患者中的临床应用*
杨国辉,刘 益
(贵阳医学院附属医院内科ICU,贵阳 550004)
·经验交流·
PiCCO监测在急性呼吸窘迫综合征患者中的临床应用*
杨国辉,刘 益
(贵阳医学院附属医院内科ICU,贵阳 550004)
目的 探讨脉搏指示连续心输出量(PiCCO)监测对急性呼吸窘迫综合征(ARDS)患者预后的预测价值,及其对ARDS液体管理的指导价值。方法 选择该院内科ICU ARDS患者38例,使用PiCCO监测仪监测所有患者第1、3、5天的肺血管通透性指数(PVPI)、血管外肺水(EVLW)、全心舒张末期容积指数(GEDVI)、胸腔内血容量指数(ITBVI)等血流动力学指标的变化及氧合指数(PaO2/FiO2),观察急性生理功能和慢性健康状况评分系统(APACHE)Ⅱ评分及患者预后,根据患者预后分为存活组及死亡组。比较EVLW、PVPI、GEDVI、ITBVI第1、3、5天的差异及其与PaO2/FiO2的关系。结果 (1)存活组ARDS患者PVPI和EVLW逐渐降低,PiCCO监测第5天PVPI、EVLW与第1天比较明显降低(P<0.05),而GEDVI和ITBVI逐渐升高,第5天GEDVI、ITBVI较第1天明显升高(P<0.05);(2)死亡组ARDS患者PVPI和EVLW逐渐升高,PiCCO监测第5天PVPI、EVLW与第1天比较明显升高(P<0.05),而GEDVI和ITBVI逐渐降低,第5天较第1天明显降低(P<0.05);(3)与存活组比较,死亡组在PiCCO监测第3、5天 PVPI和EVLW明显增高(P<0.05),而GEDVI和ITBVI明显降低(P<0.05),第1天时差异无统计学意义(P>0.05);(4)PiCCO监测第5天时存活组的PVPI、EVLW与PaO2/FiO2呈负相关(r=-0.743、-0.672,P<0.05);存活组的GEDVI、ITBVI与PaO2/FiO2呈正相关(r=0.632、0.724,P<0.05)。结论 EVLW及PVPI有助于ARDS预后判断;容量指标可更好地指导ARDS患者前负荷的评价;EVLW、GEDVI、ITBVI等容量指标可指导ARDS患者的液体管理。
呼吸窘迫综合征;成人;PiCCO监测技术;血流动力学
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是指由心源性以外的各种肺内、外因素导致的急性进行性呼吸衰竭。其病理生理改变主要表现为肺内容积减少、肺顺应性下降及严重通气/血流比失衡。临床表现为呼吸困难及顽固性的低氧血症,肺部影像学表现为非均一、渗出性改变。ARDS早期体征常无异常,胸部X线片、动脉血气分析、床旁肺功能监测、心脏超声缺乏特异性、敏感性。以往用Swan-Ganz导管测肺动脉楔压(pulmonary artery wedge pressure,PAWP)来反映左心房压力是较可靠的指标。而通过采用Swan-Ganz导管测定PAWP、CO、中心静脉压(central venous pressure,CVP)等指标后发现,通过用压力指标来评定血管容量和心脏前负荷情况,其检测结果往往容易受到胸腔内压力、血管壁顺应性等因素的影响,尤其在ARDS患者接受呼吸机正压通气情况下,常导致检测结果不能准确反映患者实际病情[1]。且Swan-Ganz导管对技术要求较高,创伤大,并发症多,操作也复杂。本研究旨在评价通过用脉搏指示连续心输出量(PiCCO)监测技术测得的肺血管通透性指数(pulmonary vascular permeability index,PVPI)、血管外肺水(extravascular lung water,EVLW)、全心舒张末期容积指数(global end-diastolic volume index,GEDVI)及胸腔内血容量指数(intrathoracic blood volume index,ITBVI)作为ARDS患者评估预后及指导液体管理指标的可行性。
1 资料与方法
1.1 一般资料 选取本院内科ICU 2013年2月至2014年3月用PiCCO技术监测ARDS的患者38例。其中男32例,女6例,年龄33~89岁,平均(61.3±28.2)岁;其中多发伤12例,重症肺炎9例,脑梗死6例,脓毒症6例,多器官衰竭5例,所有患者在治疗期间均给予机械通气,部分患者行连续性血液净化治疗(continuous renal replacement therapy,CRRT)。
1.2 入选标准 符合2012年提出的ARDS新的诊断标准柏林标准[2],且所有患者均无严重的基础心脏疾病及肺部疾病。
1.3 排除标准 (1)主动脉瘤、大动脉炎;(2)动脉狭窄、肢体有栓塞史;(3)肺叶切除、肺栓塞、胸内巨大占位性病变;(4)体外循环期间;(5)体温或血压短时间变化过大;(6)心功能不全,血浆脑利钠肽前体(brain natriuretic peptide,BNP)≥400 pg/mL;(7)严重心律失常;(8)严重气胸、心肺压缩性疾病、心腔肿瘤、心内分流、出血性疾病;(9)妊娠、存在股动脉置管的禁忌证,年龄小于18岁;(10)操作未得到患者或家属同意、不合作及终末期多脏器衰竭者;住院10 d内死亡、临床资料不全的患者。
1.4 分组及处理 根据患者接受PiCCO监测下治疗7 d内评价临床症状、体征、影像学改变及住院28 d的转归情况,分为(1)存活组:ARDS患者的临床症状、体征、X射线检查较入选时明显改善,氧合指数(PaO2/FiO2)≥300 mm Hg;(2)死亡组:ARDS患者的病情无明显好转,临床症状、体征、X射线检查无明显改善或无任何变化甚至恶化而最终死亡。
1.5 方法 所有患者入选时即进行持续生命体征监护,给予液体管理治疗,进行深静脉置管(锁骨下静脉或颈内静脉),经股动脉置入PiCCO导管,导管电极连接到带PiCCO模块的监护仪,深静脉监测中心静脉压端接PiCCO温度传感器,将带有温度感应的专用动脉导管放置其中。使用检测仪实时监测CVP、平均动脉压(mean arterial pressure,MAP),同时根据操作流程,每6小时使用0 ℃~8 ℃的0.9%氯化钠注射溶液15 mL经深静脉置管注射(10 s内注射完毕),通过经肺热稀释法测定心排量,每次连续测2次,取平均值,记录ITBVI、GEDVI、EVLW、PVPI。记录行PiCCO监测时的一般血流动力学情况(包括心率、CVP)以及PaO2/FiO2。持续评价PiCCO监测血流动力学参数,预测ARDS患者住院28 d内的转归(存活或死亡)、机械通气时间及入住ICU时间。
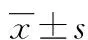
表1 ARDS患者不同时间点APACHEⅡ评分及PaO2/FiO2比较
a:P<0.05,与本组第1天比较;b:P<0.05,与本组第3天比较;c:P<0.05,与存活组同期比较。
表2 不同组别不同时间点ELWI、PVPI、GEDVI、ITBVI的测量结果
a:P<0.05,与本组第1天比较;b:P<0.05,与死亡组第3天、第5天比较。
2 结 果
2.1 患者的基本情况 存活组与死亡组患者年龄、性别、主要疾病分布等差异无统计学意义(P>0.05),有可比性。两组急性生理功能和慢性健康状况评分系统Ⅱ(APACHEⅡ)评分、PaO2/FiO2比较差异有统计学意义(P<0.05),见表1;所有患者接受抗生素治疗及机械通气治疗,存活组治疗时间为(12.8±3.6)d,死亡组(16.4±3.8)d。
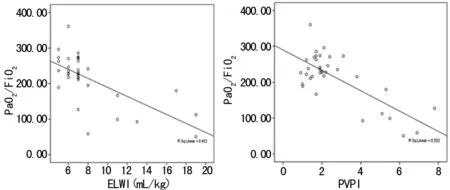
图1 第5天存活组患者ELWI、PVPI与PaO2/FiO2的相关性离散图

图2 第5天存活组患者GEDVI、ITBVI与PaO2/FiO2的相关性离散图
2.2 ELWI、PVPI、GEDVI、ITBVI的测量结果 存活组患者PVPI和EVLW逐渐降低,PiCCO监测第5天与第1天比较明显降低(P<0.05),而GEDVI和ITBVI逐渐升高,第5天较第1天明显升高(P<0.05);死亡组ARDS患者PVPI和EVLW逐渐升高,PiCCO监测第5天与第1天比较明显升高(P<0.05),而GEDVI和ITBVI逐渐降低,第5天较第1天明显降低(P<0.05);与存活组比较,死亡组在PiCCO监测第3、5天PVPI和EVLW明显升高(P<0.05),而GEDVI和ITBVI明显降低(P<0.05),第1天时差异无统计学意义(P>0.05),见表2。
2.3 ELWI、PVPI、GEDVI、ITBVI与PaO2/FiO2的相关性分析 存活组患者PiCCO监测第5天时PVPI、EVLW与PaO2/FiO2呈负相关(r=-0.743、-0.672,P<0.05),存活组患者的GEDVI、ITBVI与PaO2/FiO2呈正相关(r=0.632、0.724,P<0.05);而在PiCCO监测第1、3天时,PVPI、ELWI、GEDVI、ITBVI与PaO2/FiO2无相关性(P>0.05);死亡组在PiCCO监测第1、3、5天时PVPI、ELWI、GEDVI、ITBVI与PaO2/FiO2无相关性(P>0.05),见图1、2。
3 讨 论
ARDS的重要特征及基础改变是肺泡毛细血管屏障功能受损,ARDS时的肺泡液体增多的主要始发因素是内皮屏障受损。内皮细胞受损导致大量炎性介质释放,引起炎症扩大效应,出现ARDS肺水肿与肺血管内皮细胞屏障损伤后通透性明显增高。因此测定肺微血管受损情况,了解肺水肿程度及前负荷状态,对于评价肺损伤程度、判断预后具有重要意义。PiCCO监测技术可以对血管外肺水及肺毛细血管通透性进行量化反映[3]。而肺血管通透性可以反映肺损伤的程度,并且能评价危重病患者的预后状况[4-5]。Monnet等[6]研究发现,以PVPI≥3作为ARDS的诊断标准,其灵敏度为85%,而特异度高达100%,提示PVPI升高可作为反映ARDS是一种高通透性肺水肿的特征性指标。在ARDS的病程中,随着PVPI增加,肺PaO2/FiO2和顺应性明显下降。本研究显示PiCCO监测第5天时存活组PVPI与第1天比较明显降低,呈动态下降趋势;PiCCO监测第5天时死亡组PVPI较第1天明显升高,呈动态升高趋势;本研究显示PiCCO监测第3天死亡组的PVPI值较存活组明显升高;这与Szakmany等[5]的研究基本一致。提示对ARDS患者早期行PiCCO监测,观察PVPI动态变化,有助于对ARDS患者预后作出判断。本研究显示ARDS发展过程中,随着PaO2/FiO2的降低,PVPI也显著升高(P<0.05),与国内相关研究[7]一致,提示PVPI可作为诊断ARDS的一项良好指标。
ARDS进展过程中的肺血管通透性高低、肺水肿程度与患者预后也有相关性。EVLW是指肺血管腔以外的肺组织含水,是研究肺水肿的定量监测指标,可以早期、灵敏、直观地提供肺水肿发生、发展及演变的病理过程,有助于指导治疗及预后的评估,并且间接评估各个脏器和系统的功能。因此,监测EVLW是危重患者管理的重要部分。根据胸部X线片及动脉血气分析估计EVLW是不精确的,传统的双指示剂法可定量研究肺水肿,但可引起很多严重的并发症,限制了其在临床上的应用。有文献报道EVLW与ARDS的严重程度、患者的机械通气时间、入住ICU时间及病死率有关。用PiCCO对ARDS/ALI患者的肺水进行动态监测发现,感染性休克的ARDS/ALI患者EVLW和PaO2/FiO2呈负相关。Sakka等[8]回顾研究了373例危重患者,发现EVLW是病死率的独立预测因子,EVLW与预后有明显相关性,死亡组EVLW要明显高于生存组。Kuzkov等[9]总结38例脓毒症诱导的急性肺损伤病例病程,结果显示在监测第1天存活组EVLW和死亡组无明显差异,但随后存活组患者EVLW下降,而死亡组EVLW上升,到病程第3天存活组与死亡组比较差异有统计学意义。本研究结果显示,死亡组PiCCO监测第3、5天时EVLWI明显高于存活组,与文献报道相似。本研究监测第5天时随着PaO2/FiO2的降低,EVLW也显著增加,提示随着ARDS病情的加重,内皮屏障的破坏加剧,从而出现肺水肿加重;而EVLW的变化也有助于判断ARDS肺水肿和肺损伤的严重程度。
容量管理在ARDS治疗中十分重要,其目的一是补充并维持有效循环血量,同时又要防止容量过多导致的肺水肿,所以,容量的监测显得十分重要。有研究指出EVLW是液体疗法管理中的重要参数,在脓毒症患者表现出明显肺水肿临床症状之前,EVLW有助于指导液体的输入和缩血管活性药物的使用,当脓毒症患者表现为进行性的EVLW增加时,是限制液体输入和增加缩血管活性药物使用的指征[10]。ARDS患者血管通透性增加,如过多补液可能导致液体正平衡,加重组织的水肿。因此维持最佳容量状态是保证良好的器官灌注、防治多脏器功能失常综合征(MODS)、影响患者预后的重要因素,其前提是对容量状态进行准确的评价。有研究发现GEDV、ITBV与液体容量相关,并且不受胸内压的变化影响,较心脏充盈压(如CVP、PCWP)更能直接反映心前负荷的变化[11]。一项对45例重症患者的前瞻性研究证明ITBVI较PAWP更适合在临床上评价心脏容量[7]。有关冠状动脉搭桥和肺移植手术中应用PiCCO监测心脏前负荷的研究发现ITBVI比CVP和PAWP能更可靠地反映心脏前负荷变化。本研究结果表明ARDS作为高通透性肺水肿而非高静水压性肺水肿,PVPI增高,EVLW高,前容量负荷参数如GEDVI及ITBVI降低,与国内研究报道一致[12]。杨群等[13]研究分析36例脓毒症休克患者,比较存活病例和死亡病例的首次PiCCO指标,研究表明心脏前负荷的升高,反映为ITBVI升高。方明等[14]通过研究运用PiCCO技术对ARDS患者撤机前后血流动力学参数的监测发现,撤机拔管患者的ITBVI、GEDVI等容量指标逐步增高。一些研究认为ARDS早期存在,降低肺毛细血管通透性可以减少肺间质液体的生成,促进间质液的回吸收,使ARDS的肺顺应性和低氧血症得以改善[15]。本研究结果显示PiCCO监测存活组的GEDVI和ITBVI值呈动态增高趋势,与相关研究相符。本研究显示前负荷指标GEDVI、ITBVI和PaO2/FiO2之间存在较好相关性,可更好地指导ARDS患者前负荷的评价,在GEDVI和ITBVI的指导下进行液体治疗,是改善氧合,保持适当前负荷的重要手段。而将GEDVI、ITBVI与EVLW综合考虑,可判断肺血容量及肺渗透性变化,对于判断是容量超负荷还是通透性改变导致肺水肿有辅助作用,可更好地指导ARDS患者前负荷的评价。
[1]徐向辉,常业恬,李李,等.PiCCO与Swan-Ganz导管监测的比较与思考[J].医学与哲学,2007,28(8):52-53,55.
[2]Ferguson ND,Fan E,Camporota L,et al.The Berlin definition of ARDS:an expanded rationale,justification,and supplementary material[J].Intensive Care Med,2012,38(10):1573-1582.
[3]Pillops CP,Chesnul MS.Extra vascular lung water in sepsis associated acute respiratory distress syndrome:index with predicted body weight improves correlation with severity of illness and survival[J].Crit Care Med,2008,36(1):69-73.
[4]盛恒炜,郭锐,施冲.血管外肺水和肺血管通透性的监测与临床应用[J].实用医学杂志,2008,24(3):482-484.
[5] Szakmany T,Heigl P,Molnar Z.Correlation between extravascular lung water and oxygenation in ALI/ARDS patients in septic shock:possible role in the development of atelectasis[J].Anaesth Intensive Care,2004(32):196-201.
[6]Monnet X,Anguel N,Osman D,et al.Assessing pulmonary permeability by transpulmonary thermodilution allows differentiation of hydrostatic pulmonary edema from ALI/ARDS[J].Intensive Care Med,2007,33(3):448-453.
[7]严正,严洁,王秋卉.肺血管通透性指数用于急性呼吸窘迫综合征患者的预后评估[J].中国临床保健杂志,2013,16(4):404-406.
[8]Sakka SG,Klein M,Reinhart K,et al.Prognostic value of extravascular lung water in critically ill patients[J].Chest,2002,122(6):2080-2086.
[9]Kuzkov VV,Kirov MY,Sovershaev MA,et al.Extravascular lung waterdetermined with single transpulmonary thermodilution correlates withseverity of sepsis-induced acute lung injury[J].Crit Care Med,2006,34(6):1647-1653.
[10]Roch A,Guervilly C,Papazian L,et al.Fluid management in acute lung injury and ards[J].Ann Intensive Care,2011,1(1):16-17.
[11]郑晖,苏跃,司建洛,等.急性高容量血液稀释对OLV(单肺通气)犬血管外肺水的影响——温度稀释法与重量分析法的比较[J].中华麻醉学杂志,2004,24(9):661-664.
[12]韩凤英,杨洪莉,张惠明,等.血管外肺水的临床研究[J].中国现代药物应用,2012,6(22):37-38.
[13]杨群,许兆军,杨素华,等.PiCCO监测指标与老年脓毒性休克患者预后的相关性研究[J].中国现代医生,2012,50(18):20-22.
[14]方明,胡北,陈淼,等.从PiCCO监测指标分析急性呼吸窘迫综合征患者撤机失败的因素[J].中华急诊医学杂志,2013,22(7):765-769.
[15]毛克江,李轶男,强新华.ARDS患者机械通气时液体管理方法的临床研究[J].内蒙古中医药,2007,26(8):34-35.
10.3969/j.issn.1671-8348.2017.13.025
贵州省科技支撑计划基金项目[黔合字LG(2012)034号]。 作者简介:杨国辉(1966-),本科,主任医师,主要从事急危重症方面的研究。
R563
B
1671-8348(2017)13-1807-03
2016-12-14
2017-02-01)

