右美托咪定对肝门阻断手术血浆SDF-1表达水平的影响*
杨 贞,甯交琳,顾健腾,易 斌,鲁开智
(第三军医大学西南医院麻醉科,重庆 400038)
论著·临床研究
右美托咪定对肝门阻断手术血浆SDF-1表达水平的影响*
杨 贞,甯交琳,顾健腾,易 斌,鲁开智△
(第三军医大学西南医院麻醉科,重庆 400038)
目的 观察肝门阻断患者围术期血浆SDF-1表达水平的变化及右美托咪定对其的影响。方法 将50例择期行肝癌切除术的患者[年龄42~71岁,体质量指数(BMI)18.5~26.0 kg/m2,ASA分级Ⅱ~Ⅲ级]分为对照组及右美托咪定组,每组各25例。右美托咪定组在麻醉诱导前15 min开始持续泵注右美托咪定1 μg/kg,诱导后泵注速度改为0.4 μg·kg-1·h-1,直至手术结束前15 min;对照组以同样的方法静脉持续输注相同容量的0.9%氯化钠注射液。两组患者分别于术前1 h(T0)、术后1 h(T1)、1 d(T2)、3 d(T3)采集外周静脉血,采用酶联免疫吸附试验(ELISA)检测各时间点血浆中SDF-1的表达水平。结果 两组患者术中肝脏切除范围、出血量、第一肝门血管阻断时间、麻醉时间及术前血浆SDF-1水平比较,差异均无统计学意义(P>0.05)。与术前相比,术后T1、T2、T3时间点血浆SDF-1均明显升高(P<0.05)。与对照组相比,右美托咪定组T1、T2、T3时间点SDF-1表达水平低于对照组(P<0.05)。结论 SDF-1在肝门阻断患者围术期表达明显增高,术中持续给予右美托咪定能够显著降低其表达水平,从而在一定程度上抑制炎症细胞的趋化聚集。
右美托咪定;肝门阻断术;基质细胞衍生因子-1;围术期
在肝癌切除术中,为了能够有效切除肿瘤,常用肝门阻断对术中出血进行控制。但肝门阻断术会导致肝脏的缺血再灌注损伤,引起肝细胞的缺氧、坏死。SDF-1是趋化因子CXC亚家族的一员,又称为CXCL12(CXC chemokine ligand-12),其通过与CXCR4 N端区域和细胞外环-2(extracellular loop-2,ECL-2)结合启动下游PI3K/Akt、MAPK/ERK、JAK/STAT 等信号通路来调控细胞的增殖、运动、趋化、黏附和分泌功能表达[1]。研究发现SDF-1对淋巴细胞和单核细胞有很强的趋化作用,从而促进炎性反应以及炎性血管新生[2-3]。SDF-1同时在肝癌细胞的侵袭和转移中起到重要作用[4]。动物试验表明肝脏的缺血再灌注损伤会明显增加血浆中SDF-1的表达水平[5]。然而,在临床病例中肝门阻断术患者围术期SDF-1的表达情况以及右美托咪定对其表达的影响,值得深入探究。为此,笔者对本院2014年6月至2015年12月50例择期行肝门阻断术的患者围术期血浆SDF-1的表达水平及右美托咪定的影响进行了探讨。
1 资料与方法
1.1 一般资料 本研究于2014年6月至2015年12月进行,选取本院择期行肝癌切除术的肝癌患者50例。男26例,女24例,年龄42~71岁,体质量指数(BMI)18.5~26.0 kg/m2,ASA分级Ⅱ~Ⅲ级,接受手术治疗前未进行过放疗、化疗,肾脏、心脏和肺脏等各项指标均正常;术前无急性肝炎及其他全身性疾病;排除使用抗菌药物、激素类药物的患者;排除不配合试验观察以及患有精神疾病的患者。采用随机数字表法将最终入选患者分成对照组和右美托咪定组,每组25例,两组患者在性别、年龄、BMI、ASA分级等方面比较,差异无统计学意义(P>0.05)。本研究方案经医院医学伦理委员会批准,患者均知情同意并签署知情同意书。
1.2 麻醉方式 术前患者禁食8 h以上,均不使用术前药。患者入室后常规开放静脉通道,静脉输注乳酸钠林格液10 mL/kg,局部麻醉下行桡动脉穿刺置管。手术全程监测心率(HR)、血压(BP)、心电图(ECG)、血氧饱和度(SPO2)、呼气末二氧化碳浓度(PETCO2)、脑电双频指数(BIS)、连续鼻咽温度等。右美托咪定组在麻醉诱导前15 min开始持续泵注右美托咪定1 μg/kg,诱导后泵注速度改为0.4 μg/kg,直至手术结束前15 min;对照组以同样的方法静脉持续输注相同容量的0.9%氯化钠注射液。对照组和右美托咪定组麻醉诱导和维持方法相同,诱导前面罩吸入纯氧3 min,氧流量6 L/min。麻醉诱导:静脉注射丙泊酚2 mg/kg、舒芬太尼2 μg/kg和维库溴铵0.1 mg/kg。麻醉维持:快速气管内插管后连接麻醉机行七氟烷吸入麻醉,在10 min内将七氟烷初始呼气末浓度调节为1.6%。呼吸参数:氧流量1.2 L/min(氧浓度50%),潮气量8~10 mL/kg,呼吸频率12次/min,吸呼比1.0∶2.0,维持PETCO235 mm Hg左右。镇痛使用舒芬太尼0.04 μg/kg静脉泵注,肌松使用维库溴铵0.1 mg/kg间断静脉注射。手术期间维持BIS值40~50,维持术中血压、心率平稳。
1.3 观察指标 分别于手术前1 h(T0)、术后1 h(T1)、1 d(T2)、3 d(T3)采集外周静脉血2 mL,2 500 r/min离心15 min,取上清液于-20 ℃保存。采用酶联免疫吸附试验法(ELISA)测定血浆SDF-1水平。
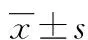
2 结 果
2.1 两组患者术前及术中情况比较 两组患者术前一般情况,其各项指标之间差异没有统计学意义(P>0.05),见表1。对手术过程中肝门阻断时间、出血量、手术时间、麻醉时间进行比较,差异亦无统计学意义(P>0.05),见表2。
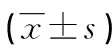
表1 两组患者术前各项基本指标的比较
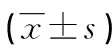
表2 两组患者术中情况比较
2.2 两组各时间点血浆SDF-1表达变化 与术前相比,术后T1、T2、T3时间点血浆SDF-1均明显升高(P<0.05);与对照组相比,右美托咪定组T1、T2、T3时间点SDF-1表达水平低于对照组(P<0.05),见表3。

表3 两组各时间点血浆SDF-1表达水平
#:P<0.05,与T0比较;*:P<0.05,与对照组相同时间点比较。
3 讨 论
SDF-1是趋化因子CXC家族中的一员,在介导免疫炎性反应以及炎症性血管新生中具有重要作用。SDF-1对淋巴细胞、单核细胞及树突状细胞具有高效的趋化作用,能诱导T 细胞滚动并紧密黏附于活化的内皮细胞上,从而介导循环中的炎症细胞通过内皮细胞到达局部,具有放射状细胞积聚现象[6]。这表明SDF-1是免疫及局部炎症中的一个重要调节因子。最近的研究还发现SDF-1-CXCR4轴是调控炎症性血管新生的重要因子,这对于肿瘤细胞的生长和进展也是非常关键的[7-8]。
在局部缺血区域SDF-1的表达会明显升高,Ceradini等[8]发现SDF-1蛋白在缺血组织血管及血管周围表达明显升高且表达水平与缺血程度直接相关[8],在组织缺血缺氧早期的6 h里,小动脉及肌肉纤维中即可出现SDF-1表达明显升高,3 d达到高峰,并且血浆中SDF-1水平也会明显升高[9]。患者在手术过程中由于需要反复阻断肝门血管,会出现缺血再灌注损伤,有研究表明肝脏的缺血再灌注损伤会促进结肠癌肝转移细胞的生长[5]。右美托咪定是一种新型、高选择性肾上腺素受体激动剂,可通过抗交感神经、抑制细胞凋亡、抑制氧化应激及炎性反应等多种途径对重要脏器起保护作用[9],并且多项研究表明右美托咪定对脏器的缺血再灌注损伤有明显的保护作用[10-12]。然而这种保护作用是否对降低肝门阻断术围术期SDF-1的表达尚未有明确的研究报道。
在本研究中,笔者观察了行肝门阻断术的患者围术期血浆SDF-1表达水平的变化及右美托咪定对其的影响。发现患者在行肝门阻断术后各时间点血浆中SDF-1的表达水平均明显高于术前,提示术中由于肝门阻断导致的肝缺血再灌注损伤明显增加了SDF-1的表达。而与对照组相比,右美托咪定组T1、T2、T3时间点SDF-1表达水平均低于对照组。说明右美托咪定对围术期肝脏缺血再灌注损伤的保护作用明显降低了SDF-1的表达水平。
综上所述,SDF-1在肝门阻断手术围术期表达明显增高,术中持续给予右美托咪定能够显著降低其表达水平,从而一定程度抑制术后炎症细胞的趋化聚集及炎症性血管新生。
[1]Chen G,Wang W,Meng S,et al.CXC chemokine CXCL12 and its receptor CXCR4 in tree shrews(Tupaia belangeri):structure,expression and function[J].PLoS One,2014,9(5):e98231.
[2]Ma Q,Jones D,Borghesani PR,et al.Impaired B-lymphopoiesis,myelopoiesis,and derailed cerebellar neuron migration in CXCR4 and SDF-1-deficient mice[J].Proc Natl Acad Sci U S A,1998,95(16):9448-9453.
[3]Askari AT,Unzek S,Popovic ZB,et al.Effect of stromal-cell-derived factor 1 on stem-cell homing and tissue regeneration in ischaemic cardiomyopathy[J].Lancet,2003,362(9385):697-703.
[4]Sutton A,Friand V,Brule-Donneger S,et al.Stromal cell-derived factor-1/chemokine(C-X-C motif) ligand 12 stimulates human hepatoma cell growth,migration,and invasion[J].Mol Cancer Res,2007,5(1):21-33.
[5]Lim C,Broqueres-You D,Brouland JP,et al.Hepatic ischemia-reperfusion increases circulating bone marrow-derived progenitor cells and tumor growth in a mouse model of colorectal liver metastases[J].J Surg Res,2013,184(2):888-897.
[6] Kantele JM,Kurk S,Jutila MA.Effects of continuous exposure to stromal cell-derived factor-1 alpha on T cell rolling and tight adhesion to monolayers of activated endothelial cells[J].J Immunol,2000,164(10):5035-5040.
[7]Liu H,Pan Z,Li A,et al.Roles of chemokine receptor 4(CXCR4) and chemokine ligand 12(CXCL12) in metastasis of hepatocellular carcinoma cells[J].Cell Mol Immunol,2008,5(5):373-378.
[8]Ceradini DJ,Kulkarni AR,Callaghan MJ.Progenitor cell trafficking is regulated by hypoxic gradients through HIF-1 induction of SDF-1[J].Nat Med,2004,10(8):858-864.
[9]De Falco E,Porcelli D,Torella AR,et al.SDF-1 involvement in endothelial phenotype and ischemia-induced recruitment of bone marrow progenitor cells[J].Blood,2004,104(12):3472-3482.
[10]Mantz J,Josserand J.Dexmedetomidine:new insight[J].Eur J Anaesthesiol,2011,28(1):3-6.
[11]Tuglu D,Yuvanc E,Yilmaz E,et al.The antioxidant effect of dexmedetomidine on testicular ischemia-reperfusion injury[J].Acta Cir Bras,2015,30(6):414-421.
[12]Kucuk A,Yaylak F,Cavunt-Bayraktar A,et al.The protective effects of dexmedetomidine on hepatic ischemia reperfusion injury[J].Bratisl Lek Listy,2014,115(115):680-684.
Effect of dexmedetomidine on plasma SDF-1 levels in hepatic portal occlusion operation*
Yang Zhen,Ning Jiaolin,Gu Jianteng,Yi Bing,Lu Kaizhi△
(Department of Anesthesiology,Southwest Hospital,Third Military Medical University,Chongqing 400038,China)
[Abstract] Objective To observe the effect of dexmedetomidine on plasma SDF-1 level in in hepatic portal occlusion operation.Methods Fifty patients with live cancer undergoing elective partial hepatectomy were selected,no gender limitation,aged 42 to 71,body mass index(BMI) 18.5 ~ 26.0 kg/m2,ASA grade Ⅱ or Ⅲ.The patients were randomly divided into 2 groups(n=25):control group and dexmedetomidine group.The dexmedetomidine group was performed the pump injection of dexmedetomidine 1 μg/kg at 15 min before induction of anesthesia.After induction the rate was changed to 0.4 μg·kg-1·h-1until 15 min before the end of operation;the control group adopted the same method for conducting continuous intravenous infusion of the same capacity of 0.9% sodium chloride.The peripheral venous blood was collected in 2 groups at preoperative 1 h (T0),postoperative 1 h(T1),postoperative 1 d (T2),postoperative 3 d(T3).The plasma SDF-1 level was detected by using enzyme-linked immunosorbent assay(ELISA).Results There was no statistically significant difference in liver resection range,blood loss,first porta hepatis vessel occlusion time,anesthesia time and plasma SDF-1 level before surgery between the two groups (P>0.05).Compared with pre-operation,plasma SDF-1level at T1,T2,T3 time point was significantly increased (P<0.05).The plasma SDF-1 level at T1,T2,T3 time point in the dexmedetomidine group was lower than that in the control group(P<0.05).Conclusion SDF-1 expression is significantly increased during perioperative period in the patients with hepatic portal occlusion operation,and intraoperative continuous dexmedetomidine can significantly reduce the SDF-1 level,which inhibits the chemotaxis and accumulation of inflammatory cells to some extent.
Dexmedetomidine;hepatic portal occlusion operation;stromal cell derived factor-1;perioperation
10.3969/j.issn.1671-8348.2017.13.012
国家自然科学基金资助项目(81270510)。 作者简介:杨贞(1983-),本科,主治医师,主要从事肝病及麻醉方面的研究。△
,E-mail:lukaizhi2010@163.com。
R614
A
1671-8348(2017)13-1765-03
2016-12-05
2017-01-23)

