人牙源性iPSCs 3种培养底物的比较*
谭小兵,刘 佳,郭 宇,徐静舒,戴青原
(1.云南省第一人民医院/昆明理工大学附属医院口腔内科,昆明 650032;2.昆明医科大学第一附属医院心内科,昆明 650032)
论著·基础研究
人牙源性iPSCs 3种培养底物的比较*
谭小兵1,刘 佳1,郭 宇1,徐静舒1,戴青原2△
(1.云南省第一人民医院/昆明理工大学附属医院口腔内科,昆明 650032;2.昆明医科大学第一附属医院心内科,昆明 650032)
目的 对比研究3种人牙源性诱导性多能干细胞(iPSCs)培养底物的特点。方法 使用3种底物培养人牙源性iPSCs:小鼠胚胎成纤维细胞(MEF)、基质胶和重组人玻连蛋白(VTN-N),对比iPSCs的生长情况。结果 3种底物的制备时间分别为14、3、1 h,三者间差异有统计学意义(P<0.05);iPSCs重编程时间分别为(30±1.6)、(26±2.1)、(27±1.4)d,其中MEF组明显多于其他两组(P<0.05);重编程效率分别为0.3%±0.03%、0.56%±0.08%、0.7%±0.02%(P<0.05)。3种底物均能较好支持iPSCs生长,使其保持未分化状态。结论 重组人玻连蛋白无异源性动物组分,制备简便、标准可控、重编程时间较短,是目前理想的支持iPSCs生长的底物。
人诱导性多能干细胞;小鼠胚胎成纤维细胞;基质胶;重组人玻连蛋白
2007年Yamanaka等[1-2]两个独立研究小组先后将转录基因Oct4/Sox2/Klf4/c-Myc或Oct4/Sox2/Nanog/Lin28导入人皮肤成纤维细胞,将其诱导为具有胚胎干细胞(embryonic stem cells,ESCs)性质的细胞,并命名为诱导性多能干细胞(induced pliripetent stem cells,iPSCs),为干细胞治疗与再生医学研究提供了新的思路[3-6]。iPSCs在形态、细胞倍增能力、类胚体和畸胎瘤形成、分化能力等多方面与ESCs非常相似,在组织再生、疾病模型、个性化治疗等方面具有巨大的应用前景[7-9]。iPSCs应用于临床研究时必须考虑其生物安全性,除了采用非整合性重编程方法(如仙台病毒、质粒载体、mRNAs、蛋白等)进行诱导以外[10],饲养层底物也是影响iPSCs生物安全性的重要影响因素。人牙髓干细胞(dental pulp stem cells,DPSCs)为间充质干细胞(mesenchymal stem cells,MSCs)来源,一定条件下可分化为脂肪、成骨或软骨系细胞,但与iPSCs相比其增殖和分化能力有限。本研究采用仙台病毒将人DPSCs诱导为iPSCs,观察比较3种培养底物对iPSCs生长的支持程度,筛选符合临床要求的最佳底物。
1 材料与方法
1.1 主要试剂 α-MEM、2.5 g/L胰蛋白酶、0.25 mmol/L乙二胺四乙酸(EDTA)、bFGF、重组人玻连蛋白(VTN-N)、Ⅰ型胶原酶购自美国Invitrogen公司,胎牛血清购自美国Hyclone公司,基质胶(生长因子减少型)购自美国BD公司,Ⅱ型中性蛋白酶购自瑞士Roche公司,CytoTune®-iPS 2.0 Sendai Reprogramming Kit购自美国Life公司,重编程培养基、PSC-easy培养基购自北京赛贝生物科技公司,H9细胞购自美国国家干细胞库。
1.2 方法
1.2.1 人DPSCs的分离培养 参照Gronthos方法[11]:收集本院口腔颌面外科拔除的下颌第三磨牙,术前告知并取得书面同意。分离牙髓组织、剪碎,Ⅰ型胶原酶与Ⅱ型中性蛋白酶混合液(3∶4,mg/mL)孵育60 min,离心、弃上清液,加入完全培养基(α-MEM + 15% FBS + 1%谷氨酰胺 + 1%青/链霉素),过滤得到单细胞悬液,37 ℃、5%CO2常规培养,90%融合后传代,第3~5代用于实验。观察细胞形态特征,流式细胞仪检测特异标记物的表达。所有实验均经云南省第一人民医院伦理委员会批准。
1.2.2 人DPSCs重编程及培养 利用Sendai Reprogramming Kit试剂盒进行细胞转染,0.5 mmol/L EDTA液消化传代。人胚胎干细胞H9为标准对照。仙台病毒(Sendai virus,SeV)转染:前两天,第3代DPSCs铺到6孔板内(1×105/孔)常规培养。转染当天(第0天),将适量SeV溶解到70 μL DPSCs培养基内,1 d后再加入130 μL 培养基,第2天换新鲜含SeV培养液。第3天将已转染细胞分别转移到3种底物覆盖的6孔板内,加入重编程培养基继续培养,3周左右可观察到克隆出现。克隆成熟时,“十字法”分割,转移到新培养板内,PSC-easy培养基培养。
1.2.3 3种培养底物的制备 小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEF)按照文献[12]制备:处死受孕小鼠,去除胚胎所有脏器、剪碎,0.25%胰酶/EDTA、37 ℃消化15 min,制成单细胞悬液,37 ℃、5%CO2培养(此时为第0代MEF),90%融合时传代或冻存。传代90%融合时,加入含丝裂霉素C的培养液(10 μg/mL),2 h后消化细胞,转入培养皿,第2天即可使用。基质胶(matrigel):4 ℃解冻,预冷枪头混匀,冷PBS稀释(50 μg/mL,1∶100),取适量包被培养板,37 ℃孵育2 h或4 ℃过夜,吸去基质胶,加入PSC-easy液备用;Vitronectin,VTN-N:常温解冻,常温PBS液稀释(5 μg/mL,1∶100),取适量包被培养板,37 ℃孵育1 h,吸去VTN-N,加入PSC-easy液备用。
1.2.4 3种不同底物培养系统的比较
1.2.4.1 iPSCs克隆生长情况 (1)观察iPSCs克隆在3组不同底物上的形态特征(H9为标准对照)。(2)RT-PCR:TriZOL试剂盒提取iPSCs总RNA,20 μL体系逆转录试剂盒合成单链cDNA,反应条件25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min,4 ℃保存。PCR反应程序:95 ℃ 5 min,35次循环(95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s),72 ℃ 7 min,电泳检测、成像,检测iPSCs特异性标记物Oct4、Sox2、Klf4、c-Myc的表达情况,人H9为标准对照,水为阴性对照。根据目的基因设计相应引物(表1)。

表1 人DPSCs-iPSCs标记物基因上下游引物碱基序列
1.2.4.2 重编程时间 包括3组不同底物的准备时间(培养基、饲养层细胞的制备)、从目标细胞接种到iPSCs克隆出现所需时间,重复3次,取平均值。
1.2.4.3 重编程效率 出现克隆数占重编程体细胞数量的比例是一个重要参数。计算公式:克隆数/体细胞数量×100%,重复3次,取平均值。
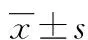
2 结 果
2.1 人DPSCs培养及鉴定 分离培养第1天即可看到细胞贴壁生长,第4天形成克隆,第10天形成单细胞层。细胞为纺锤形或长梭形,形态较大(图2A、2B)。流式细胞仪结果显示DPSCs不表达CD34、CD45,几乎所有细胞为CD90、CD105阳性,CD146染色阳性(28.4%),说明为MSCs来源;Stro-1和Oct-4染色均为阳性(分别为28.3%、43.6%),说明细胞具有多向分化潜能。

图2 人DPSCs培养及鉴定
2.2 人iPSCs重编程及其在3种底物上的培养 转染细胞接种到3组底物,重编程3 d即可观察到纤维细胞样克隆出现,7~10 d后生长停止,出现胞核凝固,细胞分解,克隆松散直至消失。ES样克隆多出现于转染后4周左右,表现为转染细胞缩小为圆形或规则多边形,单层排列紧密,边缘锐利清晰,边界清楚。此时ES样克隆即为iPS原代细胞(P0)。吸取原代iPSCs克隆种植于底物上传代培养,此时为iPS第1代(P1)。克隆生长迅速,EDTA液消化传代,4~5 d传代1次,细胞继续维持ES样克隆特征。3种底物均可很好地支持DPSCs-iPS和H9细胞的生长,克隆呈集落样生长;与周围有清晰分界线,克隆内细胞排列致密,保持未分化状态(图3)。RT-PCR结果显示iPSCs特异标记物的表达稳定,提示iPSCs处于未分化状态(图4A)。

A:MEF;B:基质胶;C:重组人玻连蛋白;D:MEF;E:基质胶;F:重组人玻连蛋白。
图3 人DPSCs-iPS与H9生长于不同培养底物
2.3 3种底物准备及重编程时间 MEF培养基准备2 h,铺板过夜12 h,丝裂霉素处理时间2 h,总计14 h,重编程第30天左右克隆开始出现。基质胶准备时间1 h,包被孵育2 h,重编程第26天时克隆开始,VTN-N准备时间0.2 h,包被孵育1 h,重编程第25天克隆开始出现(P<0.05)(图4B)。
2.4 重编程效率 人DPSCs重编程前细胞数量为1×104,重编程后3种底物上分别得到30、56、70个克隆,重编程效率为0.3%±0.03%、0.56%±0.08%、0.7%±0.02%,重编程效率间差异有统计学意义(P<0.05),见图5。

图4 人DPSCs-iPS特异性标记物RT-PCR分析及不同底物重编程时间比较

图5 人DPSCs-iPS不同培养底物上的重编程效率比较
3 讨 论
考虑到伦理道德及免疫排斥因素,iPSCs比ESCs更适于细胞移植和再生医学,是目前最有应用前景的种子细胞[13]。能满足临床应用要求的iPSCs称为临床级别iPSCs,理论上须满足以下3个条件:(1)细胞捐献者须符合《组织捐献指南》的要求;(2)细胞处理全过程须在GMP级别实验环境中进行,使用无异源性动物组分试剂;(3)获得的iPSCs无外源性基因或病毒整合,生物安全性有保证[14]。
目前制约iPSCs应用于临床的其中一个因素就是其生物安全性,如重编程载体带来的致瘤性可能、培养底物成分、含异源性动物组分试剂等。本实验采用一种非整合性RNA载体-仙台病毒诱导人DPSCs重编程为iPSCs,RT-PCR结果证实得到的iPSCs无仙台病毒或外源性转染基因的表达,同时所用iPSCs培养基无异源性动物组分(重编程培养基和PSC-easy培养基),保证了iPSCs的生物安全性(结果另文报道)。在此基础上笔者选择3种培养底物,对比研究哪种可以最佳支持iPS细胞的生长。
自从人ESCs成功培养以来,许多人ESCs和iPSCs系陆续成功建立,细胞生物学特性的研究有助于了解自我更新和定向分化过程中的关键通道和转录因子,而这又反过来促进了iPSCs的培养条件最佳化。iPSCs的培养底物经历了从饲养层到无饲养层体系的发展。早期iPSCs培养大多基于Thomson等创立的ESCs培养体系[15],MEF作为饲养层可以分泌多种生长因子、激素和胞外基质如转化生长因子β、激活素A、层粘连蛋白和玻连蛋白,支持稳定可靠的iPSCs。但MEF存在异源性动物组分污染可能,成分不明,制备耗时,标准不易控制,同时MEF及其产物对iPSCs本身是可能的病原体[16]。为了纯化细胞产物,需要采用无饲养细胞的培养体系。无饲养细胞培养体系大多基于Thomson体系加以改良[17],matrigel首先用于培养底物。有研究将人iPSCs培养于3种不同的底物,结果发现matrigel可以很好支持iPSCs生长,与MEF无明显差异[15]。matrigel是一种富含层粘连蛋白111的可溶性基底膜基质,同时含TGF-β、成纤维细胞生长因子、组织纤维酶原活化因子等[18]。matrigel在室温下可自动聚集产生类似于哺乳动物细胞基底膜的生物活性基质材料,生成类似体内环境的良好基底膜状态,有助于iPSCs的附着生长,为iPSCs保持未分化状态提供理想支持,是常用的培养底物[17]。matrigel成分相对单一,制备简便,标准可控,但其为小鼠源性肿瘤组织,限制了iPSCs的临床使用。重组人玻连蛋白(VTN-N)来自于人血浆的纯化,其主要整合素结合多肽是精氨酸-甘氨酸-天冬氨酸(RGD),通过αvβ5整合素支持人ESCs和iPSCs的生长,使其保持未分化和自我更新能力[18]。本研究从细胞形态、特异性标记物表达等方面进行分析,结果发现3种底物均能很好地使人DPSCs-iPSCs和H9长期维持未分化状态,与其他学者研究结果一致[17-19]。同时本研究分别在3种底物上对人DPSCs进行重编程,结果发现VTN-N所需重编程时间最短,重编程效率也明显高于其他两组,说明VTN-N可以为iPSCs的生长提供理想支持条件。
重组人玻连蛋白无异源性动物组分污染,制备简便,标准可控,是人牙源性iPSCs的理想底物。GMP标准下严格要求iPSCs重编程的全过程,包括目标细胞捐献者筛选、非整合性重编程载体的选择、合适底物、目标细胞及iPSCs的生物安全性检测、无异源性动物组分试剂的使用等方面,建立安全的临床级别人牙源性iPSCs,是笔者今后的研究方向。
[1]Takahashi K,Tanabe K,Ohnuki M,et al.Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J].Cell,2007,131(5):861-872.
[2]Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663-676.
[3]Ramalho-Santos M.iPS cells:insights into basic biology[J].Cell,2009,138(138):616-618.
[4]Liu L,Huang JS,Han C,et al.Induced pluripotent stem cells in huntington′s disease:disease modeling and the potential for cell-based therapy[J].Mol Neurobiol,2016,53(10):6698-6708.
[5]Pozzobon M,Ghionzoli M,De Coppi P.ES,iPS,MSC,and AFS cells.Stem cells exploitation for pediatric surgery:current research and perspective[J].Pediatr Surg Int,2010,26(1):3-10.
[6]Casaroli-Marano RP,Nieto-Nicolau N,Martínez-Conesa EM,et al.Potential role of induced pluripotent stem cells(IPSCs) for cell-based therapy of the ocular surface[J].J Clin Med,2015,4(2):318-342.
[7]Wang A,Tang Z,Park IH,et al.Induced pluripotent stem cells for neural tissue engineering[J].Biomaterials,2011,32(22):5023-5032.
[8]Tafaleng EN,Chakraborty S,Han B,et al.Induced pluripotent stem cells model personalized variations in liver disease resulting from α1-antitrypsin deficiency[J].Hepatology,2015,62(1):147-157.
[9]Montgomery A,Wong A,Gabers N,et al.Engineering personalized neural tissue by combining induced pluripotent stem cells with fibrin scaffolds[J].Biomater Sci,2015,3(2):401-413.
[10]Hibaoui Y,Feki A.Concise review:methods and cell types used to generate down syndrome Induced pluripotent stem cells[J].J Clin Med,2015,4(4):696-714.
[11]Bilic J,Izpisua Belmonte JC.Concise review:induced pluripotent stem cells versus embryonic stem cells:close enough or yet too far apart[J].Stem Cells,2012,30(1):33-41.
[12]Thomson JA,Odorico JS.Human embryonic stem cell and embryonic germ cell lines[J].Trends Biotechnol,2000,18(2):53-57.
[13]Vallier L.Serum-free and feeder-free culture conditions for human embryonic stem cells[J].Methods Mol Biol,2011,690(1):57-66.
[14]Ninomiya H,Mizuno K,Terada R,et al.Improved efficiency of definitive endoderm induction from human induced pluripotent stem cells in feeder and serum-free culture system[J].In Vitro Cell Dev Biol Anim,2015,51(1):1-8.
[15]Ghasemi-Dehkordi P,Allahbakhshian-Farsani M,Abdian N,et al.Comparison between the cultures of human induced pluripotent stem cells(hiPSCs) on feeder-and serum-free system(matrigel matrix),MEF and HDF feeder cell lines[J].J Cell Commun Signal,2015,9(3):233-246.
[16]Nagaoka M,Kobayashi M,Kawai C,et al.Design of a vitronectin-based recombinant protein as a defined substrate for differentiation of human pluripotent stem cells into hepatocyte-like cells[J].PLoS One,2015,10(8):e0136350.
[17]Badenes SM,Fernandes TG,Cordeiro CS,et al.Correction:defined essential 8 medium and vitronectin efficiently support scalable xeno-Free expansion of human induced pluripotent stem cells in stirred microcarrier culture systems[J].PLoS One,2016,11(5):e0155296.
[18]Braam SR,Zeinstra L,Litjens S,et al.Recombinant vitronectin is a functionally defined substrate that supports human embryonic stem c ell self-renewal via alphavbeta5 integrin[J].Stem cells,2008,26(9):2257-2265.
[19]Rowland TJ,Miller LM,Blaschke AJ,et al.Roles of integrins in human induced pluripotent stem cell growth on Matrigel and vitronectin[J].Stem Cells Dev,2010,19(8):1231-1240.
Comparison among 3 kinds of culture substrates of odontogenic induced pluripotent stem cells*
Tan Xiaobing1,Liu Jia1,Guo Yu1,Xu Jingshu1,Dai Qingyuan2△
(1.Department of Endodontics,Yunnan Provincial First People′s Hospital/Kunming Univerty ofscience and Technology Affiliated Hospital,Kunming,Yunnan 650032,China;2.Department of Cardiology,First Affiliated Hospital of Kunming Medical University,Kunming,Yunnan 650032,China)
[Abstract] Objective To comparatively study the characteristics of 3 kinds of culture substrates of human odontogenic induced pluripotent stem cells(iPSCs).Methods The human odontogenic iPSCs were cultured by 3 kinds of substrates:mouse embryonic fibroblasts(MEF),matrigel and recombinant human vitronectin(VTN-N).The iPSCs growth situation was compared among three groups.Results The preparation time of these 3 kinds of substrates was 14,3,1 hlespectively,and,the difference was statistically significant (P<0.05).The iPSCs reprogramming time was (30±1.6),(26±2.1),(27±1.4)d,lespectively,wht that in the MEF group significantly higer than in other two groups (P<0.05).The reprogramming efficiencies were 0.3%±0.03%,0.56%±0.08%,0.7%±0.02% respectively(P<0.05).Three kinds of substrate could better support iPSCs growth and make them to maintain un-differentiation status.Conclusion with no heterologous animal components,and the adrantaga of simple pleparation,oonfrollable standard and shorter gramming time is easy to prepare,the standard is controllable and the reprogramming time is shorter,which is an ideal substrate for supporting iPSCs growth.
human induced pluripotent stem cell;MEF;matrigel;vitronectin
10.3969/j.issn.1671-8348.2017.13.005
国家自然科学基金资助项目(81360161);云南省教育厅基金资助项目(2015Y153)。 作者简介:谭小兵(1974-),硕士,副主任医师,主要从事干细胞在牙髓再生中的应用研究。△
,E-mail:dqy0823@163.com。
R78
A
1671-8348(2017)13-1743-04
2016-11-25
2017-01-13)

