利用硫氰酸锂水溶液提取云南琥珀蚕茧壳丝蛋白的适宜条件研究
李琼艳+刘增虎+杨伟克+钟健

摘要:琥珀蚕(Antheraea assama)是一种具有重要利用价值的经济昆虫,其蚕丝特性优良,在纺织、生物医药、生物材料等领域有较好的开发利用潜力。本研究利用硫氰酸锂水溶液提取琥珀蚕茧壳丝蛋白,结果表明:部分琥珀蚕丝蛋白可得到提取,且提取效率随提取温度的升高而提高。在设置的最高水浴温度60℃条件下提取12 h后得到的蛋白浓度为10.257 mg/mL,溶解率为8.91%;在60℃溶解条件下进行超声处理(53 kHZ,500W)12 h,蛋白浓度为14.552 mg/mL,溶解率达16.93%。SDS-PAGE凝胶电泳检测提取的丝蛋白,显示不同处理条件下提取的丝蛋白条带无明显差异,丝蛋白无明显降解。提取的丝蛋白在浓度和质量上都可满足实验室研究的需要。
关键词:琥珀蚕;茧壳;丝蛋白;硫氰酸锂
中图分类号:S886:TS143.2文献标识号:A文章编号:1001-4942(2017)05-0124-05
Suitable Extraction Conditions for Yunnan Antheraea assama
Silk Protein using Aqueous Solution of Lithium Thiocyanate
Li Qiongyan, Liu Zenghu, Yang Weike, Zhong Jian
(Institute of Sericulture and Apiculture, Yunnan Academy of Agricultural Sciences, Mengzi 661101, China)
AbstractAntheraea assama is an important economic insect. Its silk shows excellent features, and has a good potential for development and utilization in the fields of textile, biological medicine, biological material and so on. This research used lithium thiocyanate solution to extract A. assama silk protein. The results showed that some A. assama silk protein could be extracted and the extraction efficiency increased with the increase of temperature. At the set maximum bath temperature of 60℃, the protein concentration was 10.257 mg/mL after dissolved for 12 hours and the extraction rate was 8.91%. When keeping the solution temperature of 60℃ and proceeding ultrasonic treatment (53 kHZ, 500 W) for 12 hours, the protein concentration reached 14.552 mg/mL and the extraction rate was 16.93%. SDS-PAGE gel electrophoresis detection results showed that there was no significant difference in the bands of silk protein extracted under different conditions, and there was no obvious degradation of silk protein. The extracted silk protein in both the concentration and quality could meet the needs of laboratory research.
KeywordsAntheraea assama; Cocoon;Silk protein;Lithium thiocyanate
蚕丝是一种天然蛋白纤维,属多孔性物质,透气性好、吸湿性极佳,被用于纺织业已有上千年,另外蚕丝具有无毒、无刺激及良好的生物相溶性,有益于人类及哺乳动物细胞的附着和增殖,所以也被广泛用于外科手术缝合線、创口覆盖材料、药物控制释放载体、组织工程学支架、皮肤修复材料、人造骨骼、韧带修复材料等生物医学领域的研究[1-7]。与家蚕相比大蚕蛾科的非桑蚕通常在野外或半野外饲养,其氨基酸的极性更高,生物活性更强[8-10]。大蚕蛾科的琥珀蚕(Antheraea assama)其丝以耐磨和富有金黄色光泽而闻名,与家蚕丝相比其具有更好的强伸力和吸湿性并具有优良的生物学特性,在纺织、生物医药、生物材料等领域有较好的开发利用潜力,经济价值较高。但由于琥珀蚕资源限制,目前琥珀蚕的研究相对滞后,对其蛋白的研究更是鲜有报道。
琥珀蚕丝蛋白是一种潜在的生物医学材料。Kar等[11]用家蚕、琥珀蚕和印度柞蚕3种丝蛋白膜进行人类成骨细胞MG-63的细胞附着性和生长性试验,结果表明非桑蚕丝蛋白膜的细胞相溶性模型可与标准模型媲美,琥珀蚕丝蛋白非常适合作为自然生物工程学的材料。研究表明,琥珀蚕丝和桑蚕丝的氨基酸组成相似,含有大量的甘氨酸、丙氨酸、丝氨酸等氨基酸[12]以及大量的精氨酸-甘氨酸-天冬氨酸三肽,三肽能提高细胞的粘附力并促进细胞生长和扩繁[1,13],可作为良好的组织工程学细胞培养基。另外琥珀蚕丝蛋白还具有很好的血液相容性,可用于构建血液仿生支架的体系结构[14]。与桑蚕相比,琥珀蚕丝蛋白在生物医学的运用上具有优越性。
目前对丝蛋白的研究和利用大多是从丝腺提取物中获得,如此很难进行大规模的运用,而直接将蚕茧溶解来获得丝蛋白,不仅可以获得大量的丝蛋白还避免了直接从蚕体中取丝腺的道德问题。但丝蛋白高度结晶,选择合适的溶剂及适宜的溶解条件来溶解茧壳获得丝蛋白,对于丝蛋白的研究和利用有极大的意义。查阅文献发现,提取茧壳蛋白主要采用尿素buffer和硫氰酸锂(LiSCN)溶液[15,16],其中尿素buffer主要是提取丝胶蛋白,而LiSCN溶液可以提取丝素蛋白,同时也可溶出丝胶蛋白。另有研究分别利用沸腾的Ca(NO3)2和30、40℃的LiSCN溶液提取柞蚕的丝素蛋白,结果显示40℃的LiSCN溶液溶解茧壳蛋白的效率较高[17]。因此,本研究利用LiSCN水溶液在不同条件下溶解琥珀蚕茧壳提取丝蛋白,以期获得利用LiSCN溶液提取琥珀蚕茧壳丝蛋白的适宜条件,为琥珀蚕丝蛋白的研究以及生物材料制备提供基础。
1材料与方法
1.1材料
选择形状为长椭圆形呈黄褐色且大小适中的云南琥珀蚕蚕茧,剪成大约 1~2 mm2碎片备用。琥珀蚕茧壳由云南省农业科学院蚕桑蜜蜂研究所提供。
1.2不同温度下溶解琥珀蚕茧壳
取0.5 g茧壳碎片,加入10 mol/L LiSCN水溶液10 mL,分别置于30、40、50、60℃的水浴环境中溶解茧壳。每隔1 h对溶解液进行一次蛋白浓度测定,12 h后取出未溶解的茧壳用蒸馏水多次冲洗,并在100℃下干燥5 h,称重,计算茧壳的溶解率。茧壳的溶解率计算公式如下:
溶解率(%)=原重-未溶解的质量原重×100。
1.3超声及振荡条件下溶解琥珀蚕茧壳
取0.5 g茧壳碎片,加入10 mol/L LiSCN水溶液10 mL,在保持60℃的条件下分别进行涡旋振荡和超声处理(53 kHZ,500 W),同样每1 h测一次溶解液的蛋白浓度,并在12 h后取出未溶解的茧壳用蒸馏水多次冲洗后,在100℃下干燥5 h,称重,计算茧壳的溶解率。
1.4蛋白浓度测定
利用BCA蛋白定量试剂盒(Biomiga,中国)对提取的丝蛋白进行定量。首先按照试剂盒说明书将reagent A与reagent B按照1∶50混合,配置成BCA工作液;用水将蛋白标准品稀释成0.5 mg/mL;将工作液、蛋白标样及水按照要求加样到96孔酶标板中,混匀,37℃放置30 min,冷却至室温,在酶标仪(Biotek ELX808IU-PC)中测定562 nm吸光值,测得吸光值绘制标准曲线。将20 μL、10倍稀释的蛋白样品加到酶标板的样品孔中,再加入BCA工作液200 μL定量后根据标准曲线算得样品蛋白浓度。
1.5SDS-PAGE电泳检测
应用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)方法检测丝蛋白的提取情况及分子量范围。配制5%浓缩胶和10%分离胶,加样10 μL,对最终提取的丝蛋白进行电泳分离。电泳时浓缩胶电流为10 mA,进入分离胶后为20 mA,当溴酚蓝指示剂距分离胶底部1 cm处时,电泳结束。电泳结束后固定2 h(固定液:40 mL无水乙醇,10 mL醋酸,50 mL H2O,混匀);之后分别用70%无水乙醇漂洗2次,水洗1次,20 min/次;0.02% Na2S2O3敏化1 min;水洗3次,20 s/次;硝酸银染色(染色液:0.4 g AgNO3,20 μL甲醛,100 mL H2O),显色(显色液:2 g Na2CO3,10 μL 0.5% Na2S2O3,50 μL甲醛,100 mL H2O);终止(终止液:1 g甘氨酸,100 mL水)。染色结束后用透射高精度扫描仪对电泳凝胶进行扫描。
1.6数据处理
采用Microsoft Excel 2010 和SPSS 17.0 软件进行数据处理和统计分析。
2结果与分析
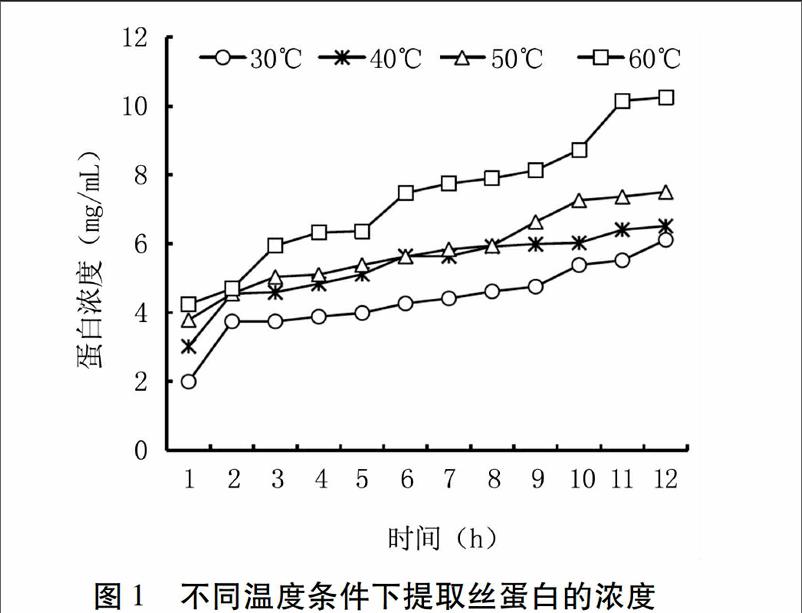
2.1温度对丝蛋白提取的影响
如图1所示,30℃条件下提取的蛋白浓度最低,第2~6 h内蛋白浓度变化幅度较小,从第7 h开始逐渐升高,到第12 h浓度达到6.100 mg/mL;40℃条件下蛋白浓度在12 h内变化不明显,前8 h内和50℃条件下提取的蛋白浓度差异较小,从第8 h开始50℃条件下提取的蛋白浓度较40℃高;60℃条件下提取的蛋白浓度在各个时间点都为4个温度条件下最高,且每小时浓度增大的幅度也较其它3个温度大,溶解第1 h 蛋白浓度为4.122 mg/mL,已达到30℃条件下第6 h时的浓度,第12 h浓度达到10.257 mg/mL。表明相同时间内随着溶解温度升高提取的蛋白浓度增大,其中60℃条件下提取的蛋白浓度最高。
2.2SDS-PAGE凝胶电泳检测
SDS-PAGE检测溶解12 h后提取的丝蛋白,结果如图2所示。琥珀蚕丝蛋白连续分布在整条泳道中,并主要集中在30 kD以上,4个泳道中都能看到在30 kD附近有一条明显的条带,95 kD以上的蛋白更加集中并有大量蛋白滞留在胶孔中。为更加清楚地看到分子量较大的丝蛋白的分布,降低分离胶浓度并延长跑胶时间,图2B结果显示,丝蛋白连续分布在泳道中,主要集中在95 kD以上,且在230 kD处有一条明显的条带。从图2可见4组试验提取的丝蛋白其蛋白条带无明显差异,表明随着温度升高,得到的琥珀蚕丝蛋白并没有发生明显降解。因此,本试验所设置的4个试验条件提取琥珀蚕丝蛋白都是可行的。
2.3超声及振荡处理对提取丝蛋白的影响
通过以上试验可知,不同温度提取的丝蛋白浓度存在差异, 60℃条件下提取的丝蛋白浓度最高,且通过检测发现在60℃高温条件下提取的丝蛋白并无明显降解。为进一步提高丝蛋白的提取效率,本试验在60℃且保持相同溶剂浓度、浴比条件下分别增加53 kHZ(500 W)超声及振荡处理,每隔1 h测定溶解液的蛋白浓度。结果(图3)显示,增加超声和振荡处理后,蛋白浓度都有一定程度的增大,且超声处理的效果更加明显。增加超声处理后第1 h的浓度为6.081 mg/mL,已超过无超声处理第3 h的浓度;第8 h的浓度为10.536 mg/mL,已超过无超声处理组第12 h时的浓度;第12 h的浓度达到14.552 mg/mL,是無超声处理组的1.42倍。说明,增加超声处理能够提高蛋白的溶解效率。另外,对增加超声和振荡处理后提取的丝蛋白进行电泳检测,结果(图4)显示,其电泳条带没有明显变化,这表明随着溶解条件的加剧,得到的丝蛋白浓度增大但无明显降解,说明可通过增加超声处理来提高丝蛋白的提取效率。
2.4琥珀蠶茧壳的溶解率
不同处理条件下溶解12 h后茧壳的溶解率结果(表1)显示,在30~60℃温度条件下溶解12 h茧壳的溶解率分别达到5.29%、6.82%、7.71%、8.91%,且随着溶解温度的升高溶解率增大,但差异未达到显著水平。在60℃条件下增加振荡处理12 h后其溶解率提高到11.72%,但与60℃温度处理差异不显著。在60℃条件下增加超声处理12 h之后其溶解率提高到16.93%,显著高于其它处理。温度升高有利于琥珀茧壳的溶解,超声和振荡能提高溶剂在茧壳中的扩散,增加溶剂与茧壳的接触从而增加茧壳的溶解效率,且超声处理下效果更好。
讨论与结论
本研究结果表明,LiSCN水溶液能溶解部分琥珀蚕丝蛋白,通过提高温度及增加超声能提高溶液在茧壳中的扩散速度,从而提高茧壳的溶解度。
大蚕蛾科野蚕的丝素蛋白仅由丝素重链fib-H及多聚丙氨酸形成二聚体,而不含丝素轻链(fib-L)及P25蛋白[18]。Adarsh等[19]研究结果显示,琥珀蚕fib-H基因编码230 kD的丝素蛋白。丝素重链蛋白是琥珀蚕丝蛋白中最重要的蛋白质,SDS-PAGE凝胶电泳检测显示,230 kD附近有一条明显的条带,推测为琥珀蚕丝素重链(Aafib-H)蛋白,说明本试验方法可以提取到琥珀蚕丝素重链蛋白。
提取时间较长,丝蛋白之间的次级键如氢键、疏水键、二硫键等容易被破坏,所以在提取过程温度过高、条件太激烈时都有可能引起丝蛋白降解。从图2和图4中可以看出,在不同条件下提取的丝蛋白其蛋白条带差异不明显,说明在本试验设置的条件下丝蛋白间的共价键、次级键没有被明显破环,蛋白没有明显降解。
综上所述,LiSCN水溶液提取琥珀蚕丝蛋白的方法可行,且在60℃、53 kHZ(500 W)超声条件下溶解效率最高,溶解12 h后丝蛋白浓度达到14.552 mg/mL,溶解效率为16.93%,提取的丝蛋白质量可满足普通实验需要。
参考文献:
[1]Minoura N, Aiba S, Higuchi M,et al. Attachment and growth of fibroblast cells on silk fibroin[J]. Biochemical & Biophysical Research Communications, 1995, 208(2): 511-516.
[2]Gotoh Y, Tsukada M, Minoura N. Effect of the chemical modification of the arginyl residue in Bombyx mori silk fibroin on the attachment and growth of fibroblast cells[J]. Journal of Biomedical Materials Research,1998, 39(3): 351-357.
[3]Inouye K, Kurokawa M, Nishikawa S,et al. Use of Bombyx mori silk fibroin as a substratum for cultivation of animal cells[J]. Journal of Biochemical & Biophysical Methods, 1998, 37(3): 159-164.
[4]Sofia S, Mccarthy M B, Gronowicz G,et al.Functionalized silk-based biomaterials for bone formation[J]. Journal of Biomedical Materials Research, 2001, 54(1): 139-148.
[5]Altman G H, Diaz F, Jakuba C,et al.Silk-based biomaterials[J]. Biomaterials, 2003, 24(3): 401-416.
[6]Chiarini A, Petrini P, Bozzini S,et al. Silk fibroin/poly(carbonate)-urethane as a substrate for cell growth: in vitro interactions with human cells[J]. Biomaterials, 2003, 24(5): 789-799.
[7]Dal P I, Petrini P, Chiarin A,et al.Silk fibroin-coated three-dimensional polyurethane scaffolds for tissue engineering: interactions with normal human fibroblasts[J]. Tissue Engineering, 2003, 9(6): 1113-1121.
[8]Sen K, Murugesh B K. Studies on Indian silk. I. Macrocharacterization and analysis of amino acid composition[J]. Journal of Applied Polymer Science, 2004, 92(2): 1080-1097.
[9]Lucas F, Shaw J T B, Smith S G. Comparative studies of fibroins : I. The amino acid composition of various fibroins and its significance in relation to their crystal structure and taxonomy[J]. Journal of Molecular Biology, 1960, 2(6): 339.
[10]Goujon N, Rajkhowa R, Wang X,et al. Effect of solvent on ionic liquid dissolved regenerated Antheraea assamensis silk fibroin[J]. Journal of Applied Polymer Science, 2013, 128(6):4411-4416.
[11]Kar S, Talukdar S, Pal S. Silk gland fibroin from Indian muga silkworm Antheraea assama as potential biomaterial[J]. Tissue Engineering and Regenerative Medicine, 2013, 10(4): 200-210.
[12]Freddi G, Gotoh Y, Mori T,et al. Chemical structure and physical properties of Antheraea assama silk[J]. Journal of Applied Polymer Science, 1994, 52(6): 775-781.
[13]Pierschbacher M D, Ruoslahti E. Cell attachment activity of fibronectin can be duplicated by small synthetic fragments of the molecule[J]. Nature, 1984, 309: 30-33.
[14]Kasoju N, Bora U. Antheraea assama silk fibroin-based functional scaffold with enhanced blood compatibility for tissue engineering applications[J]. Advanced Engineering Materials, 2010, 12(5): 139-147.
[15]Oyama F, Mizuno S, Shimura K. Studies on immunological properties of fibroin heavy and light chains[J]. Journal of Biochemistry, 1984, 96(6): 1689-1694.
[16]Wadbua P, Promdonkoy B, Maensiri S,et al.Different properties of electrospun fibrous scaffolds of separated heavy-chain and light-chain fibroins of Bombyx mori[J]. International Journal of Biological Macromolecules, 2010, 46(5): 493-501.
[17]Tao W, Li M, Zhao C. Structure and properties of regenerated Antheraea pernyi silk fibroin in aqueous solution[J]. International Journal of Biological Macromolecules, 2007, 40(5): 472-478.
[18]Yonemura N, Sehnal F. The design of silk fiber composition in moths has been conserved for more than 150 million years[J]. Journal of Molecular Evolution, 2006, 63(1): 42-53.
[19]Adarsh G K, Mita K, Arunkumar K P,et al. Molecular architecture of silk fibroin of Indian golden silkmoth, Antheraea assama[J]. Scientific Reports, 2015, 5:1-16.

