泡型肝包虫病患者血清炎症因子的抗体芯片检测及分析
邵 军, 王志鑫, 王 虎, 张灵强, 李衍飞, 阳丹才让, 任 利, 侯立朝, 周 瀛, 王海久, 樊海宁
1.青海大学附属医院肝胆胰外科,青海 西宁 810001; 2.青海省包虫病研究重点实验室 青海大学包虫病省级重点实验室; 3.青海省卫生和计划生育委员会
泡型肝包虫病患者血清炎症因子的抗体芯片检测及分析
邵 军1,2, 王志鑫1,2, 王 虎1,3, 张灵强1,2, 李衍飞1,2, 阳丹才让1,2, 任 利1,2, 侯立朝1,2, 周 瀛1,2, 王海久1,2, 樊海宁1,2
1.青海大学附属医院肝胆胰外科,青海 西宁 810001; 2.青海省包虫病研究重点实验室 青海大学包虫病省级重点实验室; 3.青海省卫生和计划生育委员会
目的 应用抗体芯片技术检测并分析泡型肝包虫病患者血清中炎症因子的表达及临床意义。方法 选取泡型肝包虫病患者与健康对照组血清标本各3份,利用抗体芯片技术检测血清样品中炎症因子的水平,采用AAH-INF-G3数据分析软件进行分析。结果 与对照组比较,泡型肝包虫病患者血清中多种炎症细胞因子(CSF-2/3、IL-1α、IL-2、IL-6、IL-8、IL-12p70、IL-13、IL-15、IL-17A、MCP-1/2、MIG、IFN-γ、TNF-α/β、TGF-β)表达水平发生显著变化(Fold change>2,<0.5;信号值>400)。其中IL-1α、IFN-γ、TNF-α/β等细胞因子升高(2倍以上),IL-12p70、MCP-2等细胞因子下降(3倍以上)。结论 免疫调节相关炎症因子可能参与泡型肝包虫病慢性炎症反应,可能是揭示泡型肝包虫病免疫逃逸机制的重要切入点。
抗体芯片;泡型肝包虫病;炎症细胞因子
泡型肝包虫病是由多房棘球绦虫幼虫寄生所致的一种人畜共患寄生虫病,流行于广大牧区,危害性极大。目前泡型肝包虫病以手术切除及药物治疗为主,但治愈率均低。近年对于炎症细胞因子与该疾病关系研究颇为深入,细胞因子在泡型肝包虫病的发病机制也不断地得到阐述。抗体芯片是一种检测生物样品中蛋白表达模式的方法,其具有高通量、平行性、高度特异性等优点,因此在细胞因子研究领域得到广泛应用[1]。本研究主要通过抗体芯片技术检测泡型肝包虫病炎症细胞因子的表达,分析炎症细胞因子的表达水平变化与泡型肝包虫病的免疫学关系,进一步探索针对寄生虫感染新的免疫疗法。
1 资料与方法
1.1 研究对象及标本处理 选取2015年9月-2015年11月青海大学附属医院泡型肝包虫病手术患者3例,男1例,女2例,均来自牧区且为藏族,年龄30~47岁,平均年龄38岁。临床表现、影像学检查结果符合卫生行业标准(WS 257-2006)泡型肝包虫病的诊断标准,除外合并感染性疾病及其他慢性疾病。同期健康对照3名,入选对象均于清晨采静脉血2 ml,1 h之内离心提取血清,置入-80 ℃冰箱保存。
1.2 实验方法 采用广州瑞博奥生物科技有限公司的AAH-INF-G3试剂盒进行检测,实验流程如下:(1)玻片芯片干燥:将玻片芯片(RayBio®Human Inflammation G3 Microarray slides)(1个玻片上有4个或者8个阵列)取出,室温平衡20~30 min,打开包装及封条,将芯片放在真空干燥器或者室温干燥1~2 h。(2)封闭和孵育:每个芯片孔中加入100 μl的1×封闭液,室温摇床上孵育1 h,避免产生气泡;抽去封闭液,样品离心13 000 r/min,10 min,每个孔中添加100 μl样品(血清2倍稀释上样),4 ℃振荡过夜孵育;使用Thermo Scientific Wellwash Versa芯片洗板机清洗玻片,每孔250 μl的1×洗液I,清洗8次,每次震荡10 s,后换用1×洗液II通道进行清洗,每孔250 μl的1×洗液II,清洗5次,每次震荡10 s。每孔加入70 μl生物素标记抗体;室温孵育2 h;清洗,每孔加入70 μl的1 500倍稀释的荧光剂-链霉亲和素,用密封条贴住玻片,然后用铝箔纸包住玻片避光室温震荡孵育1~2 h,清洗。(3)荧光检测:采用激光扫描仪(GenePix 4000B Microarray Scanner)扫描信号(激发频率=532 nm)。
1.3 数据分析及处理 采用AAH-INF-G3的数据分析软件来进行数据分析。与对照组对比,信号值>400;Fold change>2,<0.5为差异性表达因子。
2 结果
与健康对照组比较,泡型肝包虫病患者血清中18种炎症细胞因子表达水平发生显著变化(Fold change>2,<0.5;信号值>400)。荧光检测结果显示,与健康对照组比较,泡型肝包虫病患者IL-1α、IL-2、IL-6、IL-8、IL-13、IL-15、IFN-γ、TNF-α/β、TGF-β表达明显上调(见表1、图1)。通过两组均数与标准差比较发现泡型包虫病组组间差异相对较大,而健康对照组组间差异相对较小(见图2)。与健康对照组比较,泡型肝包虫病组大部分炎症细胞因子表达上调,少部分炎症细胞因子(IL-12p70、MCP-2)表达下调。其中IL-1α、IFN-γ、TNF-α/β等细胞因子升高(2位以上);IL-12p70、MCP-2等细胞因子下降(3倍以上)(见图3)。
表1 芯片膜上细胞因子位置列表 (Map of AAH-INF-G3)
Tab 1 List of cytokines on chip film locations (Map of AAH-INF-G3)

ABCDEFGHIJKLM1POS1POS2POS3NEGNEGCCL11CCL24CSF3CSF2ICAM1IFN-γI-309IL-1α2POS1POS2POS3NEGNEGCCL11CCL24CSF3CSF2ICAM1IFN-γI-309IL-1α3IL-1βIL-2IL-3IL-4IL-6sIL-6RIL-7IL-8IL-10IL-11IL-12p40IL-12p70IL-134IL-1βIL-2IL-3IL-4IL-6sIL-6RIL-7IL-8IL-10IL-11IL-12p40IL-12p70IL-135IL-15IL-16IL-17AIP-10MCP1MCP2CSF1MIGMIP-1αMIP-1βMIP-1ōRANTESTGF-β16IL-15IL-16IL-17AIP-10MCP1MCP2CSF1MIGMIP-1αMIP-1βMIP-1ōRANTESTGF-β17TNF-αTNF-βsTNFR1TNFR2PDGF-BBTIMP2NEGNEGNEGNEGNEGNEGNEG8TNF-αTNF-βsTNFR1TNFR2PDGF-BBTIMP2NEGNEGNEGNEGNEGNEGNEG
注:CCL:趋化因子的一类;CSF:集落刺激因子;ICAM:细胞间黏附分子;IFN:干扰素;I-309:嗜酸粒细胞趋化蛋白;IL:白细胞介素;IP-10:CXC趋化因子γ干扰素诱生蛋白10;MCP:单核细胞趋化蛋白;MIG:干扰素-γ诱导单核细胞因子;MIP:巨噬细胞炎症蛋白;TGF:转化生长因子;TNF:肿瘤坏死因子;sTNFR:肿瘤坏死因子受体;PDGF:血小板衍生的生长因子;TIMP:基质金属蛋白酶-1抑制剂。
3 讨论
包虫病分布于世界各地,主要分为囊型包虫病(cysticechinococcosis, CE)和泡型包虫病(alveolarechinococcosis, AE),其中AE主要局限于北半球,已经成为全球负担性疾病之一[2]。20世纪50年代AE被描述并在1952年出现正式的文献报道[3]。据报道,在没有治疗的情况下AE 10年内病死率94%以上,已经被公认为世界上最致命的人畜共患寄生虫病[4]。中国是世界上AE高度流行的国家之一,在我国新疆、青海、西藏、甘肃、宁夏、内蒙古和四川西部流行严重,尤其是青海与四川交界区域是流行的重要地区。AE恶性程度高,主要寄生于肝脏,类似恶性肿瘤,呈浸润性、外生性生长,可发生肺、脑转移[5],素有“寄生虫性肝癌”或“虫癌”之称。由于AE患者临床症状出现晚,一般症状出现时已经到了晚期[6],因此治疗很困难。
近年来,蛋白质芯片技术常被用于蛋白质谱分析、新药开发、药物目标识别、临床诊断和预后标记筛选。抗体芯片属于最常用的一种蛋白质芯片,具有高通量、高敏感度、样品(血液、尿液或组织)消耗少、较全面和准确地反映疾病发生、发展过程中蛋白质表达水平变化等特点,已经逐渐发展成为平行性定性和定量检测生物样品中蛋白质分子的重要检测手段[7]。尽管抗体芯片已被报道应用于肝细胞肝癌[8]、感染性疾病[9]等疾病相关细胞因子及蛋白水平检测中,然而其在泡型肝包虫病方面的应用尚无文献报道。与其他寄生虫感染一样,泡状棘球蚴在宿主体内成功生存往往需要其对宿主免疫系统进行主动的调节并逃逸对其有害的免疫应答反应,逐渐形成了一系列免疫调节机制[10]。而细胞因子是炎性疾病重要的调节剂,是当前关于发病机制的研究热点之一[11]。近年来细胞因子在肝包虫病的作用机制不断得到阐述,尤其是IL-6、TNF-α、TGF-β等细胞因子在肝包虫病的进展中扮演重要角色。因此我们通过抗体芯片技术检测泡型肝包虫病血清中炎症因子的表达,了解炎症细胞因子的表达在泡型肝包虫病的慢性疾病进程是否存在相关性。

图1 血清抗体芯片荧光检测扫描结果 A:健康对照组;B:泡型肝包虫病组Fig 1 The results of serum antibody chip fluorescence detection scan A: healthy control group; B: hepatic alveolar echinococcosis group
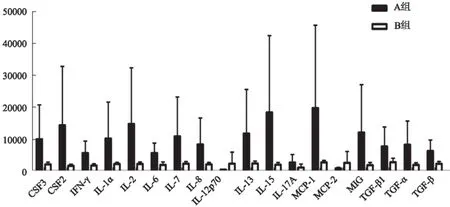
图2 两组差异性细胞因子组间比较情况(Fold change>2,<0.5; 信号值>400) A:泡型肝包虫病组;B:健康对照组
Fig 2 Comparison of the two groups of differentiated cytokines (Fold change>2,<0.5; signal value>400) A: hepatic alveolar echinococcosis group; B: healthy control group
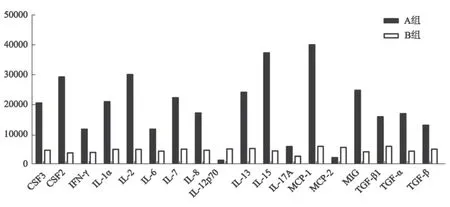
图3 两组比较显著性表达细胞因子(Fold change>2,<0.5;信号值>400) A:泡型肝包虫病组;B:健康对照组
Fig 3 The significantly expressed cytokines of two groups (Fold change>2,<0.5;signal value >400) A: hepatic alveolar echinococcosis group; B: healthy control group
泡型肝包虫病作为一种寄生虫感染性疾病,其感染的特点大致是Th2型细胞因子为主导下调Th1型细胞因子的诱导和功能,但Th2型细胞因子在泡型肝包虫病感染中的分子机制及生物学意义尚未明确[12]。Th1细胞主要产生Th1类细胞因子IL-2、TNF-β和IFN-γ,而Th2细胞主要产生IL-4、IL-5、IL-6、IL-10和IL-13[13]。Th17细胞与Treg细胞之间平衡状态的打破是很多炎症及自身免疫性疾病发病的一个关键因素。Th17可以分泌IL-17、IL-21、IL-22、IL-23、IL-26等多种细胞因子,而Treg细胞能够分泌IL-4、IL-10和TGF-β,参与自身免疫性疾病、移植免疫、肿瘤免疫等方面,Th17细胞和Treg的分化也呈互相抑制关系[14]。包虫病患者中IL-6的升高可以诱导提高NK及细胞毒T细胞的杀伤效应,达到杀灭包虫的作用;IL-2在寄生虫感染中,对寄生虫免疫应答起负向调节作用,这就促进了寄生虫的生长,Klatzmann等[15]研究表明低剂量IL-2能够激活Treg细胞群,从而控制自身免疫性疾病和炎症。IL-1和TNF-α是影响炎症进程的重要细胞因子。而TGF-β作用复杂,全身应用TGF-β有明显的负性免疫调节作用,但局部过多的TGF-β则会加重炎症;本研究中促炎因子(IL-1α、IL-6、IL-8、IFN-γ、TNF-α/β)与抗炎因子(IL-2、IL-13、IL-15、TGF-β)的表达均上调,而这些因子大部分可由Th1、Th2和Th17、Treg细胞分泌,因此推测可能存在Th1与Th2和Th17与Treg细胞之间功能的失衡,而其他炎性细胞因子(例如CSF、MCP、MIP等)的表达也存在显著差异,因此这些炎症细胞因子在泡型肝包虫病中的作用仍需要其他的方法去验证。
综上所述,目前的实验结果可推测炎性相关细胞因子在泡型肝包虫病慢性炎症进展中扮演重要角色,Th1与Th2和Th17与Treg细胞相关的促炎和抗炎因子均有所上调,提示泡型肝包虫病的进程中可能存在Th1与Th2型细胞、Th17与Treg细胞的功能失衡。由于Th1与Th2型、Th17与Treg细胞分泌的细胞因子的作用机制尚未明确,进一步探索细胞因子的作用机制及生物学意义,对免疫疗法在泡型肝包虫病以后的应用研究有重要参考意义。
[1]王艳艳. 抗体芯片分析氯喹对巨噬细胞炎性细胞因子分泌的影响[J]. 重庆医学, 2012, 41(3): 214-215. Wang YY. Effect of chloroquine on inflammatory cytokines secretion mouse macrophages by antibody chips [J]. Chongqing Medicine, 2012, 41(3): 214-215.
[2]Torgerson PR, Keller K, Magnotta M, et al. The global burden of alveolar echinococcosis [J]. PLoS Negl Trop Dis, 2010, 4(6): e722.
[3]Drozdova OS. Association of alveolar and unilocular echinococcosis of the liver [J]. Khirurgiia (Mosk), 1952, 5: 76-77.
[4]Wang Q, Huang Y, Huang L, et al. Review of risk factors for human echinococcosis prevalence on the Qinghai-Tibet Plateau, China: a prospective for control options [J]. Infect Dis Poverty, 2014, 3(1): 3.
[5]郭永忠, 丁木拉提, 朱马拜, 等. 肝泡状棘球蚴病合并肺、脑转移[J]. 中华肝胆外科杂志, 2005, 11(7): 493-494. Guo YZ, Dingmu LT, Zhu MB, et al. Alveolar Hydatid disease complicated with lung and brain metastases [J]. Chin J Hepatobiliary Surg, 2005, 11(7): 493-494.
[6]Avens HJ, Bowman CN. Development of fluorescent polymerization-based signal amplification for sensitive and non-enzymatic biodetection in antibody microarrays [J]. Acta Biomater, 2010, 6(1): 83-89.
[7]Gao DM, Sun L, Guo K, et al. Applicability of the multiplex quantitative antibody array system for early diagnosis of hepatocellular carcinoma [J]. Zhonghua Gan Zang Bing Za Zhi, 2012, 20(10): 785-788.
[8]Zhou Q, Mao YQ, Jiang WD, et al. Development of IGF signaling antibody arrays for the identification of hepatocellular carcinoma biomarkers [J]. PLoS One, 2012, 7(10): e46851.
[9]Natesan M, Ulrich RG. Protein microarrays and biomarkers of infectious disease [J]. Int J Mol Sci, 2010, 11(12): 5165-5183.
[10]马尔旦·马合木提, 吐尔洪江·吐逊, 马海长, 等. IL-17 mRNA在肝脏泡型包虫病中的表达及其临床意义[J]. 中国现代普通外科进展, 2014, 17(10): 771-774. Maerdan MHMT, Tuerhongjiang TX, Ma HC, et al. Expression of IL -17 mRNA in patients with alveolar echinococcosis and its clinical significance [J]. Chin J Curr Adv Gen Surg, 2014, 17(10): 771-774.
[11]Huang X, Grüner B, Lechner CJ, et al. Distinctive cytokine, chemokine, and antibody responses in Echinococcus multilocularis-infected patients with cured, stable, or progressive disease [J]. Med Microbiol Immunol, 2014, 203(3): 185-193.
[12]Siracusano A, Riganò R, Ortona E, et al. Immunomodulatory mechanisms during Echinococcus granulosus infection [J]. Exp Parasitol, 2008, 119(4): 483-489.
[13]姚金晶,陈宜涛. Th1/Th2平衡调节与疾病发生的研究进展[J]. 现代生物医学进展, 2009, 9(13): 2597-2600 Yao JJ, Chen YT. Advances of regulation Th1/Th2 type cytokines balance in human diseases [J]. Progress in Modern Biomedicine, 2009, 9(13): 2597-2600.
[14]陈淑增, 白剑鹏, 谢永华, 等. 强直性脊柱炎患者外周血Th17、Treg、Th1免疫失衡及其与疾病活动相关性研究[J]. 中国免疫学杂志, 2013, 29(8): 834-838. Chen SZ, Bai JP, Xie YH, et al. Expression of transcription factor Th17, Treg and Th1 in peripheral blood from patients with ankylosing spondylitis and its correlation with disease activity [J]. Chinese Journal of Immunology, 2013. 29(8): 834-838.
[15]Klatzmann D, Abbas AK. The promise of low-dose interleukin-2 therapy for autoimmune and inflammatory diseases [J]. Nat Rev Immunol, 2015, 15(5): 283-294.
(责任编辑:王全楚)
Antibody microarray analysis of the serum inflammatory cytokines in patients with hepatic alveolar echinococcosis
SHAO Jun1,2, WANG Zhixin1,2, WANG Hu1,3, ZHANG Lingqiang1,2, LI Yanfei1,2, YANGDAN Cairang1,2, REN Li1,2, HOU Lizhao1,2, ZHOU Ying1,2, WANG Haijiu1,2, FAN Haining1,2
1.Department of Hepatopancreatobiliary Surgery, the Affiliated Hospital of Qinghai University, Xining 810001; 2.Qinghai Province Key Laboratory of Hydatid Disease Researsh, Qinghai University Provincial Key Laboratory of Hydatid Disease; 3.Qinghai Province Health & Family Planning Commission, China
Objective To detect and analyze the expressions and clinical significances of serum inflammatory factors in patients with hepatic alveolar echinococcosis by antibody arrays. Methods The serum samples of hepatic alveolar echinococcosis patients and healthy controls for each of three copies were selected and the antibody microarray technique was used to detect the serum samples of inflammatory cytokines. Data was analyzed by AAH-INF-G3 software. Results Compared with control group, the expression levels of various inflammatory cytokines (CSF-2/3, IL-1α, IL-2, IL-6, IL-8, IL-12p70, IL-13, IL-15, IL-17A, MCP-1/2, MIG, IFN-γ, TNF-α/β, TGF-β) in patients with hepatic alveolar echinococcosis were significantly changed (Fold change>2, <0.5; signal value>400). IL-1α, IFN-γ, TNF-α/β were increased more than twice times and IL-12p70, MCP-2 were decreased more than 3 times. Conclusion Immunoregulatory-related inflammatory factors may be involved in the chronic inflammatory response of hepatic alveolar echinococcosis, which may be an important entry point for revealing the immune escape mechanism of hepatic alveolar echinococcosis.
Antibody microarray; Hepatic alveolar echinococcosis; Inflammatory cytokines
10.3969/j.issn.1006-5709.2017.05.024
青海省科技厅项目(2012-N-536,2012-Z-728);青海省临床重点建设专科项目-肝胆胰外科(青财社字〔2015〕1714号);青海大学中青年课题(2014-QYT-1); 2015年度卫生计生委员会指导性课题(青卫科〔2015〕18号)
邵军,在读硕士研究生,研究方向:普外科基础与临床研究及包虫病。E-mail:shj0203@163.com
王虎,教授,硕士生导师。E-mail:whqhxn@126.com;樊海宁,教授,博士生导师。E-mail:fanhaining@medmail.com.cn
R575
A
1006-5709(2017)05-0566-04
2016-09-02

