巨噬细胞在急性重症胰腺炎继发感染中的机制研究
张明刚, 段 军, 陶永康, 杨华元, 杜时雨
中日友好医院 1.消化内科; 2.重症医学科; 3.急诊科, 北京 100029
巨噬细胞在急性重症胰腺炎继发感染中的机制研究
张明刚1, 段 军2, 陶永康3, 杨华元1, 杜时雨1
中日友好医院 1.消化内科; 2.重症医学科; 3.急诊科, 北京 100029
目的分析受试者外周血中巨噬细胞的活化状态与急性重症胰腺炎(severe acute pancreatitis, SAP)患者继发感染的相关性。方法132例SAP患者入选,根据是否继发感染分为感染组和未感染组,并以健康对照者作为对照组。在继发感染初期,用酶联免疫检测方法检测血清中促炎因子肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)和白介素-1β(IL-1β)的浓度;用流式细胞术检测外周血中巨噬细胞百分率和刺激分子的表达及分泌上述促炎因子的变化。结果感染组和未感染组的血清中促炎因子TNF-α、IL-1β,较健康对照组均升高;巨噬细胞的比例及数量较健康对照组也明显增多;MHC-Ⅱ、CD86、TNF-α+细胞、IL-1β+细胞的比例也较健康对照组均升高,且感染组的各项指标均明显高于未感染组(P<0.05)。结论SAP的发生和继发感染与巨噬细胞的活化密切相关,继发感染后巨噬细胞的活化增强。
急性重症胰腺炎;巨噬细胞;继发感染;固有免疫
急性重症胰腺炎(severe acute pancreatitis, SAP)是一种临床常见的急性腹部疾病。尽管医疗条件不断提高,该疾病的死亡率为10%~30%,导致死亡的主要原因是其继发感染引起的多器官功能衰竭[1]。固有免疫是机体对抗炎症等“危险信号”的第一道防线,巨噬细胞和中性粒细胞是介导炎症的重要成员,也是诱发获得性免疫的“使者”。近年来,免疫失调被认为是急性胰腺炎的重要发病机制之一,因此,如何通过调节免疫系统有效降低SAP继发感染的发生率和有效控制感染是目前研究的热点。现有研究[2-5]表明,胰腺炎患者血液中炎性因子浓度明显增加,黏附分子和趋化因子的浓度也升高,从而引起巨噬细胞和中性粒细胞等免疫细胞向胰腺组织聚集,加重炎症和继发感染。但是对于巨噬细胞在SAP合并继发性感染过程中发挥所用的研究甚少[6-7]。因此,本研究拟探讨外周血中的巨噬细胞的免疫状态及与SAP继发感染的关系,为今后通过调整机体免疫状态来治疗SAP及其继发感染提供理论依据。
1 资料与方法
1.1 一般资料收集中日友好医院2003年1月-2015年8月住院的SAP患者132例,男73例,女59例,年龄42~78岁,平均年龄63岁。所有SAP患者分为2组:感染组和未感染组。其中感染组68例,男38例,女30例,年龄(62.8±11.2)岁;未感染组64例,男38例,女26例,年龄(59.2±9.3)岁。感染组及未感染组年龄、性别差异无统计学意义(P>0.05)。同时,选同期我院体检中心体检的健康志愿者45名,男28名,女17名,年龄43~78岁,年龄(61.0±9.8)岁,经体检后未发现胰腺和心肺功能异常。三组患者性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准所有患者符合2014年中华医学会外科学分会胰腺外科学组《重症急性胰腺炎诊治指南》的诊断标准,均排除严重心脑血管疾病、肝肾功能不全、免疫系统疾病、血液系统疾病等严重疾病。感染组患者符合以下继发感染的判断标准[1]:患者体温≥38 ℃且白细胞计数≥20×109个/L,行增强CT检查 或在B 超引导下行细针穿刺术,判断胰腺坏死范围及胰外渗出液是否已有感染。如合并下述情况之一者均可判定为坏死感染:(1)腹膜刺激征范围≥2个象限;(2)CT 检查于胰腺内发现气泡征;(3)细针穿刺术抽吸物涂片找到细菌[2]。
1.3 试剂和方法淋巴细胞分离液,购自北京索莱宝科技有限公司。流式抗体: anti-F4/80(pEcy5.5)、anti-CD11b(FITC)、anti-MHC-Ⅱ(PE)、anti-CD86(APC)均购自eBioscience公司。ELISA试剂盒购自美国R&D公司。
1.4 外周血单个核细胞(PBMC)的分离抽取各组受试者外周血10 ml左右,无菌条件下加入肝素钠抗凝,混匀后加入等量的PBS稀释,Ficoll密度梯度离心法分离PBMC:将稀释后的外周血沿管壁轻轻叠加于等体积的分离液上,使之界线清晰;配平后2 400 r/min离心25 min;离心后,小心取出分离管,可见管内液体分成清晰的4层,暗红色血浆下存在白色云雾状的淋巴细胞层;用平口吸管洗去白色云雾状细胞层,置于含PBS的离心管中,离心后沉淀即为PBMC。
1.5 流式细胞术检测细胞表面标志和产生细胞因子水平将新鲜分离得到的PBMC加入到流式管中,分组标记F4/80、CD11b、MHC-Ⅱ、CD86等抗体,轻轻振荡混匀后4 ℃避光孵育1 h。细胞因子的胞内染色需在完成上述步骤标记表面标记后,加PBS洗去未结合的抗体,用1%多聚甲醛悬起沉淀,4 ℃避光孵育30 min。PBS冲洗后,用0.01%皂素溶液悬起沉淀,4 ℃避光孵育30 min。标记抗细胞因子抗体,4 ℃避光孵育2 h。PBS冲洗2~3次后,上机检测。
1.6 ELISA检测细胞因子的变化抽取各组受试者空腹静脉血3 ml,静置30 min 后,离心1 000 r/min(离心半径为15 min)后取上层血清,置于-80 ℃ 冰箱保存,待测各项指标。肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、白介素-4(IL-4)和白介素-10(IL-10)等的浓度采用酶联免疫吸附实验测定,严格按照说明书操作进行检测,具体如下:测试前将试剂盒从冰箱中拿出,平衡至室温;取出板条,每孔加入100 μl Assay Dliuent RD1W;每孔加入100 μl标准品、样品和对照,密封后室温孵育2 h;加入洗涤液充分洗涤;每孔加入200 μl Conjugate,密封后室温孵育2 h;洗板;每孔加入200 μl Substrate Solution,室温避光孵育20 min;每孔加入50 μl Stop Solution, 轻轻敲匀后使用酶标仪在450 nm测定每孔的吸光度。
1.7 统计学处理所有数据使用软件GraphPad Prism 5进行图表的绘制和统计分析,采用方差分析检验各组均数间差异,不同组别间的比较用F检验,P<0.05为差异有统计学意义。
2 结果
2.1 血清中促炎因子水平比较与健康对照组比较,未感染组和感染组血清中的各种促炎因子水平均显著升高,差异有统计学意义(P<0.05);感染组均高于未感染组,差异具有统计学意义(P<0.05,见表1)。



TNF-αIL-6IL-1β健康对照组14.26±1.5013.17±2.3119.00±2.07未感染组52.96±3.78△67.16±3.70△62.95±4.18△感染组81.68±5.56△*118.50±7.99△*139.60±14.00△*
注:与健康对照组比较,△P<0.05;与未感染组比较,*P<0.05。
2.2 PBMC中巨噬细胞比例和绝对数的变化与健康对照组比较,感染组和未感染组巨噬细胞的比例和绝对数量均明显增加,差异有统计学意义(P<0.05);且感染组高于未感染组,差异有统计学意义(P<0.05,见表2)。
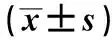
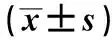

巨噬细胞比例(%)数量(×106个/L)健康对照组5.43±0.231.08±0.046未感染组11.96±0.19△4.78±0.079△感染组19.61±0.26△*13.72±0.180△*
注:与健康对照组比较,△P<0.05;与未感染组比较,*P<0.05。
2.3 巨噬细胞的活化状态和产生促炎因子水平的比较感染组和未感染组巨噬细胞的活化和产生细胞因子的水平较健康对照组均有明显增加,差异具有统计学意义(P<0.05);感染组的各项指标均高于未感染组,差异具有统计学意义(P<0.05,见表3)。
3 讨论
SAP属于急性胰腺炎的特殊类型,是一种病情险恶、并发症多、病死率较高的急腹症。约有20%的患者死于继发感染引起的胰腺坏死、脓肿或系统性多器官功能衰竭[8]。根据机体的免疫状态,通常胰腺炎被划分为3个类型:系统性免疫反应(systemic inflammatory response syndrome, SIRS)、补偿性抗炎反应(compensatory anti-inflammatory response syndrome, CARS)和混合型抗炎反应(mixed anti-inflammatory response syndrome, MARS)。鉴于免疫系统在不同病程发挥的重要作用,免疫调节的治疗方法逐渐受到各国专家的重视[1]。
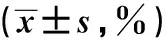
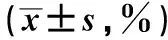

MHC-ⅡCD86TNF-α+IL-1β+健康对照组44.60±3.0134.20±3.8342.10±3.3933.10±3.92未感染组77.80±2.19△70.50±4.46△74.20±3.76△61.20±4.94△感染组85.40±2.03△*89.40±1.52△*91.80±1.14△*79.80±4.14△*
注:与健康对照组比较,△P<0.05;与未感染组比较,*P<0.05。
SAP起始于细胞内胰腺酶原和核转录因子-κB信号通路的激活,继而活化的细胞因子浸润胰腺组织,该步骤决定了胰腺炎的严重程度。初始阶段的炎症反应通过释放大量趋化因子和黏附分子将大量巨噬细胞募集到炎症部位而导致炎症放大,引起系统性大量炎症介质的产生,从而导致早期的器官损伤[9]。本研究也得到类似的结果,与健康对照组比较,感染组和未感染组患者的血清TNF-α、IL-1β和IL-6的水平均明显升高,且感染组高于未感染组,提示胰腺炎患者的免疫系统处于活化状态,并发继发性感染患者免疫系统得到了进一步的激活。
有资料显示,机体在产生大量促炎因子的同时,还会产生多种相关黏附分子,导致单核巨噬细胞向胰腺或其他炎症部位趋化。单核巨噬细胞在炎症性疾病的病理过程中发挥关键的促炎作用,巨噬细胞的活化水平可能是胰腺炎严重程度的重要决定因素之一。浸润后的巨噬细胞能产生诸如TNF-α、IL-1β、IL-6和单核细胞趋化蛋白-1(MCP-1)等多种促炎因子,致炎的同时趋化更多的单核巨噬细胞和中性粒细胞到炎症部位[10]。除此之外,活化的巨噬细胞还可以促进T、B淋巴细胞的活化,激活机体的获得性免疫。因此,本研究中我们检测了受试者PBMC中巨噬细胞的数量和活化状态。结果证明,与健康对照组相比,感染组和未感染组的患者PBMC中存在更多的活化巨噬细胞,这些细胞共刺激分子MHC-Ⅱ和CD86的表达水平和促炎因子TNF-α、IL-1β的分泌水平更高;且感染组的各项指标高于未感染组,说明SAP继发感染患者体内的巨噬细胞处于更高的活化状态,提示SAP继发感染的发生与机体内巨噬细胞的活化密切相关。
综上所述,本研究证实了SAP患者发生继发感染早期,外周血中存在大量促炎因子,体内的巨噬细胞处于高度活化状态。在胰腺炎后期,机体的免疫系统处于抑制状态[11-12],所以今后还需进一步研究巨噬细胞及其不同亚型在继发性感染的整个病理学过程中免疫系统的动态变化机制,为将免疫调节作为临床治疗SAP的重要手段建立良好的理论基础。
[1]Li J, Yang WJ, Huang LM, et al. Immunomodulatory therapies for acute pancreatitis [J]. World J Gastroenterol, 2014, 20(45): 16935-16947.
[2]Booth DM, Mukherjee R, Sutton R, et al. Calcium and reactive oxygen species in acute pancreatitis: friend or foe [J]. Antioxid Redox Signal, 2011, 15(10): 2683-2698.
[3]Gullo L, Migliori M, Oláh A, et al. Acute pancreatitis in five European countries: etiology and mortality [J]. Pancreas, 2002, 24(3): 223-227.
[4]Escobar J, Pereda J, López-Rodas G, et al. Redox signaling and histone acetylation in acute pancreatitis [J]. Free Radic Biol Med, 2012, 52(5): 819-837.
[5]汤睿, 张伟. 全身炎症反应综合征对急性胰腺炎预后的影响[J]. 华夏医学, 2004, 17(1): 7-9. Tang R, Zhang W. Impacts of systemic imflammatory response syndrome on the prognosis of patients with acute pancreatitis [J]. Acta Medicinae Sinica, 2004, 17(1): 7-9.
[6]Kylänpää L, Rakonczay Z Jr, O’Reilly DA, et al. The clinical course of acute Pancreatitis and the inflammatory mediators that drive it [J]. Int J Inflam, 2012, 2012(12): 360685.
[7]Wittau M, Mayer B, Scheele J, et al. Systematic review and meta-analysis of antibiotic prophylaxis in severe acute pancreatitis [J]. Scand J Gastroenterol, 2011, 46(3): 261-270.
[8]Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis-2012: revision of the Atlanta classification and definitions by international consensus [J]. Gut, 2013, 62(1): 102-111.
[9]杜时雨, 陶永康, 段军. 老年重症急性胰腺炎患者继发性感染的免疫状态分析[J]. 中华老年医学杂志, 2014, 3(6): 610-613. Du SY, Tao YK, Duan J, et al. Analysis of immunity status to secondary infection in the elderly with severe acute pancreatitis [J]. Chin J Geriatr, 2014, 33(6): 610-613.
[10]李延青, 高艳景, 黄柳业, 等. 急性胰腺炎的临床特征分析[J]. 中华内科杂志, 2004, 43(9): 672-674. Li YQ, Gao YJ, Huang LY, et al. The clinical features of acute pancreatitis in 10 cities in Shandong Province [J]. Chin J Intern Med, 2004, 43(9): 672-674.
[11]Zheng L, Xue J, Jaffee EM, et al. Role of immune cells and immune-based therapies in pancreatitis and pancreatic ductal adenocarcinoma [J]. Gastroenterology, 2013, 144(6): 1230-1240.
[12]Ueda T, Takeyama Y, Yasuda T, et al. Immunosuppression in patients with severe acute pancreatitis [J]. J Gastroenterol, 2006, 41(8): 779-784.
(责任编辑:李 健)
The mechanism of macrophages in prognosis of severe acute pancreatitis with secondary infection
ZHANG Minggang1, DUAN Jun2, TAO Yongkang3, YANG Huayuan1, DU Shiyu1
1.Department of Gastroenterology; 2.Intensive Care Unit; 3.Department of Emergency, China-Japan Friendship Hospital, Beijing 100029, China
Objective To investigate the relationship between macrophages activation state in the blood and secondary infection from severe acute pancreatitis (SAP). Methods One hundred and thirty-two patients with SAP were divided into infection group and uninfection group, compared with healthy control group. Serum levels of tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), interleukin-1β (IL-1β) were determined by ELISA. The frequency and activation of macrophages in the blood and the production of cytokines such as TNF-α, IL-6 and IL-1β were detected by FCM. Results Compared with healthy control group, the inflammatory indicators, such as density of TNF-α, IL-6, IL-1β in the serum and the number, ratio of macrophages were increased in infection group and uninfection group. The activation of macrophages which was represented as expression of MHC-Ⅱ, CD86, ratio of TNF-α+cells and IL-1β+were also increased sequentially (P<0.05). Conclusion The pathogenesis of SAP and secondary infection are closely related to the activation of macrophages. Macrophages emerges an enhanced activation after secondary infection.
Severe acute pancreatitis; Macrophages; Secondary infection; Innate immunity
10.3969/j.issn.1006-5709.2017.02.025
张明刚,副主任医师,研究方向:消化疾病内科及内镜诊治。E-mail:13621159166@163.com
杜时雨,博士,主任医师。研究方向:胰胆疾病的内科治疗及相关内镜诊断与治疗。E-mail:dushiyu1975@126.com
R576
A 文章编号:1006-5709(2017)02-0207-03
2016-04-11

