二氢辣椒素对人CD3AK细胞杀伤结肠癌SW-480和SW-620细胞的影响
郭相丽,钱 鹏,朱炳喜,周忠海,刘军权,徐 晶
1.徐州医科大学,江苏 徐州 221002; 2.徐州医科大学附属医院; 3.中国人民解放军第九七医院
二氢辣椒素对人CD3AK细胞杀伤结肠癌SW-480和SW-620细胞的影响
郭相丽1,钱 鹏1,朱炳喜2,周忠海3,刘军权3,徐 晶3
1.徐州医科大学,江苏 徐州 221002; 2.徐州医科大学附属医院; 3.中国人民解放军第九七医院
目的探讨二氢辣椒素(Dihydrocapsaicin)对人CD3AK细胞杀伤结肠癌SW-480和SW-620细胞的影响。方法分离健康人外周血单个核细胞(PBMC),在体外诱导培养CD3AK细胞。不同浓度的二氢辣椒素作用于CD3AK细胞48 h后,CCK-8法检测二氢辣椒素对CD3AK细胞增殖能力的影响,流式细胞术检测CD3AK细胞穿孔素、颗粒酶B、CD107a的表达,乳酸脱氢酶(LDH)释放法检测CD3AK细胞对结肠癌SW-480和SW-620细胞的杀伤活性。结果体外培养7 d后,CD3AK细胞比例由(20.15±3.4)%增加到(81.24±4.6)%(n=12)。与对照组比较,二氢辣椒素浓度在0.39~12.5 μmol/L时可显著促进CD3AK细胞增殖(P<0.05);二氢辣椒素浓度在0.39~1.56 μmol/L时,CD3AK细胞穿孔素、颗粒酶B、CD107a的表达均显著高于对照组(P<0.05);二氢辣椒素浓度在0.0975~6.25 μmol/L时,CD3AK细胞对结肠癌SW-480和SW-620细胞的杀伤活性显著增强(P<0.05)。结论二氢辣椒素能在一定范围内促进CD3AK细胞的增殖,并增强其对人结肠癌细胞的杀伤活性,这可能与药物作用后其穿孔素、颗粒酶B和CD107a的表达上调有关。
二氢辣椒素;CD3AK细胞;增殖;杀伤活性;结肠癌
结肠癌是最常见的消化系统恶性肿瘤之一,近几年,由于人们的生活习惯发生改变,其发病率呈现上升趋势[1]。常规的治疗手段如:手术、放疗和化疗,均有其自身的局限性。随着肿瘤免疫学的发展,目前肿瘤过继免疫治疗已成为肿瘤治疗新的研究热点。CD3AK细胞可作为一种抗肿瘤效应细胞应用于肿瘤过继性免疫治疗,其由CD3AK单克隆抗体(CD3McAb)联合小剂量白细胞介素-2(IL-2)激活产生,已在肿瘤治疗[2]和病毒治疗方面取得了进展。二氢辣椒素(Dihydrocapsaicin)是辣椒的主要辛辣成分之一,二氢辣椒素与辣椒素共占辣椒素类似物的90%[3]。随着研究的深入,发现二氢辣椒素和辣椒素具有抗肿瘤效应[4-6]。目前关于二氢辣椒素对免疫效应细胞的作用鲜有报道,本实验通过不同浓度二氢辣椒素对CD3AK细胞进行诱导,观察其对人CD3AK 细胞体外增殖及杀伤活性的影响,并初步探讨其可能机制。
1 材料与方法
1.1 材料结肠癌细胞株SW-480和SW-620(中国科学院上海细胞研究所);二甲基亚砜(DMSO)、异戊烯焦磷酸(IPP)购自Sigma公司;RPMI 1640培养基、胰蛋白酶、胎牛血清购自Gibco公司;人AB血清购自徐州市血站;淋巴细胞分离液购自中国科学院血液病研究所;二氢辣椒素购自Sigma公司;Anti-CD3、重组人白细胞介素-2(rhIL-2)购自厦门特宝生物公司;CCK8试剂购自碧云天生物技术有限公司;PerCP-Cy5.5标记的CD8、FITC标记的CD3、APC标记的CD107a单抗(clone:H4A3)购自BD公司;PE标记的Perforin单抗(clone:dG9)、PE标记的Granzyme B单抗(clone:GB11);Fix&Perm破膜剂购自Invitrogen公司;乳酸脱氢酶试剂盒购自日本世诺临床诊断制品株式会社;倒置显微镜购自德国Wilovert公司;垂直式电泳装置、电转移槽购自北京希亚克技术有限公司;ST-360酶标仪购自上海科华实验系统有限公司;Encore自动生化分析仪购自北京希亚克技术有限公司;流式细胞仪购自美国BD公司,分析软件为Cell Quest,每个标本分析细胞数≥1×104个。
1.2 方法
1.2.1 人CD3AK细胞的培养和鉴定:取健康成年志愿者外周血15 ml,加入淋巴细胞分离液分离获得PBMC(1 500 r/min×15 min,离心半径为12 cm),玻璃吸管吸取单个核细胞层,PBS洗涤3次,加入含Anti-CD3 1 mg/L、rhIL-2 50 U/L的RPMI 1640培养液中,调整细胞密度为1×106个/ml,置于37 ℃、体积分数5% CO2细胞培养箱中培养。收集培养7 d的CD3AK细胞,洗涤后调整细胞密度为1×107个/ml,加入PerCP-Cy5.5标记的CD8和FITC标记的CD3抗体进行标记,室温下避光孵育15 min,PBS洗涤并重悬细胞,采用流式细胞术检测其表达。
1.2.2 CCK-8法检测二氢辣椒素对CD3AK细胞增殖的影响:收集培养7 d的CD3AK细胞,调整细胞数为5×104个/ml,接种于96孔板中,200 μl/孔,分别加入不同浓度的二氢辣椒素(终浓度为0.39、0.78、1.56、3.125、6.25、12.5、25、50、100、200、400 μmol/L),设不加二氢辣椒素的空白对照组,每组设3个复孔,孵育48 h后,加入20 μl的CCK-8溶液,继续孵育4 h后放入酶标仪测定450 nm处的吸光度值,根据公式分析不同浓度药物组CD3AK细胞增殖率(%),增殖率(%)=(实验组OD值-对照组OD值)/对照组OD值×100%。
1.2.3 流式细胞术检测二氢辣椒素诱导48 h后CD3AK细胞中穿孔素、颗粒酶B、CD107a的表达:收集培养7 d的CD3AK细胞分别接种于6孔板中,加入二氢辣椒素(终浓度分别为0.0975、0.39、1.56、6.25 μmol/L),设不加药物组为对照组,培养48 h后,收集CD3AK细胞,调整细胞数至1×107个/ml。取3管100 μl细胞悬液,加入PerCP-Cy5.5标记的CD8和FITC标记的CD3抗体各20 μl,在检测穿孔素和颗粒酶B的试管内,加入 Fix&Perm破膜剂A和破膜剂B各100 μl,同时分别在试管中加入PE标记的perforin单抗和Granzyme B单抗各5 μl;在检测CD107a的试管内,加入APC标记的CD107a 5 μl。三组均设置同型对照抗体管,避光室温继续孵育20 min,PBS洗涤后,以400 μl PBS重悬细胞,上机检测穿孔素、颗粒酶B、CD107a的表达。
1.2.4 LDH释放法检测二氢辣椒素诱导CD3AK细胞48 h后对结肠癌细胞株SW-480和SW-620细胞杀伤活性的影响:按刘军权等[7]方法,取经不同浓度二氢辣椒素(终浓度为0.0975、0.39、1.56、6.25、25 μmol/L)诱导48 h后的CD3AK细胞为效应细胞,取对数生长期靶细胞SW-480和SW-620为靶细胞,将效应细胞和靶细胞数按10∶1比例混合,同时设单独效应细胞孔、单独靶细胞孔和空白孔,每组3个复孔,500 r/min离心5 min,离心半径为12 cm,置37 ℃、体积分数5% CO2孵箱中孵育6 h,再以1 500 r/min离心10 min,离心半径为12 cm,收集上清液用LDH试剂盒在Encore自动生化分析仪测定LDH的活性单位(U/L)。杀伤活性(%)=(A实验组-A效应细胞自然释放组)/(A靶细胞最大释放组-A靶细胞自然释放组)×100%。
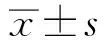
2 结果
2.1 人CD3AK细胞培养和鉴定人CD3AK细胞体外培养7 d后,在倒置显微镜下观察,可见细胞数量增多、体积增大,呈圆形或椭圆形,胞膜光滑,部分汇聚成大的细胞集落。收集培养前后的细胞用流式细胞仪检测,人CD3AK细胞(CD3+CD8+)的比例在培养前为(20.15±3.4)%,培养后增加到(81.24±4.6)%(n=12)(见图1)。

图1 培养前后CD3AK细胞百分率
A:培养前;B:培养后
Fig 1 Percentage of CD3AK cells before and after culture
A: before culture; B: after culture
2.2 不同浓度二氢辣椒素对CD3AK细胞增殖的影响二氢辣椒素浓度在0.39~12.5 μmol/L时,能促进人CD3AK细胞增殖,以1.56 μmol/L时最明显,增殖率为10.91%,显著高于对照组(P<0.01);当二氢辣椒素浓度在200~400 μmol/L时,CD3AK细胞增殖率为负值,与对照组相比,差异有统计学意义(P<0.01)(见图2)。
2.3 二氢辣椒素对CD3AK细胞中细胞穿孔素、颗粒酶B、CD107a的影响二氢辣椒素诱导CD3AK细胞48h后,CD3AK细胞穿孔素、颗粒酶B、CD107a的表达均有所上调,结果显示二氢辣椒素浓度范围为0.39~1.56 μmol/L时,人CD3AK细胞穿孔素、颗粒酶B、CD107a均不同程度高于对照组(P<0.05),而在浓度为1.56 μmol/L时达峰值,分别为(87.92±1.74)%、(88.97±1.61)%、(75.40±1.53)%,显著高于对照组(P<0.01)(见表1、图3)。

注:与对照组(0 μmol/L二氢辣椒素)相比,*P<0.05,**P<0.01。
图2 不同浓度二氢辣椒素对CD3AK细胞增殖率的影响
Fig 2 Effect of different concentrations of Dihydrocapsaicin on proliferation rate of CD3AK cells
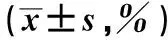
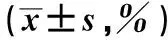

组别穿孔素颗粒酶BCD107a对照组72.98±1.3780.46±2.1656.65±1.32二氢辣椒素(μmol/L) 0.097580.43±2.14**84.21±1.5464.35±1.72*** 0.3984.82±1.32***86.05±2.21*69.02±1.24*** 1.5687.92±1.74***88.97±1.61**75.40±1.53*** 6.2578.72±1.42*83.15±1.7375.28±1.61
注:与对照相比较,*P<0.05,**P<0.01,***P<0.001。
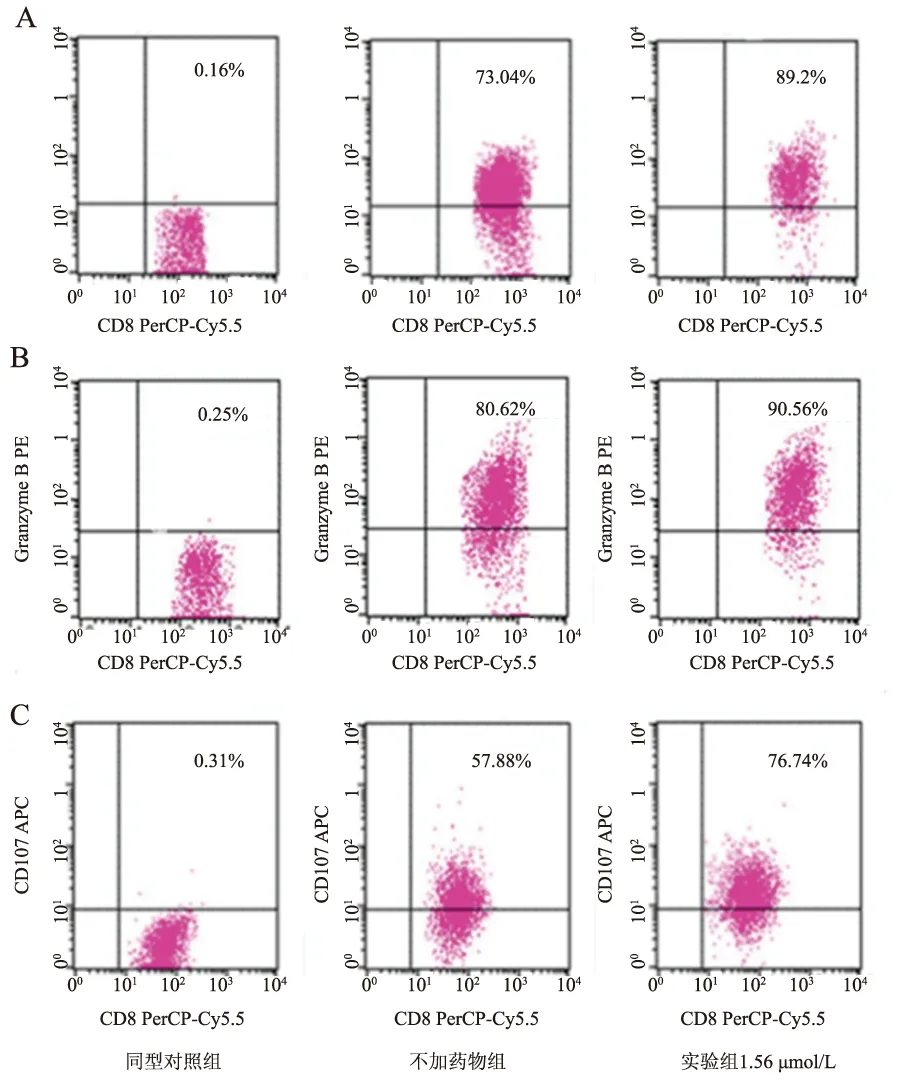
图3 二氢辣椒素诱导后人CD3AK细胞的穿孔素、颗粒酶B、CD107a含量变化
A:穿孔素;B:颗粒酶B;C:CD107a
Fig 3 Changes of perforin, Granzyme B and CD107a in human CD3AK cells induced by Dihydrocapsaicin
A: perforin; B: Granzyme B; C: CD107a
2.4 二氢辣椒素对CD3AK细胞杀伤结肠癌细胞株SW-480和SW-620细胞活性的影响浓度为0.0975~25 μmol/L的二氢辣椒素作用于人CD3AK细胞48 h后,人CD3AK细胞对结肠癌细胞株的杀伤活性变化比较明显,二氢辣椒素浓度为1.56 μmol/L时诱导的人CD3AK细胞对SW-480细胞的杀伤活性最高为(52.31±1.33)%,明显高于对照组(40.50±1.29)%(P<0.001)。诱导的药物浓度高于1.56 μmol/L时,杀伤活性逐渐降低(见图4);二氢辣椒素浓度为0.39 μmol/L时诱导的人CD3AK细胞对SW-620细胞的杀伤活性最高为(55.49±2.94)%,明显高于对照组(38.67±2.38)%(P<0.001)。诱导的药物浓度高于0.39 μmol/L时,杀伤活性逐渐降低(见图5)。
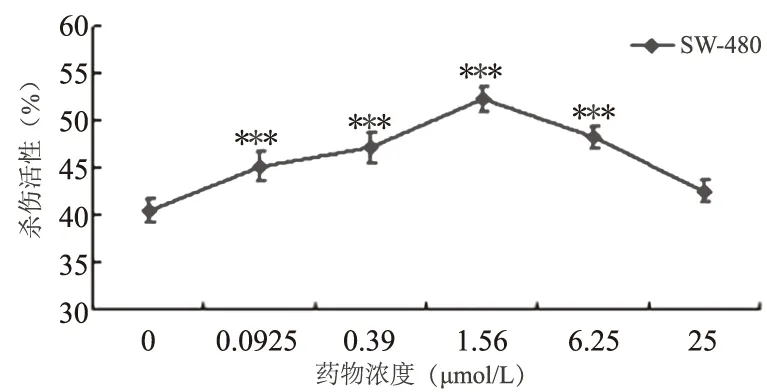
注:与对照组(0 μmol/L二氢辣椒素)相比,***P<0.001。
图4 二氢辣椒素对CD3AK细胞杀伤结肠癌细胞株SW-480细胞的影响
Fig 4 Effect of Dihydrocapsaicin on CD3AK cells killing colon cancer cell line SW-480 cells
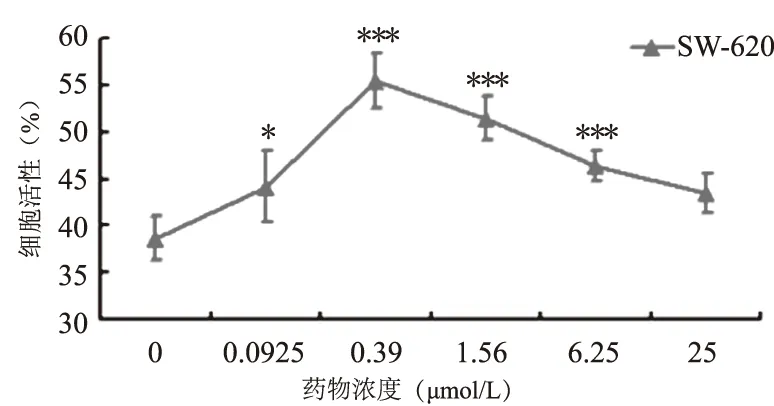
注:与对照组(0 μmol/L二氢辣椒素)相比,*P<0.05,***P<0.001。
图5 二氢辣椒素对CD3AK细胞杀伤结肠癌细胞株SW-620细胞的影响
Fig 5 Effect of Dihydrocapsaicin on CD3AK cells killing colon cancer cell line SW-620 cells
3 讨论
二氢辣椒素作为辣椒的辛辣成分,已被发现有镇痛、抗炎[7]、抗氧化、抗肥胖及抗癌[8-10]作用。此外,有研究[11]证明,二氢辣椒素可以通过PPARγ/LXRα途径显著衰减动脉粥样硬化斑块的形成,增加对心血管功能的保护。CD3AK细胞是继淋巴因子激活的杀伤细胞(LAK)、肿瘤浸润淋巴细胞(TIL)、细胞因子诱导的杀伤细胞(CIK)之后最新发现的一种抗肿瘤效应细胞,具有增殖速度快、细胞毒活性高、杀瘤谱广、存活时间长、体内抗瘤效果显著、所需IL-2最少等特点[12]。CD3AK细胞过继免疫治疗可提高机体免疫功能,通过效应细胞CD3+、CD8+等异质细胞群,直接杀伤肿瘤细胞,且毒副作用较小[13]。有关二氢辣椒素对人体免疫细胞的调节作用尚未见报道。本实验结果显示,浓度在0.39~12.5 μmol/L的二氢辣椒素作用于CD3AK细胞48 h后能明显促进其增殖,浓度为1.56 μmol/时,CD3AK细胞增殖率达峰值,当浓度继续增加超过200 μmol/时,反而抑制细胞增殖,表明二氢辣椒素对CD3AK细胞的增殖作用存在浓度窗现象,这也为二氢辣椒素可作为CD3AK细胞免疫调节剂研究奠定了一定的实验依据。
研究发现,穿孔素是一种糖蛋白,能以钙离子依赖方式在靶细胞膜上形成多聚穿孔素管状通道,直接导致靶细胞溶解破坏,也可协助颗粒酶B杀伤靶细胞[14]。颗粒酶B是具有天冬氨酸酶活性最重要的丝氨酸蛋白酶,存在于杀伤性T淋巴细胞和NK细胞颗粒中,可通过激活Caspase蛋白、直接裂解靶细胞内成分和诱导线粒体凋亡通路三种途径杀伤靶细胞。二者的表达都伴随着细胞毒细胞的活化而增加,可以作为CD3AK细胞体外杀瘤活性增强的机制之一。另一个反映CD3AK细胞体外杀瘤活性的指标是CD107a分子,是抗原特异性细胞活化以后脱颗粒过程的密切相关蛋白[15]。最新研究显示CD107a是NK细胞和CD8+T细胞活化的一个重要标志,与细胞毒活性密切相关[16]。本实验结果显示适当浓度的二氢辣椒素可增加CD3AK细胞的穿孔素、颗粒酶B、CD107a的表达。对结肠癌细胞杀伤活性检测显示,浓度为0.0975~6.25 μmol/L的二氢辣椒素作用于CD3AK细胞后,促使其杀伤活性增加,浓度为1.56 μmol/L的二氢辣椒素诱导的人CD3AK细胞对SW-480细胞的杀伤活性达到最高,与穿孔素、颗粒酶B、CD107a检测结果相一致,表明不同浓度的二氢辣椒素作用于CD3AK细胞48 h后,其杀伤活性的增强可能与CD3AK细胞穿孔素、颗粒酶的表达增加有关。有研究表明,CD3AK细胞可以通过以下途径杀伤相应的靶细胞:穿孔素、颗粒酶、Fas/FasL途径。而本研究对SW-620细胞的杀伤活性的药物峰值为0.39,这与本实验穿孔素、颗粒酶、CD107a的峰值结果不一致,我们考虑二氢辣椒素诱导的CD3AK细胞对肿瘤细胞的杀伤则可能也与Fas/FasL途径相关。
综上所述,本课题初步研究了二氢辣椒素对CD3AK细胞的影响,发现二氢辣椒素在一定浓度范围内可以促进CD3AK细胞增殖,并增强其杀伤能力,为二氢辣椒素用于结肠癌的免疫治疗提供一定的实验依据。
[1]姜毅楠,蔡逊,马丹丹,等.趋化因子受体1在人结肠癌中的表达及其与肿瘤转移的相关性研究[J].华中科技大学学报(医学版),2014, 43(4): 427-430. Jiang YN, Cai X, Ma DD, et al.Expression of CC Chemokine receptor 1 in colorectal carcinoma tissues and its association with tumor metastasis [J]. Acta Med J Univ Sci Technol Huazhong (Medical Science), 2014, 43(4): 427-430.
[2]胡伟,梁婧,孙殿水,等.自体CD3AK细胞治疗晚期恶性肿瘤的近期疗效[J].中国肿瘤生物学杂志, 2008, 15(2): 155-158. Hu W, Liang J, Sun DS, et al. Anti-CD3 monoclonal antibody activated autologous killer cells in treatment of advanced malignant tumor: an observation of short-term effectiveness [J]. Chinese Journal of Biotherapy, 2008, 15(2): 155-158.
[3]Reyes-Escogido ML,Gonzalez-Mondragon EG,Vazquez-Tzompantzi E.Chemicaland pharmacological aspects of capsaicin[J].Molecules,2011,16(2):1253-1270.
[4]Malagarie-Cazenave S, Olea-Herrero N, Vara D, et al. The vanilloid capsaicin induces IL-6 secretion in prostate PC-3 cancer cells [J]. Cytokine, 201l, 54(3): 330-337.
[5]Zhang JH, Lai FJ, Chen H, et al. Involvement of the phosphoinositide 3-kinase/Akt pathway in apoptosis induced by capsaicin in the human pancreatic cancer ceU line PANC-l [J]. Oncol Lett, 2013, 5(1): 43-48.
[6]Bley K, Boorman G, Mohammad B, et al. A comprehensive review of the carcinogenic and anticarcinogenic potential of capsaicin [J]. Toxicol Pathol, 2012, 40(6): 847-873.
[7]刘军权,韩慧敏,陈复兴.用乳酸脱氢酶试剂盒检测LAK细胞活性[J].临床医学检验, 1995, 13(2): 83. Liu JQ, Han HM, Chen FX. Cytotoxicities of LAK cell using the LDH kits [J]. Chin J Clin Lab sci, 1995, 13(2):83.
[8]Clark R,Lee SH.Anticancer properties of capsaicin against human cancer [J]. Anticancer Res, 2016, 36(3): 837-843.
[9]Gannon NP,Lambalot EL,Vaughan RA.The effects of capsaicin and capsaicinoid analogs on metabolic molecular targets in highly energetic tissues and cell types [J]. Biofactors, 2016, 42(3): 229-246.
[10]Luo XJ, Peng J, Li YJ. Recent advances in the study on capsaicinoids and capsinoids [J].Eur J Pharmacol, 2011, 650(1): 1-7.
[11]Yang ZH,Wang XH,Wang HP,et al. Capsaicin mediates cell death in bladder cancer T24 cells through reactive oxygen species production and mitochondrial depolarization [J].Urology, 2010, 75(3): 735-741.
[12]Zhao JJ,Hu YW,Huang C,et al.Dihydrocapsaicin suppresses proinflammatory cytokines expression by enhancing nuclear factor IA in a NF-κB-dependent manner [J]. Arch Biochem Biophys, 2016, 604: 27-35.
[13]陈复兴,刘军权,张南征,等.人γδT细胞、CD3AK细胞、CIK和DCs对荷胃癌裸鼠的疗效[J].中国肿瘤生物治疗杂志,2009,16(2): 180-180. Chen FX, Liu JQ, Zhang NZ, et al. Effects of human gamma T cells, CD3AK cells, CIK and DCs on nude mice bearing gastric cancer [J]. ChinJ Cancer Biother, 2009, 16(2): 180-180.
[14]Ricker LJ, Kijlstra A, Kessels AG, et al. Interleukin and growth factor levels in subretinal fluid in rhegmatogenous retinal detachment:a case-control study [J].PLoS One, 2011, 6(4): e19141.
[15]Prakash MD, Bird CH, Bird PI. Active and zymogene forms of granzyme B are constutively released from cytotoxic lymphocytes in the absence of target ceu engagement [J]. Immunol Cell Biol, 2009, 87(3): 249-254.
[16]Aktas E,Kucuksezer UC,Bilgic S, et al.Relationship between CD107a expression and cytotoxic activity[J].Cell Immunol, 2009, 254(2): 149-154.
[17]Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity [J]. Immunol Methods, 2004, 294(1-2): 15-22.
(责任编辑:马 军)
Effect of Dihydrocapsaicin on the cytotoxic activity of CD3AK cells against colon cancer cell lines SW-480 and SW-620
GUO Xiangli1, QIAN Peng1, ZHU Bingxi2, ZHOU Zhonghai3, LIU Junquan3, XU Jing3
1.Xuzhou Medical University, Xuzhou 221002; 2.The Affiliated Hospital of Xuzhou Medical University; 3.The 97th Hospital of Chinese PLA, China
Objective To investigate the effect of Dihydrocapsaicin on the cytotoxic activity of human CD3AK cells against colon cancer cell lines SW-480 and SW-620 in vitro.Methods CD3AK cells drived from healthy donors were isolated and cultured in vitro. CD3AK cells with different concentrations of Dihydrocapsaicin were cultured in vitro for 48 hours.Proliferation of CD3AK cells in each group was detected by CCK-8 method. The phenotypes were identifed by flow cytometer. Expressions of perforin, granzyme B, CD107a in CD3AK cells were verified by flow cytometer. The cytotoxic activity of CD3AK cells against colon cancer cells was analyzed by LDH release assay.Results After 7 days culture, the proportion of CD3AK cells were increased from (20.15±3.4)% to (81.24±4.6)% (n=12).Compared with the control group, the proliferation rate of CD3AK cells was increased significantly with the Dihydrocapsaicin at concentrations from 0.39 to 12.5 μmol/L (P<0.05); the expressions of perforin, Granzyme B, CD107a in human CD3AK cells were significantly higher than those in control group with the Dihydrocapsaicin at concentrations from 0.39 to 1.56 μmol/L (P<0.05); the cytotoxic activity of CD3AK cells against colon cancer SW-480 and SW-620 cells with the Dihydrocapsaicin at concentrations from 0.0975 to 6.25 mol/L was remarkably higher than that in the control group (P<0.05).Conclusion Dihydrocapsaicin at a certain range of concentrations can promote the proliferation of CD3AK cells and enhance the cytotoxic activity of CD3AK cells to colon cancer cells.The mechanism may be related to the increase of the expressions of Granzyme B and CD107a in CD3AK cells after drug action.
Dihydrocapsaicin; CD3AK cells; Proliferation; Cyotoxic activity; Colon cancer cells
郭相丽,硕士研究生,研究方向:消化道肿瘤的基础与临床。E-mail:1215508447@qq.com
朱炳喜,主任医师,副教授,研究方向:消化道肿瘤的基础与临床。E-mail:82200496@163.com
10.3969/j.issn.1006-5709.2017.02.004
R735.3+5
A 文章编号:1006-5709(2017)02-0134-05
2016-11-06

