培哚普利对APPswe/PS1dE9双转基因痴呆模型小鼠认知功能的改善及脑中NOS的影响①
张腾腾,辛 华, 黄作义 ,邹春颖 ,张淑萍
(佳木斯大学附属第一医院神经科,黑龙江 佳木斯 154003)
培哚普利对APPswe/PS1dE9双转基因痴呆模型小鼠认知功能的改善及脑中NOS的影响①
张腾腾,辛 华, 黄作义 ,邹春颖 ,张淑萍
(佳木斯大学附属第一医院神经科,黑龙江 佳木斯 154003)
目的:观察培哚普利对APPswe/PS1dE9痴呆模型小鼠认知功能的改善及脑中一氧化氮合酶(NOS)的影响。方法:将30只健康APPswe/PS1dE9 4月龄双转基因雄性小鼠随机分为3组:即模型组(AD组)、培哚普利治疗组、石杉碱甲治疗组。另外选择10只健康4月龄野生雄性小鼠作为正常组。灌药4个月以后,观察小鼠一般状态,Morris 水迷宫观察小鼠行为学,化试剂盒检测小鼠海马中iNOS和nNOS含量。结果:与石杉碱甲治疗组相比,培哚普利治疗组能够明显改善APPswe/PS1dE9痴呆小鼠的认知功能,并且能够降低小鼠海马组织中iNOS、nNOS的含量。结论:培哚普利能够明显提高APPswe/PS1dE9痴呆小鼠的认知能力,同时降低小鼠海马组织中iNOS及nNOS的含量。
阿尔兹海默病(AD);培哚普利;一氧化氮合酶
阿尔茨海默病(Alzheimer disease,AD)[1]是发生于老年和老年前期、以进行性认知功能障碍和行为损害为特征的中枢神经系统退行性病变。临床上表现为记忆障碍、失语、失用、失认、视空间能力损害、抽象思维和计算力损害、人格和行为改变等。培哚普利是ACEI类药物中的一种,除传统的血压调节、水盐代谢、垂体激素分泌等生理功能外,对于神经可塑性和学习记忆等认知功能也有重要作用[2,3],目前许多国内外学者研究表明其可以通过血脑屏障产生中枢性作用[4],本研究着重分析培哚普利对老年痴呆小鼠认知功能的改善及对小鼠海马区NOS(iNOS、nNOS)水平的影响,为以后老年痴呆的预防及治疗提供新道路。
1 材料与方法
1.1 实验动物
选取4月龄APPswe/PS1dE9痴呆小鼠30只及4月龄野生雄性小鼠10只。APPswe/PS1dE9双转基因痴呆小鼠购自中国医学科学院神经科学研究所(该品系引种于美国JACKSON实验室),4月龄野生雄性小鼠由佳木斯大学动物中心提供,饲养于佳木斯大学生命科学实验中心。全程小鼠自由摄食、饮水。动物饲养及所有实验操作均严格遵守佳木斯大学生命科学实验中心实验动物伦理委员会的相关规定进行。
1.2 药品试剂与仪器
培哚普利片购自武汉能仁医药化工有限公司,石杉碱甲片购自上海复旦复华科技有限公司,iNOS、nNOS试剂盒购自上海沪震生物有限公司,标准型脑立体定向仪购自深圳市瑞沃德(RWD)生命科技有限公司。
1.3 动物分组及模型
将30只4月龄APPswe/PS1dE9痴呆小鼠随机分为模型组、培哚普利组(1mg/kg·d)、石杉碱甲组(0.3mg /kg·d)[5],另选择同等数量的健康野生4月龄雄性小鼠作为正常组。模型组及正常组给予等体积生理盐水灌胃。每日灌药 1次,连续 4个月。
1.4 小鼠空间学习记忆能力测试
各组小鼠在末次给药后次日进行 Morris 水迷宫探求小鼠的学习和记忆能力。恒温游泳池直径110cm,高50cm,深30cm,池壁周围涂上黑漆,将池壁分为四个象限,选取任意象限,在该象限放一直径8cm,高20cm的白色小鼠站台,测试前使水温保持25℃,水内放入牛奶混匀。将小鼠分别从4个不同象限面壁入水,记录小鼠在60s内寻找平台所需的时间(逃避潜伏期)。若时间超过60s,则指导动物到平台并停留10s,此时潜伏期记为60s。以4个不同象限的平均值作为该次的逃避潜伏期,记录小鼠的空间学习能力。测试历时5d,每天训练一次。同理移去原平台进行空间探索实验,记录小穿越原平台位置的次数及在原平台所在象限的停留时间,记录小鼠对原平台的空间记忆情况。
1.5 脑组织NOS含量测定
Morris水迷宫测试后采用颈椎脱臼法处死小鼠,将其放置在标准型脑立体定位仪上,仔细分离出海马,依据试剂盒要求处理小鼠海马组织,测定其中iNOS和nNOS含量。
1.6 统计学方法

2 结果
2.1 培哚普利对痴呆小鼠学习记忆的影响
见表1~2。

表1 各组小鼠逃避潜伏期的比较±s)
注:与正常组相比,**P<0.05,*P<0.05;与模型组相比,△△P<0. 01,△P<0.05。
从表1可知,与正常组比较,模型组各个时间点小鼠的逃避潜伏期的差异有统计学意义(P<0.1),并且随着时间的延长,各个组的潜伏期不断缩短,表明模型组小鼠学习记忆出现障碍。各治疗组与模型组比较,潜伏期均缩短,差异有统计学意义(P<0.01)。说明培哚普利组与石杉碱甲组均能使小鼠逃避潜伏期缩短,但二者效果相当,没有明显差别。

表2 各组小鼠原平台穿越次数和象限停留 时间比较
注:与正常组相比,**P<0.01,*P<0. 05;与模型组相比,△△P<0.01,△P<0.05。
由表2可知,与正常对照组比较,模型组原平台象限停留时间及穿越次数明显减小,并且呈现显著性差异(P<0.01),表明双转基因痴呆小鼠学习记忆能力明显减退,表现为一定的痴呆症状。与模型组相比,石杉碱甲组与培哚普利组均有统计学意义,但培哚普利组小鼠原平台象限停留时间明显延长,原平台穿越次数显著增多,即培哚普利组效果更显著(P<0.01)。
2.2 培哚普利对痴呆小鼠大脑海马内iNOS及nNOS的影响
见表3。
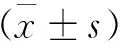
表3 各组小鼠大脑海马内iNOS及nNOS的含量
注: 与正常组相比,**P<0.01,*P<0.05;与模型组相比,△△P<0.01,△P<0.05。
从表3可知,模型组与正常组比较脑组织iNOS和nNOS含量均显著增加,说明痴呆小鼠脑组织中iNOS和nNOS表达水平升高,从而造成神经细胞死亡。与模型组相比,两治疗组中iNOS和nNOS含量均降低,但培哚普利组更明显(P<0.01),说明两组药均能减轻iNOS和nNOS对大脑的损害,但培哚普利效果更好。
3 讨论
肾素—血管紧张素系统(renin-aangiotensin-system,RAS)对人体的体液调节系统有重要作用。肾素在血管紧张素原的作用下生成血管紧张素I(AngI),AngI在血管紧张素转换酶(ACE)的作用下,生成血管紧张素Ⅱ(AngⅡ)。AngⅡ有两个受体: 血管紧张素受体1(AT1R) 和血管紧张素受体2(AT2R) 。AngⅡ主要作用于AT1R,可以导致血管收缩和内皮功能紊乱[6],并产生氧化应激而损害脑血管功能[7]。ACEI类药物主要抑制ACE,使AngⅡ的合成减少,从而减轻其对脑组织和神经元的破坏。有资料表明[8],能作用于中枢神经系统的血ACEI类药物如卡托普利、福辛普利、赖诺普利、培哚普利、雷米普利等能通过血脑屏障,有效防止痴呆, 控制并减少氧化应激, 减轻脑组织炎症。本文通过Morris水迷宫实验,记录小鼠逃避潜伏期、小鼠空间探索试验的原平台穿越次数、象限停留时间。证实,在使用中枢性ACEI类药物培哚普利后,小鼠的学习记忆能力明显得到改善。
一氧化氮(nitricoxide,NO)是体内重要的信使分子,在体内由L- 精氨酸在一氧化氮合成酶(nitricoxidesynthase,NOS)的催化作用下生成。NOS有三种亚型[9]:即神经元型一氧化氮合成酶(nNOS)、诱导型一氧化氮合成酶(iNOS)、内皮型一氧化氮合成酶(eNOS)[10]。其中,nNOS和eNOS在生理条件下可正常表达,而iNOS在生理条件下不表达,只在病理条件下诱导表达,激活后会长时间大量合成NO。由于NO性质不稳定,实验条件下能检测到极少的含量,而NO的多少与NOS的活性呈正相关,固本实验对iNOS、nNOS的含量进行了检测,从而间接说明NO对小鼠认知功能的影响。
本实验发现转基因痴呆小鼠大脑中iNOS和nNOS均明显升高,表明炎症性刺激使iNOS和nNOS过度表达,使体内生成的NO增多,产生神经毒性;对其一般行为学观察发现,小鼠喜蜷卧,实验人员敲击鼠栅栏不予理睬,对气味及食物反应迟钝,并且在Morris水迷宫试验中表现出逃避潜伏期显著延长,原平台穿越次数和原平台象限停留时间显著缩短。猜测其机制可能为nNOS及iNOS激活产生的NO,激活凋亡级联反应通向细胞死亡的最后共同通路,诱导细胞凋亡,导致血管收缩,内皮细胞紊乱,从而使小鼠学习记忆功能出现障碍。而在使用培哚普利进行干预后,发现小鼠反应变得敏捷,一有声音即睁眼, 跑到栅栏张望, 在闻到食物香味时, 鼻腔作嗅物状。水迷宫实验结果也出现巨大反差,即小鼠平台逃避潜伏期缩短,原平台穿越次数和平台象限停留时间增多;同时发现痴呆小鼠脑中iNOS和nNOS含量均显著降低,推断培哚普利能通过小鼠的血脑屏障,抑制血管紧张素转换酶的作用,使血管紧张素Ⅱ生成减少,使其对AT1R受体的作用减弱,增加脑血流灌注,有对抗氧化应激,保护脑血管功能,有利于神经细胞分化、再生和存活,诱导神经元分化以及轴突生长,有利于损伤神经的功能修复,从而改善认知功能。
综上所述,培哚普利对APPswe/PS1dE9双转基因痴呆模型小鼠有显著的防治效果,能够抑制iNOS和nNOS的合成,从而降低脑组织NO的产生,提高小鼠学习认识能力,从而为今后老年痴呆的预防提供新的思路。
[1]杨立娟,姚艳英.社区老年痴呆的早期观察及护理对策[J].黑龙江医药科学,2006,29(6):86
[2]KerrDS,BevilaquaLR,BoniniJS,etal.AngiotensinIIblocksmemoryconsolidationthroughanAT2receptor-dependentmechanism[J].Psy-chopharmacology,2005,179(3):529-535
[3]DeBundelD,DemaegdtH,LahoutteT,etal.InvolvementoftheAT1re-ceptorsubtypeintheeffectsofangiotensinⅣandLVV-haemorphin7onhippocampalneurotransmitterlevelsandspatialworkingmemory[J].JNeurochem,2010,112(5):1223-1234
[4]OhruiT,TomitaN,Sato-NakagawaT,etal.EffectsofbrainpenetratingACEinhibitorsonAlzheimerdiseaseprogression[J].Neurology,2004,63(7):1324-1330
[5]杨春荣,郑素芹.离心超滤法测定石杉碱甲固体脂质纳米粒的包封率[J].黑龙江医药科学,2009,32(3):752
[6]张淑萍,王昆祥.社区老年痴呆的早期观察及护理对策[J].黑龙江医药科学,2010,33(5):33
[7]王莹,边迪.血管性痴呆药物治疗最新进展[J].黑龙江医药科学,2014,37(4):107-108
[8]YamadaK,UcjodaS,TakahashiS,etal.Effectofacentrallyactiveangiotensin-convertingenzymeinhibitorperindopriloncognitiveperformanceinamousemodelofAlzheimer'sdisease[J].BrainRes, 2010,1352:176-186
[9]SamdsniAF,DawsonTM,DawonVL.Nitricoxidesynthaseinmodelsoffocalischemia[J].Stroke,1997,28:1283-1284
[10]RahHC,JeonYJ,LeeWS,etal.Associationofnitricoxidesynthasegenepolymorphisms( -786T>C,4a4b,894G>T)withprimaryovarianinsufficiencyinKoreanwomen[J].Maturitas,2013,74(2):160-165
黑龙江省自然科学基金项目,编号:C2012-42。
张腾腾(1988~)女,黑龙江齐齐哈尔人,在读硕士研究生。
张淑萍(1969~)女,黑龙江佳木斯人,硕士,主任医师,硕士研究生导师。E -mail:blcldxn@163.com。
R742
B
1008-0104(2017)02-0025-02
2017-01-05)

