奇异南星再生体系的建立
张一鸣,林昱星,张璐,肖泽丰,王俊丽
(中央民族大学 生命与环境科学学院,北京 100081)
奇异南星再生体系的建立
张一鸣,林昱星,张璐,肖泽丰,王俊丽
(中央民族大学 生命与环境科学学院,北京 100081)
为了保护和利用野生奇异南星资源,建立了奇异南星的再生体系.以奇异南星叶柄作为外植体,通过器官发生途径,探讨了不同植物生长调节剂对愈伤组织、不定芽及不定根的诱导效应.研究结果表明,诱导愈伤组织的适宜培养基为MS+6-BA 1.0 mg/L+2,4-D 1.0 mg/L;诱导不定芽和不定根分化的适宜培养基均为MS+IAA 0.5 mg/L+6-BA 0.5 mg/L,不定芽诱导率达82%,生根率达到100%.
奇异南星;愈伤组织;不定芽诱导;生根培养
奇异南星(ArisaemadecipiensSchott)又称铁灯台、青脚莲,是天南星科(Araceae)天南星属(Arisaema)植物,产于云南西北部(贡山、德钦至腾冲)和广西容县,生于海拔880~3 400 m的山坡灌丛中.印度也有分布.奇异南星的根茎入药,主治无名肿毒、乳腺炎、痈疽、毒蛇咬伤、蜂蝎螫伤、蜘蛛及老鼠咬伤[1]168.
天南星属约有150余种植物,大都分布于亚洲热带、亚热带和温带,少数产于热带非洲,中美和北美也有数种.中国有82种,其中59种系中国特有,以云南分布的种类最为丰富(40种),其次为四川(33种)、西藏(19种)、湖北(14种)[1]116.中国药典收载了天南星(Arisaemaerubescens)、异叶天南星(A.heterophyllum)、东北天南星(A.amurense)3 种植物.
为了有效扩大奇异南星种源,可以通过组织培养技术,建立奇异南星高效再生体系.目前已有多种植物通过组织培养技术建立了再生体系,如新疆雪莲[2]、胭脂花[3]、长春花[4]、Harpagophytumprocumbens[5]、Violauliginosa[6]等.
本研究的目的在于以野生奇异南星为材料,建立组织培养再生体系,为奇异南星开发利用奠定基础.
1 材料与方法
1.1 植物材料的选取与消毒处理
奇异南星种子采于广西壮族自治区靖西县龙邦镇.将采集的种子先用流动自来水冲洗 1 h,再用蒸馏水浸泡24 h后,于超净工作台内用体积分数为75%的乙醇浸泡30 s,再用质量分数为0.1%的 HgCl2消毒7 min,最后用无菌水冲洗3次.
1.2 培养条件及培养方法
实验所用培养基为MS培养基,pH值为5.8~6.2,121 ℃灭菌20 min.将消毒后的种子接种于上述培养基中,在温度为(25±2) ℃、光照时间为12 h/d、光照强度为3 000~4 000 lx条件下进行培养,30 d后可获得无菌苗.
1.2.1 愈伤组织的诱导
在超净工作台内,将奇异南星无菌苗的叶片切成0.5 cm×0.5 cm大小的切块,将叶柄切成0.5 cm长的切段,分别接种到MS+6-BA 1.0 mg/L+2,4-D 1.0 mg/L培养基中,进行愈伤组织诱导.
1.2.2 不定芽的诱导
将愈伤组织分别接种于单独添加6-BA、TDZ(0、0.5、1.0、2.0、4.0 mg/L)的MS培养基中进行培养,或接种到MS+IAA+6-BA和MS+IAA+TDZ培养基中进行不定芽的诱导.每个处理接种50块愈伤组织,重复3次.30 d后统计结果.
1.2.3 生根培养
以MS+IAA 0.5 mg/L+6-BA 0.5 mg/L培养基作为生根培养基.选取3 cm左右生长茁壮的不定芽接入培养基中,每次接种50个不定芽,重复3次.30 d后统计生根率及根长.
1.2.4 炼苗与移栽
将生根后的再生植株移栽至V(泥炭土)∶V(珍珠岩)∶V(沙)=4∶3∶2的混合基质中,置于相对湿度为80%~90%、温度为20 ℃左右的环境中培养.移栽30 d后统计成活率.
2 结果与分析
2.1 愈伤组织的诱导
研究发现,在愈伤组织诱导过程中,叶片外植体先膨大,2周后逐渐褐化死亡,这表明叶片不适合做外植体.叶柄外植体则可诱导出愈伤组织.培养1周后,叶柄外植体开始膨大,2周后切口2端开始出现愈伤组织.4周后将愈伤组织在MS+6-BA 1.0 mg/L +2,4-D 1.0 mg/L培养基中进行继代培养,愈伤组织可快速增殖(图1a),每4周继代1次.
2.2 不定芽的诱导
2.2.1 单一植物生长调节剂对不定芽诱导的影响
在单独添加6-BA质量浓度为0、0.5、1.0、2.0、4.0 mg/L的MS培养基中,2周后愈伤组织可以分化出不定芽(图1 b),其诱导率为15.67%~36.67%.当6-BA质量浓度为0.5 mg/L时,诱导率最高,为36.67 %.当6-BA质量浓度升高到4.0 mg/L时,诱导率最低,仅为15.67%(图2).

a.愈伤组织;b.不定芽;c.不定根;d.移栽后的植株.图1 奇异南星愈伤组织的诱导及植株再生Fig.1 Callus induction and plant regeneration of Arisaema decipiens
将愈伤组织分别接种于TDZ质量浓度为0、0.5、1.0、2.0、4.0 mg/L的培养基中进行培养,接种1周左右,愈伤组织逐渐变绿,表面有颗粒状突起,2周后,形成不定芽,其诱导率为21.33%~48.67%.当TDZ质量浓度为2.0 mg/L时,诱导率最高,可达到48.67%(图3).
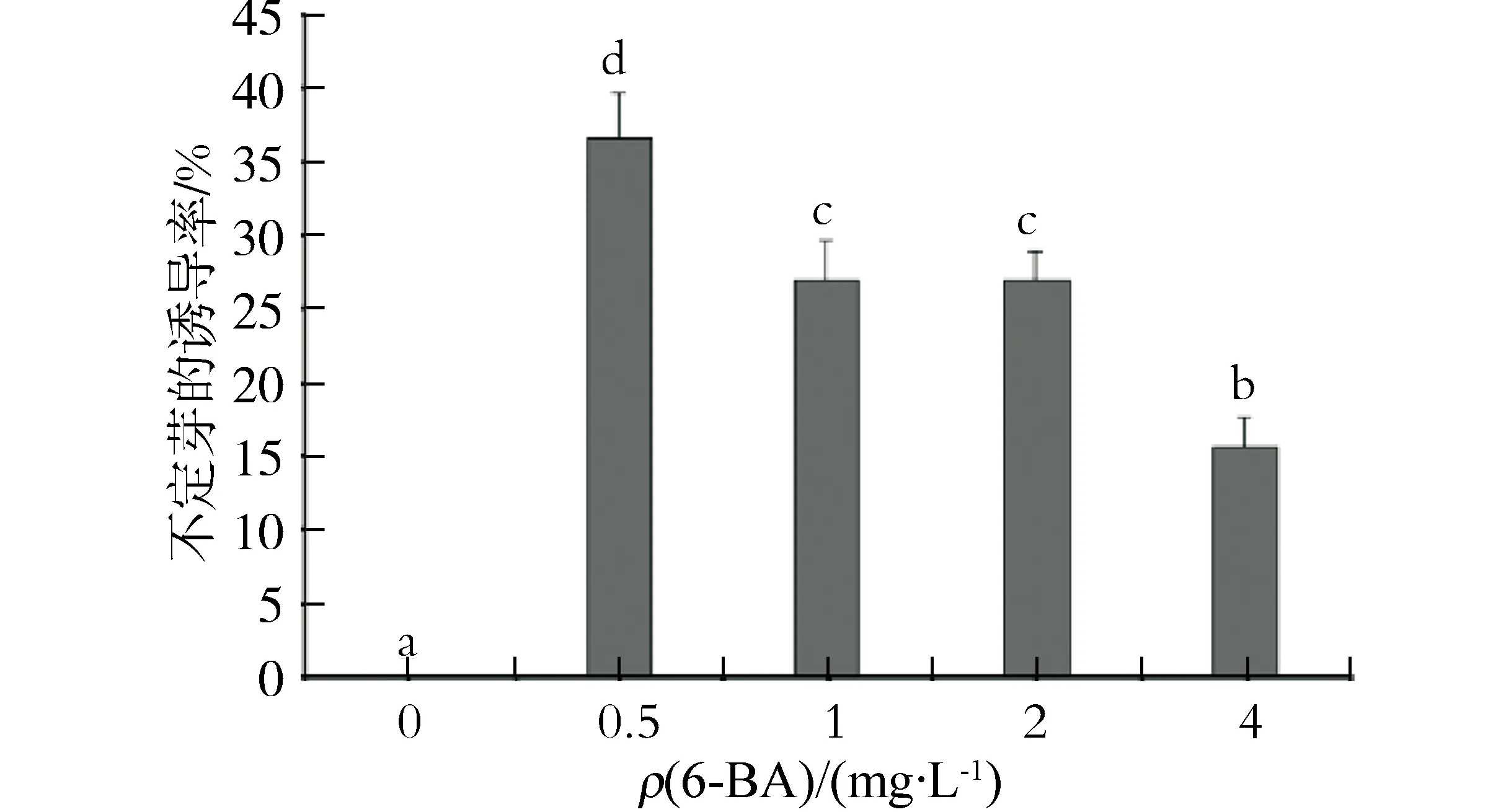
数据以表示,P<0.05,标有相同字母的数据表示差异不显著,标有不同字母的数据表示差异显著.
2.2.2 IAA与6-BA组合对不定芽分化的影响
将愈伤组织分别接种于含有0、0.5、1.0、2.0、4.0 mg/L IAA和6-BA的MS培养基中,愈伤组织表面出现球状突起,很快形成不定芽(图1b).当IAA和6-BA的质量浓度均为0.5 mg/L时,诱导率最高,可达82.00 %(图4),并且不定芽的生长状况良好,叶柄较粗,叶片较大,生长旺盛.因此,诱导不定芽的最佳培养基为MS+IAA 0.5 mg/L+6-BA 0.5 mg/L.
2.2.3 IAA与TDZ组合对不定芽分化的影响
在添加IAA和TDZ(0、0.5、1.0、2.0、4.0 mg/L)的诱导培养基中,不定芽的诱导率为18.00%~66.00%.当IAA和TDZ的质量浓度均为0.5 mg/L时,诱导率最高,可达到66 .00%(图5).该组合的诱导效果不及IAA+6-BA.
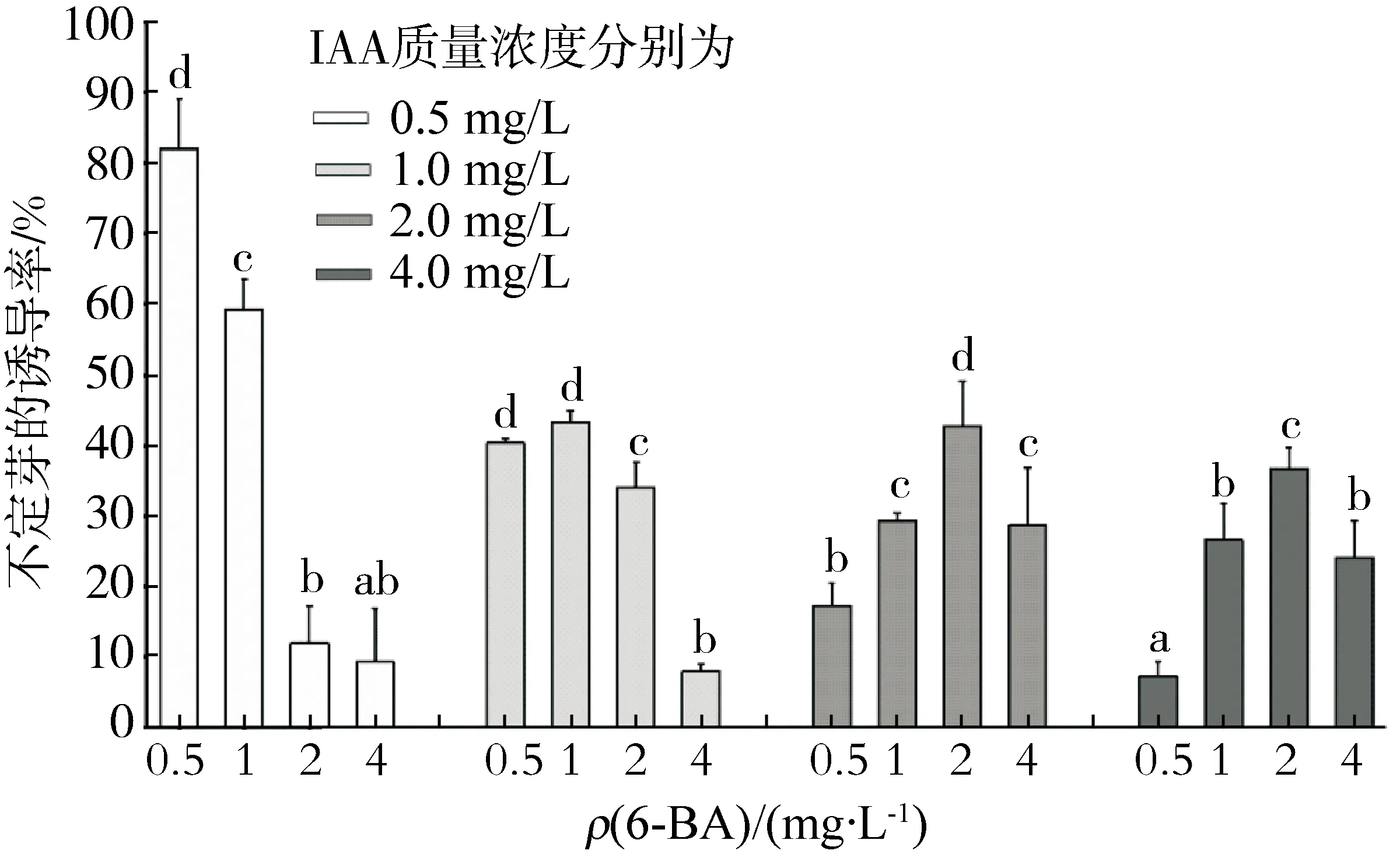
图4 IAA与6-BA组合对不定芽诱导的影响Fig.4 Effects of IAA in combination with 6-BA on adventitious shoots induction
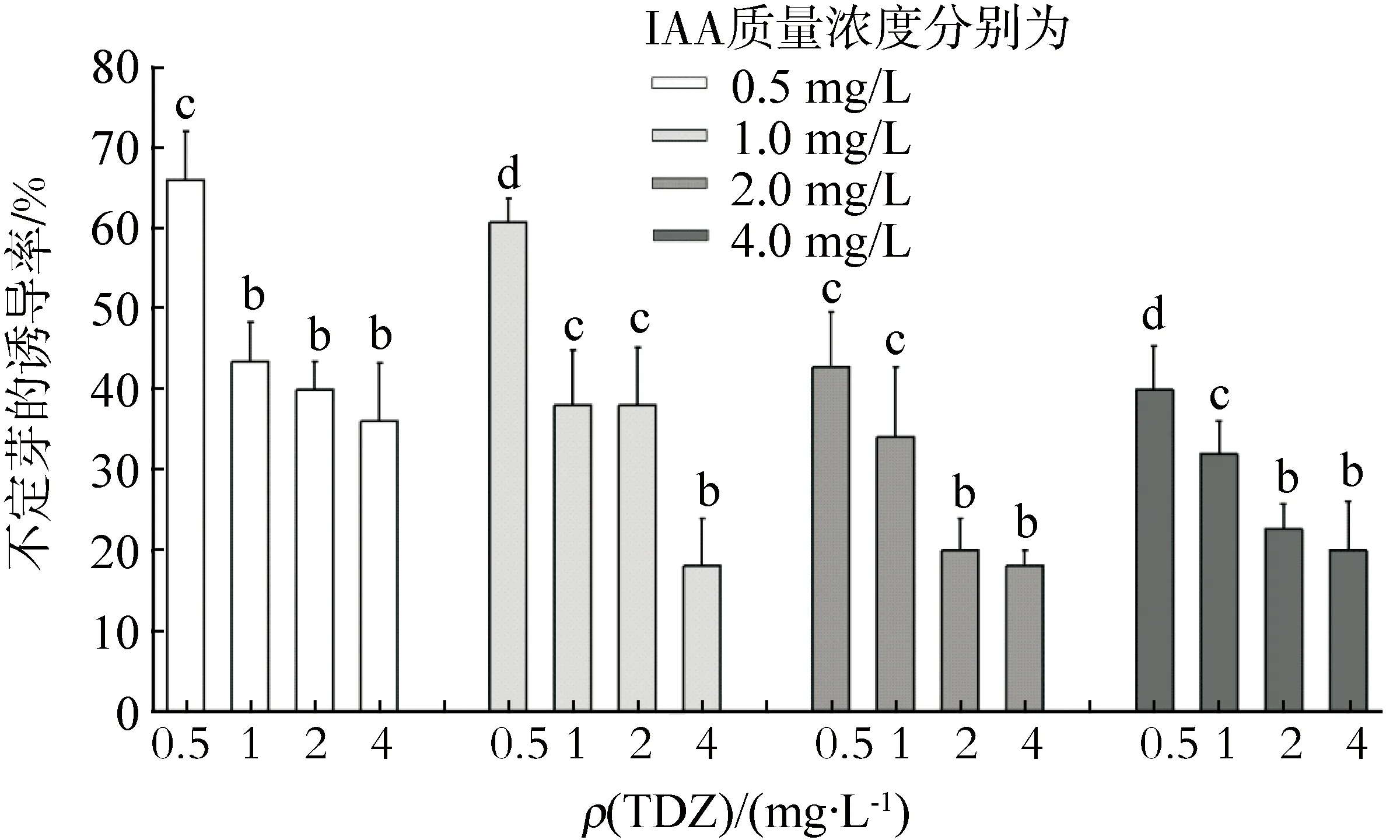
图5 IAA与TDZ组合对不定芽诱导的影响Fig.5 Effects of IAA in combination with TDZ on adventitious shoots induction
2.3 生根培养
选取3 cm左右的不定芽接种到MS+IAA 0.5 mg/L+6-BA 0.5 mg/L培养基中进行不定根的诱导,5~7 d开始出现白色根尖,随后根尖伸长,30 d时长出10条左右淡黄色的不定根,呈辐射状分布,生根率达100%.大多数根长为7~10 cm,粗壮(图1c).
2.4 炼苗及移栽
将三角瓶的瓶口打开,再生苗炼苗1周.然后小心洗净根部的培养基,尽量减少对根系的损伤,将再生植株移栽至V(泥炭土)∶V(珍珠岩)∶V(沙)=4∶3∶2的混合基质中,置于相对湿度为80%~90%、温度为20 ℃左右的环境中培养,30 d后成活率达100%(图1d).
3 讨论
本研究发现,将奇异南星叶柄外植体在MS+6-BA 1.0 mg/L+2,4-D 1.0 mg/L培养基中进行诱导培养时,可诱导出愈伤组织,在此培养基上进行继代培养时,愈伤组织可快速增殖.梁宇等[7]以东北天南星嫩叶为外植体进行组织培养时发现,在添加2.0 mg/L 6-BA和 0.5 mg/L 2,4-D的1/2MS培养基中愈伤组织的诱导率为85%.这表明6-BA和2,4-D配合有利于天南星属植物愈伤组织的诱导.王俊丽等[8]研究发现,当6-BA与低浓度2,4-D配合使用时,对华北大黄愈伤组织的增殖效应十分明显,其中MS+6-BA 2.0 mg/L+2,4-D 0.2 mg/L培养基的增殖效果最好.这些研究结果表明,6-BA和2,4-D配合有利于愈伤组织的诱导,但植物种类不同,对其浓度要求也不同.
在不定芽诱导过程中,培养基中单独添加6-BA或TDZ均可诱导出不定芽,但最高诱导率分别为36.67%和48.67%,诱导率较低.研究发现,培养基同时添加较低浓度的IAA和6-BA或TDZ时,不定芽的诱导率明显提高.当IAA质量浓度为0.5 mg/L、6-BA质量浓度为0.5~1.0 mg/L时,不定芽的诱导率为59.33%~82.00%.当IAA质量浓度为0.5~1.0 mg/L、TDZ质量浓度为0.5 mg/L时,不定芽的诱导率为60.67%~66.00%.可见,IAA与6-BA配合使用时更有利于奇异南星不定芽的诱导.
李卉等[9]以峨眉山野生一把伞南星茎尖作为外植体,研究了不同植物生长调节剂的诱导作用,发现MS+IAA 2.0 mg/L+6-BA 1.0 mg/L培养基对茎尖诱导愈伤组织效果较好,这表明IAA与6-BA配合使用时,对不同植物、不同外植体的诱导作用是不同的.
本研究以奇异南星叶柄为外植体进行组织培养研究,探索出了愈伤组织、不定芽和不定根诱导的适宜培养基,建立了再生体系,这为野生奇异南星的开发与利用奠定了基础.
[1] 中国科学院中国植物志编辑委员会.中国植物志(第13卷:第2分册)[M].北京:科学出版社,1979:116,168.
[2] GUO B,GAO M,LIU C Z.In vitro propagation of an endangered medicinal plant Saussurea involucrata Kar.et Kir [J].Plant Cell Rep,2007,26(3):261-265. DOI 10.1007/s00299-006-0230-6.
[3] 宋韵霏,王俊丽,毕凯丽,等.胭脂花的组织培养与植株再生[J].河北大学学报(自然科学版),2012,32(6):630-634. SONG Y F,WANG J L, BI K L,et al.Tissue culture and plant regeneration ofPrimulamaximowiczii[J].Jornal of Hebei University (Natural Science Edition),2012,32(6):630-634.
[4] DHANDAPANI M,KIM D H,HONG S B.Efficient plant regeneration via somatic embryogenesis and organogenesis from the explants ofCatharanthusroseus[J].In Vitro Cell Dev Biol- Plant,2007,44(1):18-25. DOI 10.1007/s11627-007-9094-x.
[5] GRABKOWSKA R,SITAREK P,WYSOKIN′SKA H.Influence of thidiazuron (TDZ) pretreatment of shoot tips on shoot multiplication and ex vitro acclimatization ofHarpagophytumprocumbens[J].Acta Physiol Plant,2014,36(7):1661-1672.DOI 10.1007/s11738-014-1541-9.
[6] SLAZAK B,SLIWINSKA E,SALUGA M,et al.Micropropagation ofViolauliginosa(Violaceae) for endangered species conservation and for somaclonal variation-enhanced cyclotide biosynthesis[J].Plant Cell Tiss Organ Cult,2014,120(1):179-190.DOI 10.1007/s11240-014-0592-3.
[7] 梁宇,顾地周,刘秀岩,等.东北天南星的离体培养与快速繁殖[J].植物生理学通讯,2008,44(4):751-752.DOI 10.13592/j.cnki.ppj.2008.04.042. LIANG Y,GU D Z,LIU X Y,et al.In vitro culture and rapid propagation ofArisaemaamurenseMaxim [J].Plant Physiology Communications,2008,44(4):751-752. DOI 10.13592/j.cnki.ppj.2008.04.042.
[8] 王俊丽,陆远,刘坤,等.华北大黄愈伤组织培养及土大黄苷含量研究[J].河北大学学报(自然科学版),2011,31(2):195-199. WANG J L,LU Y,LIU K,et al.Callus proliferation and rhaponticin accumulation ofRheumfranzenbachiiMunt [J].Jornal of Hebei University (Natural Science Edition),2011,31(2):195-199.
[9] 李卉,李仲芳,刘芳,等.一把伞南星组织培养研究[J].安徽农业科学,2007,35(8):2231,2236 . DOI 10.13989/j.cnki.0517-6611.2007.08.016. LI H,LI Z F,LIU F,et al.Study on culture condition ofArisaemaerubescens(Wall.) [J].Journal of Anhui Agricultural Sciences,2007,35(8):2231,2236.DOI 10.13989/j.cnki.0517-6611.2007.08.016.
(责任编辑:赵藏赏)
Establishment of regeneration system ofArisaemadecipiensSchott
ZHANG Yiming,LIN Yuxing,ZHANG Lu,XIAO Zefeng,WANG Junli
(College of Life and Environmental Sciences,Minzu University of China,Beijing 100081,China)
For protection and utilization of the wildArisaemadecipiensSchott,a regeneration system was developed.The effects of different plant growth regulators on callus,adventitious shoot and root induction were investigated by organogenesis using petiole as explants.The results showed that the optimal medium of callus induction was MS+6-BA 1.0 mg/L+2,4-D 1.0 mg/L.The suitable medium for adventitious shoots induction was MS+IAA 0.5 mg/L +6-BA 0.5 mg/L,and the induction rate of adventitious shoots reached at 82%.Up to 100% of the regenerated shoots formed complete plantlets on MS+IAA 0.5 mg/L+6-BA 0.5 mg/L medium.
Arisaemadecipiens;callus;adventitious shoots;rooting culture
2016-07-25
国家重大科学仪器设备开发专项(2012YQ03026108);高等学校学科创新引智计划资助项目(B08044);一流大学一流学科建设项目(YLDX01013)
张一鸣(1986—),男,辽宁本溪人,中央民族大学在读博士研究生.E-mail:61705358@qq.com
王俊丽(1964—),女,河北新乐人,中央民族大学教授,博士生导师,主要从事植物细胞工程及资源利用研究. E-mail:wangjunli1698@163.com
10.3969/j.issn.1000-1565.2017.03.007
Q945
A
1000-1565(2017)03-0262-05

