Xp11.2易位/TFE3基因融合相关性肾癌的CT与MRI表现
高凯波GAO Kaibo
赵秀丽2ZHAO Xiuli
叶慧义3YE Huiyi
王海屹3WANG Haiyi
常瑞萍3CHANG Ruiping
Xp11.2易位/TFE3基因融合相关性肾癌的CT与MRI表现
高凯波1GAO Kaibo
赵秀丽2ZHAO Xiuli
叶慧义3YE Huiyi
王海屹3WANG Haiyi
常瑞萍3CHANG Ruiping
目的探讨Xp11.2易位/TFE3基因融合相关性肾癌(Xp11.2易位性肾癌)的CT与MRI表现。资料与方法回顾性分析经病理证实的18例Xp11.2易位性肾癌患者。10例行CT扫描,其中单纯平扫2例,平扫及增强扫描8例;14例行肾脏MRI平扫及多期多时相扫描,含同时CT平扫2例、CT平扫及增强扫描4例。观察Xp11.2易位性肾癌瘤体的部位、大小、形态、密度/信号特征及血供、强化方式。结果18例18个病灶均位于皮髓质,实性17个,囊实性1个。病灶最大径平均(4.6±2.0)cm;圆形或类圆形病灶13个,不规则形或分叶状病灶5个。10个病灶CT平扫呈稍高/高密度,平均CT值为(50.6±11.5)HU,4个病灶见钙化;8个病灶CT增强扫描示多血供1个,少血供7个。MRI示14个病灶信号表现多样,均见不同范围稍短/短T1、稍短/短T2信号,增强扫描以髓质期持续强化为主要表现。根据病变主要信号特点及血供情况分3种类型(1个囊实性病灶除外):①以短T1短T2信号为主型病灶5个,为少血供;②以稍长T1稍T2信号为主型病灶4个,均为多血供;③以等T1等T2信号为主型病灶4个,均为相对少血供。结论Xp11.2易位性肾癌CT 、MRI表现有一定的特征,当CT平扫发现位于皮髓质稍高/高密度结节或肿块,MRI表现为信号多样伴有不同范围稍短/短T1、稍短/短T2信号特征,并以髓质期持续强化为特点时,结合临床可提示诊断。
肾肿瘤;易位,遗传;体层摄影术,螺旋计算机;磁共振成像
Xp11.2易位/结合免疫球蛋白重链恒定区μ基因增强子的转录因子3(transcription factor bindingto IGHM enhancer 3,TFE3)基因融合相关性肾癌(Xp11.2易位性肾癌)是2004年WHO肾细胞癌病理组织学分类中新增的类型,其命名来源于肿瘤中均含有染色体Xp11.2易位形成的融合基因,好发于儿童和青少年,临床罕见[1]。因本病临床症状、病理学表现、生物学行为及预后均有别于这2种肾癌,故术前影像提示诊断具有一定的价值[2-3]。本研究回顾性分析18例经手术病理证实的Xp11.2易位性肾癌患者的影像资料,探讨其影像学表现,以增加对本病的认识。
1 资料与方法
1.1 研究对象 收集2008年12月-2015年8月解放军总医院经手术及病理证实为Xp11.2易位性肾癌患者18例,其中男6例,女12例;年龄9~56岁,平均(32.2±15.2)岁。临床表现:右侧腰痛伴肉眼血尿1例,无痛性肉眼血尿4例,体检发现13例;尿常规示7例尿红细胞阳性。后腹腔镜根治性肾切除术11例,瘤肾部分切除术7例。
1.2 检查方法
1.2.1 CT检查 采用Siemens Sensation Cardiac 64螺旋及Philips 256 CT扫描仪检查。扫描前5 min口服清水500 ml。管电压120 kV,管电流300 mA,层厚5 mm,无间距扫描,螺距1.375。增强扫描对比剂采用碘海醇(300 mgI/ml),以3.5 ml/s经静脉团注90 ml,注射对比剂后25~30 s、120~180 s分别行动脉期、实质期扫描,必要时5.0 min后行排泄期扫描。
1.2.2 MRI检查 6例采用GE HD Excite 1.5T MR扫描仪,8例采用3.0T MR扫描仪。使用腹部8通道相控阵线圈,患者取仰卧位,T2WI采用呼吸触发脂肪抑制快速自旋回波序列:TR 2000~6000 ms,TE 80~104 ms,回波链长度8~16,矩阵320×224,层厚5~6 mm,间距1 mm,视野(FOV)36 cm×36 cm~40 cm×40 cm。化学位移成像采用快速梯度回波序列,矩阵256×192,层厚、间距及FOV同T2WI。多时相动态增强扫描采用三维肝脏加速容积采集序列,40~44层,屏气9~11 s。对比剂采用钆喷替酸葡甲胺,剂量为0.1 mmol/kg,采用高压注射器以1.5 ml/s经肘静脉团注。注射后18~20 s行皮质期扫描,髓质期及延迟期分别于注射造影剂后50~60 s及240 s扫描。8例患者行扩散加权成像(DWI)检查,b值为 800 s/mm2,TR 4600 ms,激励次数1,层厚、间距及FOV同T2WI。
1.3 图像分析 由3名影像科副主任医师共同阅片,达成一致意见。观察CT/MRI图像上病变的部位、形态、大小、密度/信号特征、肿瘤强化情况及侵犯范围等。病变CT密度高低、MRI信号强度判定均参照对侧正常肾实质。血供判断标准:皮质期强化程度接近肾皮质为多血供,强化程度低于肾皮质为少血供。CT强化程度分级标准:<10 HU为无强化,10~20 HU为轻度强化,21~30 HU为中等强化,>30 HU为明显强化。MRI强化程度判断:皮质期接近肾皮质为中度至明显强化,高于髓质明显低于皮质为轻至中度强化,低于髓质为轻度强化或强化不明显。病理资料由2名病理科主任医师综合分析。
2 结果
2.1 影像学表现
2.1.1 生长部位、大小、形态 18例18个病灶,均为单发,实性17个,囊实性1个;病灶最大径1.7~7.3 cm,平均(4.6±2.0)cm;形态以圆形或类圆形为最多见,共13例,呈不规则形或分叶状5例。生长部位、方式见表1。

表1 18例Xp11.2易位性肾癌生长部位、方式(个)
2.1.2 CT表现 10例行CT扫描,其中单纯CT平扫2例,平扫及双期双时相扫描5例,平扫及多期多时相扫描3例,共10个病灶。平扫实性部分均为稍高或高密度,病变CT值为36~75 HU,平均(50.6±11.5)HU。4个病灶可见钙化,其中外周部点状钙化3个,小环形钙化1个。明显高密度病灶6个,平扫CT值为51~75 HU(图1A),其中5个病灶行增强扫描表现为少血供病变,2个病灶皮质期轻度强化,CT值增幅为11 HU、19 HU(图1B),实质期前者延迟中度强化,后者廓清;3个病灶皮质期明显强化,CT值增幅为32 HU、38 HU、40 HU,实质期均廓清。稍高密度病灶4个,平扫CT值为36~44 HU,其中3个病灶行增强扫描,2个病灶表现为少血供,增强后CT值增幅分别为12 HU、29 HU,实质期两者均廓清;1个病灶表现为相对多血供,皮质期明显强化,CT值增幅为93 HU,实质期廓清。
2.1.3 MRI表现 14例行肾脏MRI平扫及多期多时相扫描,含同时CT平扫2例、CT平扫及增强扫描4例。14例14个病灶信号表现多样,均见不同范围稍短/短T1、稍短/短T2信号,尤以稍短/短T2信号为最特征表现,增强扫描以髓质期持续强化为主要表现。根据病变主要信号特点及血供情况分3种类型:①以短T1短T2信号为主病灶5个(图1C、2A),T2WI示2个病灶低信号背景中边缘或近中央见结节样稍高信号呈“瘤中结”改变(图1C)、3个病灶见高低信号相间伴行呈“条纹征”(图2A)。5个病灶均表现为少血供,增强扫描病灶整体呈皮质期轻度强化-髓质期持续强化-延迟期廓清特征,其中1个病灶靠边缘瘤中结节皮质期中度至明显强化-髓质期持续强化-延迟期廓清(图1D)、1个病灶靠中央瘤中大结节皮质期点状中度至明显强化-髓质期结节渐进性充填强化-延迟期结节全部充填强化(幅度下降)。②以稍长T1稍长T2信号为主4个病灶(图3A),均表现为相对多血供,增强扫描皮质期中度-明显强化(接近肾皮质),2个病灶髓质期持续强化(图3B),延迟期廓清;2个病灶髓质期边缘略廓清,延迟期进一步廓清。③以等T1等T2信号为主病灶4个(图4A),均表现为相对少血供,增强扫描皮质期轻至中度强化(图4B),2个病灶髓质期廓清,延迟期进一步廓清;2个病灶髓质期持续强化,延迟期1个病灶持续强化、1个病灶廓清。1个囊实性病灶实性结节信号及强化方式同第③种类型。所有病灶DWI呈不均匀晕环结节样稍高和明显高信号。
12个病灶边缘出现短T2信号且延迟强化,考虑为假包膜,所有病灶假包膜与肾实质接触面均不完整(图4A);7个病灶中见灶状和片状短T1信号,提示出血(图2B);6个病灶出现不同程度囊变,1个病灶囊变位于周边、5个病灶囊变散在分布。化学位移成像有3个病灶出现片状信号差异,提示含有细胞内脂质。
2.1.4 CT平扫密度与MRI信号对照 6个病灶中,2个病灶CT平扫明显高密度影,CT值分别为56 HU、75 HU,对应MRI表现为①型;4个病灶CT平扫为稍高密度,CT值分别为36 HU、40 HU、42 HU、44 HU,对应MRI表现为②、③型。
2.1.5 其他征象 1例伴有右肾门区淋巴结转移,1例伴有右肾静脉及下腔静脉癌栓,1例伴有腰1椎体右侧附件骨转移,1例伴有右侧髂骨转移。

图1 女,34岁,Xp11.2易位性肾癌。CT平扫示病灶大部分均匀呈明显高密度,CT值为75 HU(A);增强扫描皮质期病变轻度强化,CT值为94 HU(B);T2WI示病变呈短T2信号为主,靠外侧缘见结节样稍长T2信号(箭),外周见短T2假包膜(C);增强扫描皮质期病变轻度强化,外周结节中度-明显强化(箭,D)
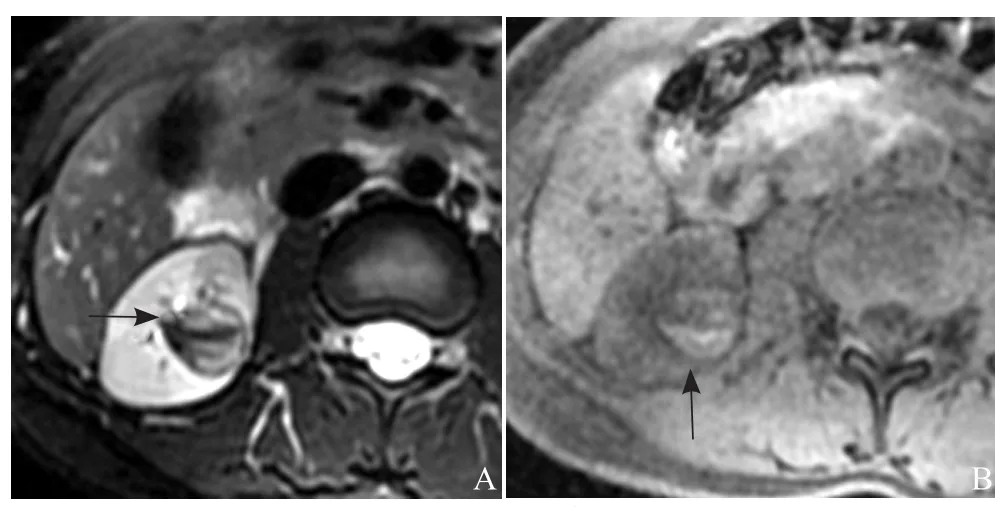
图2 女,28岁,Xp11.2易位性肾癌。T2WI示病灶以短T2信号为主,内见条片状长T2信号相间,呈“条纹征”(箭),外周见短T2假包膜(A);T1WI示病灶内见条片状短T1信号(箭),提示出血(B)
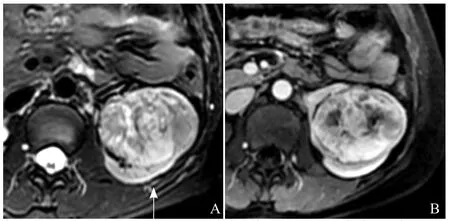
图3 女,44岁,Xp11.2易位性肾癌。T2WI示病变呈稍长T2信号为主,内见斑片状稍短T2异常信号(A);增强扫描髓质期病灶持续不均匀明显强化(B)
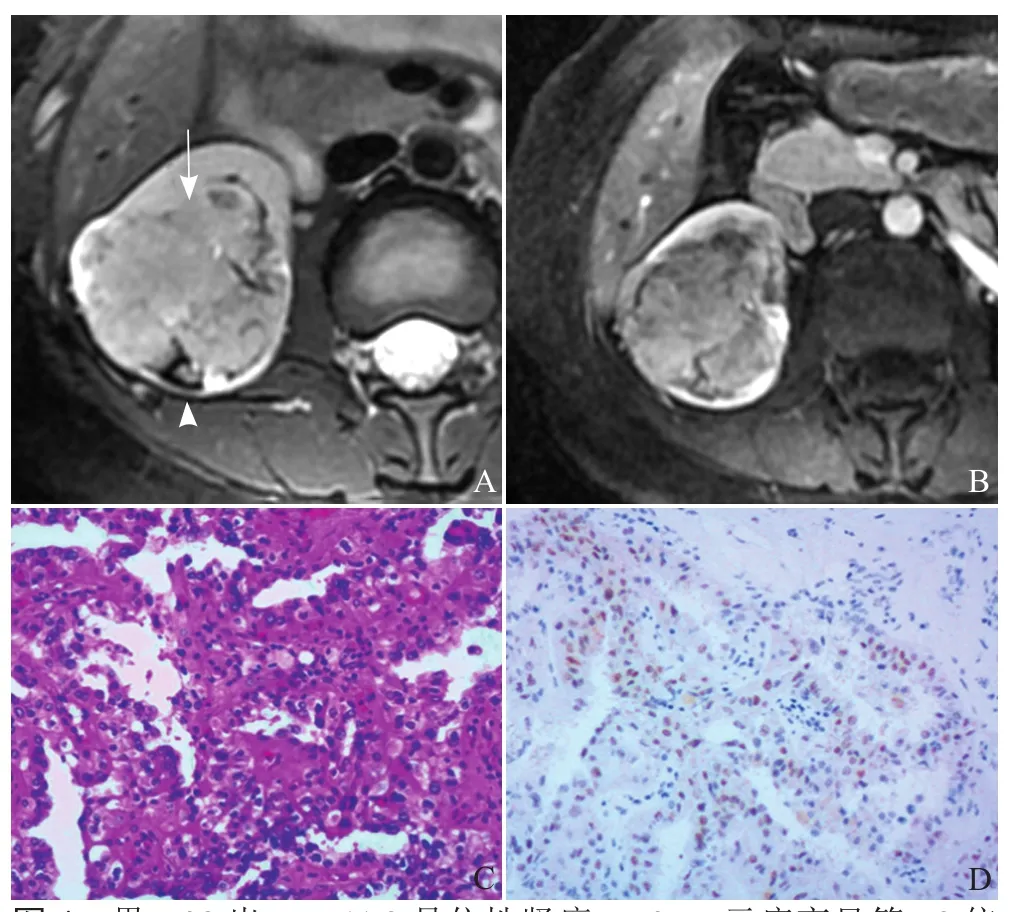
图4 男,38岁,Xp11.2易位性肾癌。T2WI示病变呈等T2信号为主,前部与肾实质接触面见短T2假包膜不完整(箭),后部见片状明显短T2信号(箭头,A);增强扫描皮质期示病变中度强化(B);病理示肿瘤细胞呈腺泡状及乳头状排列,胞质透明或见嗜酸性颗粒,核级高(HE,×200,C);免疫组织化学示TFE-3 肿瘤细胞核阳性表达(HE,×200,D)
2.2 病理表现 肿瘤切面大多呈黄褐色,常伴坏死和出血。常规HE染色切片表现为由透明细胞构成的乳头状结构,并伴有由含嗜酸性颗粒胞质的瘤细胞组成的巢状结构(图4C)。免疫组织化学示所有病例TFE-3(图4D)、CD10均(+)。
3 讨论
3.1 概述 Xp11.2易位性肾癌较罕见,占成年人肾癌的0.5%。儿童和青少年患者多见,其发病率在儿童肾癌患者中约占33.3%,好发于女性,男女性别比约为1∶4[4-6]。本研究男女性别比为1∶2,高于文献报道。本组患者平均年龄(32.2±15.2)岁,大部分为成年人,可能与本院为综合性医院,泌尿外科较少收治小儿患者有关。本病的发病机制目前尚不清楚,可能与既往有化疗病史相关[7]。然而,本组患者既往均无化疗药物接触史。本病临床症状与常见肾癌类似,同时具有肾癌三联征(肉眼血尿、腰痛、腹部肿块)罕见,大多数无症状,但出现肉眼血尿较肾透明细胞癌和乳头状肾细胞癌常见[3,8]。病理学特点:大体标本与常见肾癌相似,常规HE染色切片的特征表现为由透明细胞组成的乳头状结构,常伴有由含嗜酸性颗粒胞质的瘤细胞组成的巢状结构[9]。免疫组织化学肿瘤恒定表达TFE3和CD10[10]。Xp11.2易位性肾癌预后较肾透明细胞癌和乳头状肾细胞癌差[11],其治疗首选肾癌根治术,Rao等[12]研究发现Xp11.2易位性肾癌在诊断时多为T3/T4期,预后较差,故术后需行补充治疗。
3.2 Xp11.2易位性肾癌的影像学表现
3.2.1 病灶部位、大小、形态 Xp11.2易位性肾癌起源于肾小管上皮细胞,呈浸润性生长,病灶较小时局限于肾髓质,病灶较大时易累及肾盂,肾皮质受压并伴有破坏,但肾积水少见[13]。常见肾癌大部分肾脏轮廓增大,肿瘤部分可局限在肾实质内,但以突出肾轮廓向肾周生长常见[14]。本研究发现Xp11.2易位性肾癌所有病灶均位于皮髓质,病灶较小时局限在肾髓质内生长,病灶较大时以突向肾窦单向生长或肾窦肾周双向生长常见,其发生部位与生长方式可作为与常见肾癌的鉴别点之一。文献报道Xp11.2 易位性肾癌肿瘤最大径1.3~21 cm,形态多样,可为实性或囊实性,囊性区域可见乳头状结构[15-16],与本研究相符。
3.2.2 CT表现 系统研究Xp11.2易位性肾癌影像表现的报道较少[14],多数文献认为CT平扫肿瘤密度均高于正常肾实质,密度均匀或不均匀,可有钙化及坏死囊变[17-19]。本研究CT平扫10个病灶均呈稍高密度(4个)或明显高密度(6个),4个病灶外周见点状或小环形钙化,与Kato等[17]的报道相符。徐晓晨等[14]报道12例认为皮质期可明显强化且强化不均,但CT值增幅<50 HU。本研究中8个病灶增强扫描,7个病灶皮质期增幅<40 HU,与报道相符;1个病灶皮质期显著强化,增幅为93 HU,与报道不符。
3.2.3 MRI表现 Kato等[17]认为Xp11.2易位性肾癌MRI信号呈短T1短T2信号,且为少血供肿瘤,类似乳头状肾癌。本研究发现此类肾癌信号多样,内可见不同范围稍短/短T1、稍短/短T2信号,尤以稍短/短T2信号为特征表现,而且肿瘤血供与肿瘤内部T1、T2信号相关,具体表现为以下3种类型:①以短T1短T2信号为主,表现为少血供,此型与文献报道类似乳头状肾癌[17-18]相符。本研究发现此型5个病灶大部分信号欠均匀,T2WI见2个病灶低信号背景中结节样稍高信号呈“瘤中结”样改变,皮质期结节中度至明显强化,3个病灶见线条样高低信号相间伴行呈“条纹征”改变,可作为鉴别点。②以稍长T1稍长T2信号为主,表现为相对多血供,类似透明细胞癌,但可与透明细胞癌鉴别。第一,此型4个病灶平扫均可见片状或结节状稍短/短T1、稍短/短T2信号为其特点;第二,皮质期均低于或仅接近皮质强化,且强化幅度低于肾透明细胞癌;第三,髓质期持续强化并廓清较慢可作为鉴别点。③以等T1等T2信号为主,表现为相对少血供,此型与常见的透明和非透明细胞癌均不相似,可以做出提示性诊断。本研究发现Xp11.2易位性肾癌MRI表现中以①、③型相对多见,而②型相对少见,还需大样本病例进一步证实。
3.3 CT平扫密度与MRI信号对照 本研究发现CT平扫明显高密度时,MRI表现为短T1短T2信号为主、少血供。平扫稍高密度时,MRI主要表现为等T1等T2信号为主或稍长T1稍长T2信号为主2种类型,前者相对少血供,后者相对多血供。这种CT平扫高密度及T2WI低信号、T1WI轻度高信号是由于含铁血黄素、新鲜出血、蛋白液或少细胞等多种因素共同作用的结果[17,20]。因为上述成分无或少强化,故推测肿瘤血供多少可能与上述成分在瘤内分布的范围与数量相关,有待进一步证实。
3.4 假包膜、出血、囊变、脂肪变性 Xp11.2易位性肾癌形态多样,可为实性或囊实性,可见坏死、出血、钙化及假包膜[15]。本研究发现病灶假包膜、出血、囊变常见,脂肪变性可见,与报道相符。本研究还发现Xp11.2易位性肾癌假包膜发生率高的同时,所有假包膜与肾实质接触缘显示不完整,提示局部浸润性生长,与Liu等[19]的报道相符。因此,假包膜的不完整可作为与常见肾细胞癌鉴别点之一。
3.5 鉴别诊断 当Xp11.2易位性肾癌表现为CT稍高密度、MRI以稍长T1稍长T2信号为主且相对多血供时需与肾透明细胞癌鉴别。当Xp11.2易位性肾癌表现为CT明显高密度,短T1短T2信号为主且少血供时需与乳头状肾细胞癌鉴别。乳头状肾细胞癌平扫密度及信号相对均匀,而Xp11.2易位性肾癌T2WI见“瘤中结”改变及“条纹征”。乳头状肾细胞癌为低度恶性肿瘤,包膜相对完整,发生转移少见,而Xp11.2易位性肾癌大多数包膜不完整,提示恶性程度高,且常发生腹膜后及远处转移。当Xp11.2易位性肾癌CT高密度及T2WI低信号需与少脂肪的血管平滑肌脂肪瘤鉴别,后者一般无包膜、均匀/不均匀延迟强化可鉴别。
总之,Xp11.2易位性肾癌CT 、MRI表现有一定的特征,当CT平扫发现位于皮髓质稍高/高密度结节或肿块,MRI表现为信号多样伴有不同范围稍短/短T1、稍短/短T2信号特征,且髓质期持续强化为特点时,结合临床可提示诊断。
[1] Lopez-Beltran A, Scarpelli M, Montironi R, et al. 2004 WHO classification of the renal tumors of the adults. Eur Urol, 2006, 49(5): 798-805.
[2] Sidhar SK, Clark J, Gill S, et al. The t(X;1)(p11.2;q21.2) translocation in papillary renal cell carcinoma fuses a novel gene PRCC to the TFE3 transcription factor gene. Hum Mol Genet, 1996, 5(9): 1333-1338.
[3] Argani P, Antonescu CR, Illei PB, et al. Primary renal neoplasms with the ASPL-TFE3 gene fusion of alveolar soft part sarcoma: a distinctive tumor entity previously included among renal cell carcinomas of children and adolescents. Am J Pathol, 2001, 159(1): 179-192.
[4] Kuroda N, Mikami S, Pan CC, et al. Review of renal carcinoma associated with Xp11.2 translocations/TFE3 gene fusions with focus on pathobiological aspect. Histol Histopathol, 2012, 27(2): 133-140.
[5] Komai Y, Fujiwara M, Fujii Y, et al. Adult Xp11 translocation renal cell carcinoma diagnosed by cytogenetics and immunohistochemistry. Clin Cancer Res, 2009, 15(4): 1170-1176.
[6] Sukov WR, Hodge JC, Lohse CM, et al. TFE3 rearrangements in adult renal cell carcinoma: clinical and pathologic features with outcome in a large series of consecutively treated patients. Am J Surg Pathol, 2012, 36(5): 663-670.
[7] Ross H, Argani P. Xp11 translocation renal cell carcinoma. Pathology, 2010, 42(4): 369-373.
[8] Argani P, Antonescu CR, Couturier J, et al. PRCC-TFE3 renal carcinomas: morphologic, immunohistochemical, ultrastructural, and molecular analysis of an entity associated with the t(X;1)(pl1.2;q21). Am J Surg Pathol, 2002, 26(12): 1553-1566.
[9] 陈显成, 甘卫东, 郭宏骞. Xp11.2易位/TFE3基因融合相关性肾癌:一种需要更多认识的肾癌亚型. 中华临床医师杂志(电子版), 2014, 8(21): 3749-3752.
[10] Argani P, Lal P, Hutchinson B, et al. Aberrant nuclear immunoreactivity for TFE3 in neoplasms with TFE3 gene fusions: a sensitive and specific immunohistochemical assay. Am J Surg Pathol, 2003, 27(6): 750-761.
[11] Argani P, Ladanyi M. The evolving story of renal translocation carcinomas. Am J Clin Pathol, 2006, 126(3): 332-334.
[12] Rao Q, Guan B, Zhou XJ. Xp11.2 translocation renal cell carcinomas have a poorer prognosis than non-Xp11.2 translocation carcinomas in children and young adults: a metaanalysis. Int J Surg Pathol, 2010, 18(6): 458-464.
[13] 朱庆强, 王中秋, 吴晶涛, 等. XP11.2易位TFE基因融合相关性肾癌的多层螺旋CT表现. 中华放射学杂志, 2012, 46(6): 516-520.
[14] 徐晓晨, 甘卫东, 李笑弓, 等. Xp11.2易位/TFE3基因融合相关性肾癌与肾透明细胞癌的螺旋CT诊断鉴别. 现代泌尿外科杂志, 2012, 17(2): 122-124.
[15] Altinok G, Kattar MM, Mohamed A, et al. Pediatric renal carcinoma associated with Xp11.2 translocations/TFE3 gene fusions and clinicopathologic associations. Pediatr Dev Pathol, 2005, 8(2): 168-180.
[16] Salles PG, Soto M Jr. Kidney carcinoma associated with Xp11.2 translocation / TFE3 (ASPL-TFE3) gene fusion. Int Braz J Urol, 2005, 31(3): 251-254.
[17] Kato H, Kanematsu M, Yokoi S, et al. Renal cell carcinoma associated with Xp11.2 translocation/TFE3 gene fusion: radiological findings mimicking papillary subtype. J Magn Reson Imaging, 2011, 33(1): 217-220.
[18] 朱庆强, 王中秋, 吴晶涛, 等. Xp11.2/TFE 易位基因融合相关性肾癌与乳头状肾细胞癌的CT和MRI鉴别诊断. 中华医学杂志, 2014, 94(19): 1470-1472.
[19] Liu K, Xie P, Peng W, et al. Renal carcinomas associated with Xp11.2 translocations/TFE3 gene fusions: findings on MRI and computed tomography imaging. J Magn Reson Imaging, 2014, 40(2): 440-447.
[20] Prasad SR, Humphrey PA, Catena JR, et al. Common and uncommon histologic subtypes of renal cell carcinoma: imaging spectrum with pathologic correlation. Radiographics, 2006, 26(6): 1795-1806.
(本文编辑 周立波)
CT and MRI Findings of Renal Cell Carcinoma Associated with Xp11.2 Translocation / TFE3 Gene Fusions
PurposeTo investigate CT and MRI manifestations of renal cell carcinoma associated with Xp11.2 translocation/TFE3 gene fusions (abbreviation as Xp11.2 translocation renal cell carcinoma).Materials and MethodsEighteen cases of Xp11.2 translocation renal cell carcinoma confirmed by pathology were retrospectively analyzed. Ten patients underwent CT scans, 2 of them had unenhanced CT and 8 of them had pre-and post-contrast CT scan. Fourteen cases underwent plain and multi-phase contrast MRI scan, including 2 cases with unenhanced CT and 4 cases with pre-and post-contrast CT scan. The location, size, shape, density/signal, blood supply and the enhancement of the Xp11.2 translocation renal cell carcinoma were analyzed.ResultsAll of the 18 tumors located in the corticomedullary with 17 solid lesions and 1 cystic lesion. The mean maximum diameter of the tumor was (4.6±2.0) cm. Thirteen lesions were circular or oval and 5 were irregularly or lobulated lesions. Ten lesions showed slightly high or high density on unenhanced CT, and the average CT value was (50.6±11.5) HU, in which 4 lesions showed calcification. Among 8 cases of enhanced CT, 1 lesion showed abundant blood supply, while 7 lesions showed lack of blood supply. Fourteen cases of MRI scan exhibited various imaging features with short T1 and T2 signal, and the persistent enhancement in the medullary phase. The MRI findings were further divided into 3 types according to the signal intensity and blood supply except 1 cystic lesion: ①5 lesions predominantly with short T1 and T2 signal were lack of blood supply; ②4 lesions predominantly with slightly longer T1 and T2 signal were abundant blood supply; ③4 lesions predominantly with equal T1 and T2 signal were relatively lack of blood supply.ConclusionThe CT and MRI features of Xp11.2 translocation renal cell carcinoma had certain manifestations: slightly high or high density nodule or mass located in corticomedullary on pre-contrast CT scan, various signal intensity with short T1 and T2 signal on MRI, and the persistent enhancement in the medullary phase. These image features combined with clinical data are helpful for diagnosis.
Kidney neoplasms; Translocation, genetic; Tomography, spiral computed; Magnetic resonance imaging
1. 解放军第一六三医院医学影像科 湖南长沙410003
2. 青州市人民医院放射科 山东青州 262500 3. 解放军总医院放射诊断科 北京 100853
常瑞萍
Department of Radiology, General Hospital of PLA, Beijing 100853, China
Address Correspondence to: CHANG Ruiping
E-mail: changruiping71@163.com
R737.11;R445
2016-09-01
修回日期:2016-11-09
中国医学影像学杂志
2017年 第25卷 第3期:222-226,230
Chinese Journal of Medical Imaging
2017 Volume 25 (3): 222-226, 230
10.3969/j.issn.1005-5185.2017.03.015

