囊性成分在鉴别儿童髓母细胞瘤和室管膜瘤中的价值
李 娅 张 勇 程敬亮
囊性成分在鉴别儿童髓母细胞瘤和室管膜瘤中的价值
李 娅 张 勇 程敬亮
髓母细胞瘤;室管膜瘤;磁共振成像;病理学,外科;诊断,鉴别;儿童
儿童颅内肿瘤主要发生在后颅窝,以毛细胞型星形细胞瘤、髓母细胞瘤和室管膜瘤最常见[1]。毛细胞型星形细胞瘤、髓母细胞瘤和室管膜瘤具有发病年龄相近、均可为囊实性、易发于中线区等共性,3种肿瘤形态相似,影像学表现缺乏特异性,其中髓母细胞瘤和室管膜瘤均易侵犯四脑室,故增加了鉴别的难度[2-3]。传统的鉴别诊断主要从髓母细胞瘤和室管膜瘤的发病部位、MR信号强度、表观扩散系数(ADC)值等方面进行。本研究通过分析两种肿瘤囊性成分分布、大小、数量、边缘特征和信号强度,为临床医师提供新的鉴别诊断方法。
1 资料与方法
1.1 研究对象 回顾性分析郑州大学第一附属医院2008年5月-2015年8月经手术病理证实的髓母细胞瘤35例和室管膜瘤22例患者的影像资料。所有患儿年龄均<14岁,且对应3幅显示肿瘤最大层面的MRI图像。
1.2 仪器与方法 采用 Siemens 3.0T MR仪,标准头颅线圈。平扫行矢状位及轴位T1WI、轴位T2WI及轴位扩散加权成像(DWI);增强扫描行矢状位、轴位及冠状位T1WI,造影剂采用钆喷酸葡胺,剂量0.1 mmol/kg。轴位扫描,层厚6 mm,间隔1 mm,FOV 24 cm×24 cm,矩阵128×128,成像时间48 s。
1.3 图像分析 由2位主任医师对图像采用盲法进行分析。分析两种肿瘤囊性成分分布、大小、数量、边缘和信号强度。根据囊性成分所占肿瘤面积的比例将其分为4种分布类型:1%~25%为小范围型;26%~50%为中范围型;51%~75%为大范围型;76%~100%为扩散型[4]。两种肿瘤囊性成分的边缘均存在不规则性。根据囊性成分在肿瘤中的位置将其分为3种类型:偏心型、中央型和整体型。同时测量两种肿瘤最大的囊性成分直径。
1.4 统计学方法 采用SPSS 18.0软件。采用独立样本t检验比较两种肿瘤囊性成分的平均最大直径;采用χ2检验比较两种肿瘤囊性成分的发生率、边缘特征、分布类型。P<0.05表示差异有统计学意义。
2 结果
髓母细胞瘤和室管膜瘤图像的定性分析和定量测量结果见表1及图1、2。

表1 髓母细胞瘤和室管膜瘤囊性成分比较

图1 男,5岁,髓母细胞瘤。T1图像表现为低信号(A);T2图像表现为高信号(B);箭示肿瘤部分

图2 男,4岁,室管膜瘤。T1图像表现为稍低信号(A);T2图像表现为高信号(B);箭示肿瘤部分
髓母细胞瘤和室管膜瘤的囊性成分均易发生在肿瘤周边(P<0.01)。髓母细胞瘤囊性成分的分布类型大多为小范围型,室管膜瘤囊性成分分布类型大多为扩散型(P<0.01)。由此可见,室管膜瘤更易发生囊性变,且囊性成分所占的面积更多。见表2。
3 讨论
髓母细胞瘤和室管膜瘤均为儿童常见的后颅窝肿瘤。髓母细胞瘤发病高峰年龄为7岁,多为实性,但肿瘤内可见小囊变;室管膜瘤多见于儿童和青少年,肿瘤坏死囊变多见[5]。通过以下特点相鉴别:髓母细胞瘤起源于后髓帆原始胚胎残留组织,可突入四脑室,易发生脊髓和软脑膜转移;室管膜瘤常位于四脑室经外侧孔向桥小脑角延伸,向下方通过正中孔呈铸型生长到达延髓后方[6-8]。尽管室管膜瘤较髓母细胞瘤的ADC 值增高,但由于这两种肿瘤内部成分的病理变化(钙化或者出血)导致两者间的ADC 值有部分重叠,当ADC值以0.66×10-3mm2/s为标准时,诊断髓母细胞瘤的阳性预测值、阴性预测值及准确率分别是86%、97%、93%[9]。但Pillai等[10]报道10例髓母细胞瘤的ADC值,其中2例ADC值>1×10-3mm2/s,这可能缘于肿瘤内网状纤维聚集,导致ADC值升高。故仅凭ADC 值不能可靠鉴别[11]。
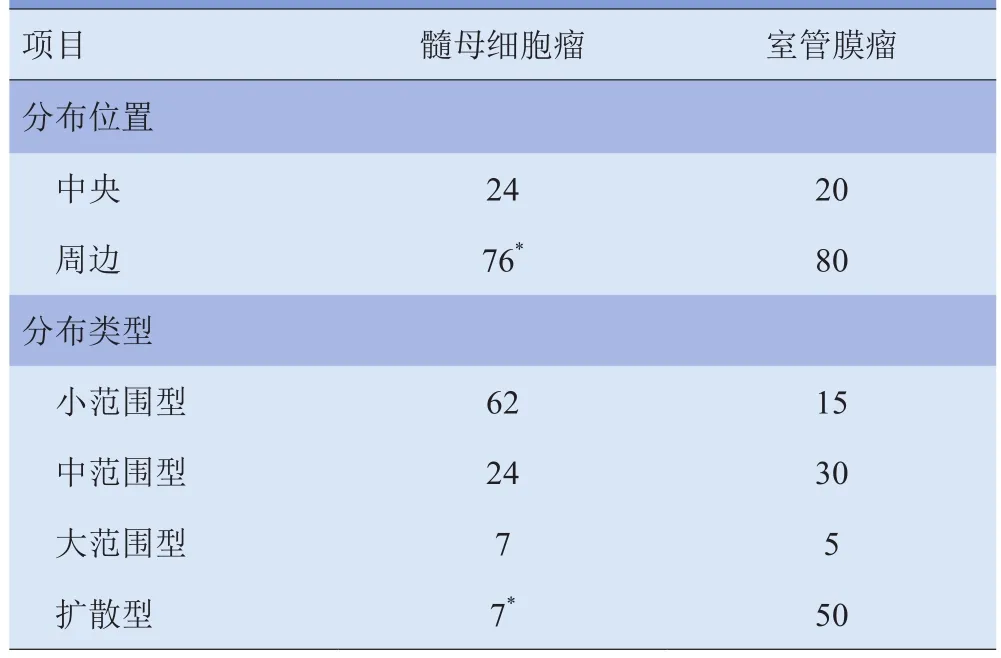
表2 髓母细胞瘤和室管膜瘤内囊性成分分布位置及范围比较(%)
MR图像可显示两种肿瘤囊性成分的位置和大小,可通过分析肿瘤囊性成分的发生位置、发生率、边缘特征及MR信号强度相鉴别。本研究发现,室管膜瘤比髓母细胞瘤更易发生囊变,且室管膜瘤囊性成分的平均最大直径达(30.2±12.3)mm,而髓母细胞瘤囊性成分边缘更不规则,室管膜瘤发生囊性成分的类型主要为大范围型和扩散型。既往研究报道利用囊性成分的特征可鉴别腮腺肿瘤的性质[4],与本研究结果一致。
肿瘤内的囊性成分主要由出血、坏死造成;囊性成分的MR信号强度也会因成分不同而存在差异。此方法需与两种肿瘤的临床特点及MR图像特点相结合,从而减少临床误诊和漏诊率。本研究也存在一定的局限性,仅在轴位对两种肿瘤的囊性成分进行分析,今后将扩大样本量针对矢状位和冠状位开展进一步的研究。
[1] Poretti A, Meoded A, Huisman TA. Neuroimaging of pediatric posterior fossa tumors including review of the literature. J Magn Reson Imaging, 2012, 35(1): 32-47.
[2] Fetit AE, Novak J, Peet AC, et al. Three-dimensional textural features of conventional MRI improve diagnostic classification of childhood brain tumours. NMR Biomed, 2015, 28(9): 1174-1184.
[3] Orphanidou-Vlachou E, Vlachos N, Davies NP, et al. Texture analysis of T1-and T2-weighted MR images and use of probabilistic neural network to discriminate posterior fossa tumours in children. NMR Biomed, 2014, 27(6): 632-639.
[4] Kato H, Kanematsu M, Watanabe H, et al. Salivary gland tumors of the pariotid gland: CT and MR imaging findings with emphasis on intratumoral cystic components. Neuroradiology, 2014, 56(9): 789-795.
[5] 李晓光, 张伟国, 康厚艺. 第四脑室菊形团形成型胶质神经元肿瘤1例. 中国医学影像学杂志, 2013, 21(5): 330-331.
[6] Jaremko JL, Jans LB, Cleman LT, et al. Value and limitations of diffusion-weighted imaging in grading and diagnosis of pediatric posterior fossa tumors. Am J Neuroradiol, 2010, 31(9): 1613-1616.
[7] Yuh EL, Barkovich AJ, Gupta N. Imaging of ependymomas: MRI and CT. Childs Nerv Syst, 2009, 25(10): 1203-1213.
[8] Koller KK, Rushing EJ. From the archives of the AFIP: pilocytic astrocytoma: radiologic-pathologic correlation. Radiographics, 2004, 24(6): 1693-1708.
[9] 卜春晓, 张勇, 程敬亮, 等. ADC值在儿童常见小脑肿瘤鉴别诊断中的应用. 实用放射学杂志, 2015, 31(6): 998-1001.
[10] Pillai S, Singhal A, Byrne AT, et al. Diffusion-weighted imaging and pathological correlation in pediatric medulloblastomas-"They are not always restricted!". Childs Nerv Syst, 2011, 27(9): 1407-1411.
[11] Jaremko JL, Jans LB, Coleman LT, et al. Value and limitations of diffusion-weighted imaging in grading and diagnosis of pediatric posterior fossa tumors. Am J Neuroradiol, 2010, 31(9): 1613-1616.
R445.2;R739.4
2016-09-22 【收回日期】2016-12-25
(本文编辑 闻 浩)
郑州大学第一附属医院磁共振科 河南郑州 450052
张 勇 E-mail: zzuzhangyong2013@163.com
10.3969/j.issn.1005-5185.2017.03.009

