棉酚对T2DM合并NAFLD大鼠肝脏的保护作用
王家员 樊建霜 吴亮 黄卡特 王蓉蓉
●论 著
棉酚对T2DM合并NAFLD大鼠肝脏的保护作用
王家员 樊建霜 吴亮 黄卡特 王蓉蓉
目的 探讨棉酚对2型糖尿病(T2DM)合并非酒精性脂肪性肝病(NAFLD)大鼠肝脏的保护作用。方法 将30只SD雄性大鼠随机分为棉酚组、T2DM组和正常组,每组10只。高脂高糖饮食喂养4周后腹腔注射小剂量(30mg/kg)链脲佐菌素构建T2DM大鼠模型。棉酚组用棉酚混悬液灌胃12周,每次剂量为15mg/kg,前4周为1次/d,后8周为1次/周。实验结束后检测大鼠血清ALT、AST、白蛋白(ALB)及透明质酸(HA)水平;透射电镜下观察肝组织超微结构改变;经HE染色、Masson胶原纤维染色后,在光镜下分别观察肝组织形态学改变、纤维化病变;免疫组化染色检测肝组织α-平滑肌肌动蛋白(α-SMA)、肝脏Ⅰ型11β类固醇脱氢酶(11β-HSD1)及糖皮质激素受体(GR)蛋白表达;采用半定量RT-PCR法检测肝组织葡萄糖-6-磷酸酶(G6Pase)、磷酸烯醇式丙酮酸羧激酶(PEPCK)、瘦素受体(Leptin R)、胰岛素受体(Insulin R)mRNA表达水平。结果 与正常组相比,T2DM组血清ALT、AST、HA水平均明显升高(均P<0.05),ALB水平明显降低(P<0.01);肝脏α-SMA、11β-HSD1、GR蛋白表达均明显增强(均P<0.05);肝组织Leptin R、Insulin R mRNA表达均明显升高(均P<0.01);临床病理学表现主要为肝细胞水肿、脂肪变性、气球样变、炎症细胞浸润及纤维组织增生,肝组织内可见较多活化的肝星形细胞。与T2DM组相比,棉酚组血清ALT、AST、HA水平均明显降低(均P<0.05),ALB水平明显升高(P<0.05);肝脏11β-HSD1、GR蛋白表达均明显降低(均P<0.05);肝组织G6Pase、PEPCK、Insulin R、Leptin R mRNA表达均明显下降(均P<0.01);临床病理学表现主要为肝细胞水肿、脂肪变性、气球样变及炎症现象稍有减轻,肝内纤维组织明显减少,肝组织内活化的肝星形细胞数量明显减少。结论 低剂量棉酚可明显减轻T2DM合并NAFLD大鼠纤维化病变,其机制可能与其抑制组织11β-HSD1、Leptin R、Insulin R mRNA表达有关。
棉酚 2型糖尿病 非酒精性脂肪性肝病 Ⅰ型11β类固醇脱氢酶 瘦素受体 胰岛素受体
【 Abstract】 Objective To investigate the hepatoprotective effect of gossypol in type 2 diabetic (T2DM)rats complicated with non-alcoholic fatty liver disease(NAFLD). Methods Thirty male Sprague-Dauley rats were divided randomly into normal control group,T2DM group and gossypol-treated group with 10 in each group.After being fed with high-fat feeding for 4 weeks, the latter two groups were injected with strepozotocin(30mg/kg)intraperitoneally to induce T2DM.The rats in gossypol treated group were given gossypol at a dose of 15mg·kg-1·d-1for 4 weeks by gavage,then at a dose of 15mg·kg-1·d-1until the end of week 12.At the end of the experiment all animals were sacrificed,the concentration of serum ALT,AST,ALB and HA were measured.The ultrastructural changes of liver were observed by transmission electron microscopy(TEM),the pathologic changes and fibrosis of liver were observed by light microscopy(LM)with HE staining and Masson staining respectively.Additionally,the activated hepatic stellate cells(HSCs)and the protein expression of 11 beta-hydroxysteroid dehydrogenase type 1(11β-HSD1) and glucocorticoid receptors(GR)was assayed by immunohistochemistry(IHC),the mRNA expression of phosphoenolpyruvate carboxykinase(PEPCK),glucose-6-phosphatase(G6Pase),insulin receptor and leptin receptor in liver tissue was assayed by semi-quantitative RT-PCR. Results The levels of serum ALT,AST,HA increased(P<0.05),serum ALB decreased(P<0.05),the 11β-HSD1 and GR protein expression increased(P<0.05),the mRNA expression of insulin receptor,leptin receptor increased (P<0.05)in liver tissue of T2DM group compared with normal control group.Clinical pathology showed obvious liver hydropicdegeneration,fatty degeneration,ballooning degeneration,inflammatory infiltration,fibrosis,a great number of activated HSCs in liver tissue of T2DM group.The levels of serum ALT,AST,HA decreased (P<0.05),serum ALB increased (P<0.01),the 11β-HSD1 and GR protein expression decreased(P<0.05),the mRNA expression of PEPCK,G6Pase,insulin receptor and leptin receptor decreased (P<0.05)in liver tissue of gossypol treated group compared with diabetic group.The hydropic degeneration,fatty degeneration,ballooning degeneration,inflammatory infiltration in liver tissue were improved slightly but the hepatic fibrosis was attenuated and the number of activated HSCs was reduced in gossypol treated group significantly compared with T2DM group. Conclusion Low dosage gossypol can attenuate fibrosis of NAFLD in diabetic rats.Down regulation of mRNA expression of 11β-HSD1,insulin receptor and leptin receptor may be involved in it.
【 Key words】 Gossypol Type 2 diabetes Nonalcoholic fatty liver disease 11beta-hydroxysteroid dehydrogenase type 1 Leptin receptor Insulin receptor
非酒精性脂肪性肝病(NAFLD)是一种以肝细胞内脂肪沉积为特征但无过量饮酒史的慢性肝脏疾病[1]。NAFLD包括非酒精性单纯性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH)及相关肝硬化、肝细胞癌[1]。在这一组由轻至重的疾病谱中,纤维化对疾病的发展起着关键的作用。NAFLD发病机制复杂,目前较为公认的观点是胰岛素抵抗导致的糖脂代谢紊乱是其启动因子与中心事件。糖皮质激素(GC)是潜在的胰岛素拮抗剂,它对靶组织的作用依赖于局部组织Ⅰ型11β类固醇脱氢酶(11β-HSD1)调节的受体前代谢[2]。棉酚是从棉籽中提炼出来的一种黄色脂溶性多酚化合物,曾被证实是一种非常有效的男性避孕药[3]。相关研究表明,棉酚能抑制大鼠睾丸11β-HSD1活性[4]。本课题组前期研究发现棉酚可以降低2型糖尿病(T2DM)大鼠的血糖、血脂、血胰岛素水平[5-6],抑制大脑皮层与海马组织内11β-HSD1蛋白表达[6]。国外研究证实棉酚具有拮抗肺纤维化的功能[7]。目前关于棉酚对T2DM大鼠肝脏11β-HSD1的表达及肝脏形态、功能的影响,国内外未见文献报道。故本课题组构建T2DM合并NAFLD大鼠模型,观察棉酚对糖尿病大鼠肝脏形态与功能的影响,检测肝组织α-平滑肌肌动蛋白(α-SMA)、11β-HSD1、糖皮质激素受体(GR)的蛋白表达,以及葡萄糖-6-磷酸酶(G6Pase)、磷酸烯醇式丙酮酸羧激酶(PEPCK)、瘦素受体(Leptin R)、胰岛素受体(Insulin R)基因mRNA表达水平,探讨棉酚对T2DM合并NAFLD大鼠肝脏的保护作用机制。
1 材料和方法
1.1 实验材料 SPF级雄性SD大鼠,体重140~180g [由温州医科大学实验动物中心提供,SCXK(浙)2015-0004];链脲佐菌素(厦门星隆达化学试剂有限公司);ALT、AST、白蛋白(ALB)、透明质酸(HA)试剂盒(上海海研医学生物技术有限公司);鼠抗单克隆抗体α-SMA(北京中杉金桥生物试剂有限公司),兔抗多克隆抗体11β-HSD1(由美国洛克菲勒大学人口委员会葛仁山教授惠赠),兔抗多克隆抗体GR(美国圣克鲁斯生物技术有限公司),二抗(北京中杉金桥生物试剂有限公司);Triol(美国Invitrogen公司),M-MLV逆转录酶(美国Promega公司),PCR试剂[大连宝生物(TaKaRa)公司];所用引物由上海Invitrogen公司合成。
1.2 方法
1.2.1 动物造模[8]将30只雄性SD大鼠随机分为棉酚组、T2DM组和正常组,每组10只。棉酚组、T2DM组用高糖高脂饲料(饲料配方:10.0%猪油、20.0%蔗糖、2.5%胆固醇、1.0%胆酸盐、66.5%常规饲料)喂养4周后,禁食12h,按照30mg/kg的剂量单次腹腔注射链脲佐菌素(溶于0.1mmol/L枸椽酸缓冲液内,pH 4.0);72h后检测空腹血糖≥8mmol/L,即造模成功。正常组大鼠腹腔注射等容积枸橼酸缓冲液。
1.2.2 药物治疗[8]将棉酚溶于2%羧甲基纤维素混合制成棉酚混悬液,棉酚组用棉酚混悬液灌胃12周,每次剂量为15mg/kg,前4周为1次/d,后8周为1次/周[5]。T2DM组、正常组用等容积2%羧甲基纤维素灌胃。实验期间,T2DM组、棉酚组继续用高糖高脂饲料喂养。
1.2.3 血清检测 股动脉放血处死大鼠,采集血清10ml,2 200r/min离心10min,取上清液;使用日立7600大型生化分析仪检测血清ALT、AST、ALB水平,采用放免法检测血清HA水平。
1.2.4 肝脏病理学检查 (1)HE染色:取10mm×10mm× 2mm的新鲜肝脏组织1块,置于10%中性甲醛溶液中固定6h,经脱水、透明、浸蜡、包埋成蜡块,用切片机制成厚度约3μm切片,行HE染色。随机选择5个高倍视野(× 200)进行NAFLD活动度积分(NAS)[1]:①肝细胞脂肪变性<5%为0分,5%~<34%为1分,34%~66%为2分,>66%为3分;②小叶内炎症(200倍镜下坏死灶计数)无为0分,1个为1分,2~4个为2分,>4个为3分;③肝细胞气球样变“无”为0分,“少见”为1分,“多见”为2分。(2)Masson胶原纤维染色:肝组织石蜡切片,脱蜡至水,苏木素染色5min,1%盐酸乙醇分化数秒,置于Masson液染色5min,水洗数次,置于亮绿液中染色1min,经低浓度到高浓度梯度乙醇脱水,石碳酸-二甲苯中红绿分化数秒,入二甲苯透明,中性树胶封固。结果判断:胶原纤维蓝绿染,肝细胞胞质红染,肝细胞核紫色;光镜下随机选择5个低倍镜视野(×100)观察胶原纤维的分布,按以下标准进行肝组织纤维化分期评分[1]:无纤维化为0分;肝小叶3区窦周或汇管区周围纤维化为1分;肝小叶3区窦周合并汇管区周围纤维化为2分;桥接纤维化为3分;高度可疑或确诊肝硬化为4分。
1.2.5 肝脏超微结构检查 取新鲜肝组织1小块,约1mm×1mm×1mm,立即置于2.5%戊二醛4℃固定1h;饿酸后固定,行常规PBS漂洗,丙酮梯度脱水;用Epon812包埋,半薄切片定位,用LKB-V型超薄切片机切片;行铅铀双重染色,在H-600A型透射电镜下观察。
1.2.6 免疫组化染色 根据Envision二步法进行染色。将石蜡标本切成厚度5μm切片,在60℃水浴箱内展贴于防脱胶APES处理的载玻片上,常规脱蜡、脱水至蒸馏水;用3%过氧化氢甲醇溶液阻断内源性过氧化物酶10min;将切片置于0.01mol柠檬酸缓冲液中(pH 7.2~7.4)高压抗原修复10min;分别滴加一抗α-SMA(稀释浓度1∶100)、11β-HSD1(稀释浓度1∶300)、GR(稀释浓度1∶160),置于4℃冰箱过夜;用0.01mol PBS(pH 7.2~7.4)漂洗数次,滴加二抗及HRP复合物,反应20min;DAB显色;苏木素复染;以0.01mol PBS代替一抗作为阴性正常。结果判定:α-SMA、11β-HSD1定位于细胞质,GR定位于细胞核,棕黄色为阳性表达;光镜下随机选择5个低倍镜视野(×100),按以下标准评估α-SMA蛋白表达[9]:无着色为无表达;<10%为轻度表达;10%~25%为中度表达;>25%~50%为重度表达;>50%为极重度表达。应用Image-Pro Plus 6.0图像处理软件计算累积吸光度(OD),以评估11β-HSD1、GR蛋白表达。
1.2.7 半定量RT-PCR -80℃超低温冰箱内取出冷冻肝组织100mg,碾碎后加入1ml Triol,提取总RNA。应用Beckman Coulter DU800紫外分光光度仪进行RNA纯度、浓度检测。取2μg OD260/OD280比值1.8~2.0的RNA在M-MLV逆转录酶下合成cDNA。取1μl cDNA作为模板,在Taq DNA聚合酶催化下行目的基因G6Pase、PEPCK、Insulin R、Leptin R和内参基因RPS16的PCR同管扩增。PCR引物及反应条件见表1。PCR产物经2%琼脂糖凝胶电泳(含0.5μg/ml Goldview染色剂),应用Gel-pro31凝胶分析系统分析PCR产物条带累积光密度,以各目的基因与内参照基因的比值反映目的基因的相对mRNA水平。

表1PCR引物及反应条件
1.3 统计学处理 应用SPSS 19.0统计软件。计量资料用表示,3组间比较采用单因素方差分析。
2 结果
2.1 3组大鼠血清肝功能指标及HA水平比较 与正常组比较,T2DM组大鼠血清ALT、AST、HA水平均明显升高,ALB水平明显降低,差异均有统计学意义(均P<0.05)。与T2DM组比较,棉酚组大鼠血清ALT、AST、HA水平均明显降低,ALB水平明显升高,差异均有统计学意义(均P<0.05),见表2。
2.2 3组大鼠肝脏病理学评分比较 正常组大鼠肝小叶以中央静脉为中心,肝索呈放射状整齐排列,肝血窦清晰可见;T2DM组大鼠肝索紊乱、肝血窦消失,肝细胞广泛水肿伴部分气球样变、明显脂肪变性,多灶区肝细胞点状坏死伴炎症细胞浸润、小胆管增生;棉酚组肝细胞水肿、气球样变、脂肪变性、肝细胞坏死、炎症细胞浸
润略有减轻,见图1(插页)。Masson胶原纤维染色:仅正常组见血管壁少许胶原纤维绿染;T2DM组见肝小叶3区窦周隙区域或气球样变、严重脂肪变性的肝细胞外周有“鸡爪样”的胶原纤维增生为主的NASH特征性的纤维化病变,严重者肝小叶3区胶原纤维与汇管区胶原纤维相互连接并形成桥接纤维化,甚至个别肝小叶内纤维组织增生将其分割形成假小叶;棉酚组胶原纤维增生程度较T2DM组明显减轻,两组纤维化分期评分比较差异有统计学意义,见图2(插页)和表3。
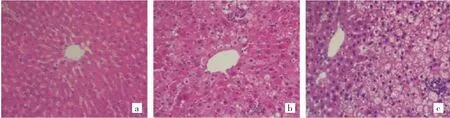
图1 3组大鼠肝组织形态学改变(a.:正常组;b:T2DM组;c:棉酚组;HE染色,×200)

图2 3组大鼠肝组织胶原纤维分布(a:正常组;b:T2DM组;c:棉酚组;Masson染色,×100)

表2 3组大鼠血清肝功能及HA水平比较
2.3 3组大鼠肝脏超微结构比较 正常组大鼠肝细胞核呈圆形、居中,胞质内有丰富的线粒体、粗面内质网,未见脂滴,见图3a(插页);T2DM组大鼠肝细胞核固缩、偏位,胞质内见大量脂滴,粗面内质网数目减少,线粒体体积变小、数目减少、密度增高,狄氏窦胶原纤维增生,见图3b(插页);棉酚组大鼠肝细胞核固缩减轻,胞质内脂滴略有减少,线粒体数目增多、密度降低,板状嵴变清晰,粗面内质网与正常组相近,狄氏窦未见明显胶原纤维增生,见图3c(插页)。

图3 3组大鼠肝脏超微结构(a:正常组胞质内可见丰富的线粒体、内质网,透射电镜,×6 000;B:T2DM组胞质内见脂滴(↑),狄氏窦示胶原纤维增生(←),透射电镜,×12 000;C:棉酚组线粒体密度降低,板状嵴较清晰,透射电镜,×20 000)

表3 3组大鼠肝脏病理学评分比较
2.4 3组大鼠肝脏α-SMA、11β-HSD1、GR蛋白表达正常组肝星形细胞不表达α-SMA,仅肝小叶中央静脉、小叶间静脉、小叶间动脉血管壁的平滑肌细胞表达α-SMA,肝脏α-SMA蛋白表达水平为0;T2DM组肝组织内可见局灶表达α-SMA的增生、活化的肝星形细胞,高倍镜下星形细胞胞浆呈星状或棱状突起,主要分布于肝小叶3区窦周纤维组织增生区域及纤维组织增生的汇管区及其周围,其分布与胶原纤维增生区域基本一致,其α-SMA蛋白表达水平为1.60±1.35,与正常组比较差异有统计学意义(P<0.05);棉酚组肝组织内阳性表达α-SMA的肝星形细胞明显减少,部分肝组织未见表达α-SMA的肝星形细胞,其α-SMA蛋白表达水平为0.40±0.52,与T2DM组比较差异无统计学意义(P>0.05),见图4。

图4 3组大鼠肝组织α-SMA蛋白表达(a:正常组;b:T2DM组;c:棉酚组;Invision法,×400)
正常组肝脏11β-HSD1呈弱阳性表达,其蛋白表达水平为4 316.57±1 330.35,主要在中央静脉周围区;T2DM组肝脏11β-HSD1蛋白表达水平为9 857.37±5 762.49,明显高于正常组(P<0.05);棉酚组肝脏11β-HSD1蛋白表达水平为5 651.48±3 345.21,明显低于T2DM组(P<0.05),与正常组比较差异无统计学意义(P>0.05),见图5。
正常组肝脏GR呈中等强度表达,其蛋白表达水平为3 319.11±1 462.39,多数肝细胞核呈棕黄色;T2DM组GR蛋白表达水平为8 922.95±2 324.85,明显高于正常组(P<0.05),肝细胞核略显棕黑色;棉酚组GR蛋白表达水平为4 576.68±2 136.43,明显低于T2DM组(P<0.05),与正常组比较差异无统计学意义(P>0.05),见图6。
2.5 3组大鼠肝组织G6Pase、PEPCK、Leptin R、Insulin R mRNA表达 T2DM组肝组织Leptin R、Insulin R mRNA表达均明显高于正常组(均P<0.05);G6Pase、PEPCK mRNA表达有升高趋势,但与正常组比较差异均无统计学意义(均P>0.05)。与T2DM组相比,棉酚组肝组织PEPCK、G6Pase、Insulin R、Leptin R mRNA表达均明显下降(均P<0.05),见表4和图7(插页)。
3 讨论
NAFLD是T2DM的一种常见并发症,其发病率高达50%[10]。多数患者仅表现为肝细胞内脂肪沉积的单纯性脂肪肝,临床预后良好;但仍有20%~30%的患者伴肝内炎症、纤维组织增生的NASH。NASH若不进行早期干预治疗,纤维组织持续增生,将发展为不可逆转的肝硬化甚至肝功能衰竭[11]。因此,有效地治疗糖尿病性NAFLD具有重要的临床意义。
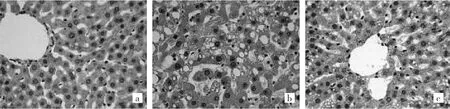
图5 3组大鼠肝脏11β-HSD1蛋白表达(a:正常组;b:T2DM组;c:棉酚组;Invision法,×400)

图6 3组大鼠肝脏GR蛋白表达(a:正常组;b:T2DM组;c:棉酚组;Invision法,×400)

表4 3组大鼠肝组织G6Pase、PEPCK、LeptinR、InsulinRmRNA表达

图7 3组大鼠肝组织G6Pase、PEPCK、Leptin R、Insulin R mRNA的表达(M:100bp分子量标准;a:正常组b:T2DM组;c:棉酚组)
GC是潜在的胰岛素拮抗剂,可在多个水平参与调节葡萄糖-胰岛素之间的平衡,如抵抗胰岛素的外周作用、抑制胰岛素的释放、促进糖异生等[12]。11β-HSD1是GC的代谢酶,具有脱氢/氧化还原两种活性,催化局部器官、组织内无生物活性的GC可的松与有生物活性GC皮质醇的相互转换。在肝脏,11β-HSD1以还原酶活性为主,催化可的松转换为皮质醇[13]。肝脏是糖代谢的重要靶器官,肝脏通过糖异生的方式合成肝内葡萄糖,G6Pase、PEPCK是糖异生的关键酶[14]。PEPCK催化草酰乙酸是磷酸烯醇式丙酮酸,G6Pase催化葡萄糖-6-磷酸分解成葡萄糖、磷酸,引起血液中葡萄糖水平升高,主要生理意义在于保证饥饿情况下的血糖浓度相对恒定。G6Pase、PEPCK的表达受到胰岛素的抑制与胰高血糖素的激活。Insulin R是一种广泛分布于各组织与器官的跨膜蛋白,胰岛素通过与其结合发挥生物学效应,其中肝脏是Insulin R的主要靶器官,Insulin R的数目受到血胰岛素水平的调节。胰岛素与受体的结合程度随糖尿病严重程度而增加,发生糖尿病时肝细胞Insulin R数目可增加180%,但Insulin R的酪氨酸激酶活性降低,由胰岛素介导的葡萄糖利用率反而减少[15]。瘦素是由肥胖基因编码白色脂肪组织合成的一种分泌型蛋白质,它通过与靶器官上的Leptin R结合而发挥生物学效应。瘦素及其受体在葡萄糖代谢过程中具有重要作用。在生理情况下,胰岛素与瘦素之间是一个双向的反馈调节,即胰岛素刺激瘦素分泌、瘦素抑制胰岛素分泌,一旦这种平衡被破坏,胰岛素对瘦素的灵敏度减弱,则引起胰岛素抵抗。
本实验结果显示T2DM组血清AST、ALT、HA水平均明显升高,ALB水平明显降低;临床病理学表现主要为肝细胞水肿、脂肪变性、点状坏死伴炎症细胞浸润、肝纤维组织增生等。肝脏11β-HSD1、GR蛋白表达明显升高;肝组织Insulin R、Leptin R mRNA表达明显升高。笔者认为发生T2DM时肝内11β-HSD1蛋白表达增强并激活GC活性,GC通过与肝细胞内GR受体的结合发挥拮抗胰岛素的作用,使肝组织对胰岛素的灵敏度降低,从而使胰岛素刺激瘦素分泌的功能下降;可见机体通过上调肝组织Insulin R、Leptin R mRNA表达是一种改善胰岛素抵抗的代偿反应。棉酚组血清AST、ALT、HA水平均明显下降,ALB水平明显升高,肝纤维化程度明显减轻;提示棉酚具有保护T2DM大鼠肝脏的作用。同时,肝脏 11β-HSD1、GR蛋白表达明显下降,PEPCK、G6Pase mRNA表达亦明显下降,提示棉酚可抑制肝脏11β-HSD1蛋白表达,一方面降低肝内有活性的GC浓度,从而使肝内GR表达亦相应减少,改善肝组织对胰岛素的灵敏度;另一方面减弱了GC刺激糖异生的作用,使血糖降低,糖异生关键酶PEPCK、G6Pase mRNA表达减少。此外,棉酚还能抑制肝组织Insulin R、Leptin R mRNA表达水平,可能参与降低糖尿病胰岛素水平、改善胰岛素抵抗的作用。在NAFLD发病过程中,高糖致线粒体内超氧阴离子产生过多导致组织细胞内发生氧化应激是关键因素[16]。肝内氧化应激增加,肝星形细胞被激活并分裂增殖,使肝星形细胞具有肌纤维母细胞分泌胶原纤维的功能,促进肝纤维化[17]。本实验发现棉酚组大鼠活化的肝星形细胞数目明显减少,肝纤维化程度明显减轻,可能与棉酚改善胰岛素抵抗、减少糖异生有关。
本课题组前期研究发现[6],T2DM大鼠大脑皮层、海马组织内GR蛋白表达明显升高,经棉酚治疗后,GR蛋白表达明显下降,与本实验中肝脏GR蛋白表达结果相反。笔者考虑原因在于两者形成机制不同:(1)肝组织局部有活性的GC增多主要是刺激GR蛋白表达使之与过多的GC结合以发挥拮抗胰岛素的作用,而棉酚可抑制11β-HSD1的表达,使无活性的GC转化成有活性的GC的量减少,因此GR也相应减少。而在脑内GC与GR结合的作用主要是对HPA轴起负反馈调节作用,局部有活性的GC对神经元的损害导致神经元数目减少、GR减少,使GC对HPA的抑制作用减弱,因此HPA对应激反应持久亢进,分泌GC水平升高,从而进一步加重了脑神经元的损害,形成恶性循环。棉酚通过抑制11β-HSD1的表达,使局部有活性的GC减少,可减轻GC对神经元的损害,因此,大脑皮层、海马组织内GR蛋白表达增强。
棉酚曾是一种实用的男性口服避孕药而被广泛应用临床,但高剂量(20~30mg/kg)会抑制11β类固醇脱氢酶-2而出现低血钾,因此逐步停止使用;后来有研究证实低剂量(15mg/kg)无低血钾的不良反应[18],本课题组前期研究结果亦与其一致[5-6]。因此,低剂量棉酚可明显减轻T2DM合并NAFLD大鼠纤维化病变,其机制可能与其抑制组织11β-HSD1、Leptin R、Insulin R mRNA表达有关。
[1] Farrell G C,Chitturi S,Lau G K,et al.Guidelines for the assessment and management of non-alcoholic fatty liver disease in the Asia-Pacific region:executive summary[J].Gastroenterol Hepatol,2007,22(6):775-777.
[2] Seckl J R,Walker B R.11beta-hydroxysteroid dehydrogenase type 1-a tissue-specific amplifier of glucocorticoid action[J].Endocrinol,2001,142(4):1371-1376.
[3] Yu Z H,Chan H C.Gossypol as a male antifertility agent-why studies should have been continued[J].Int J Androl,1998,21(1): 2-7.
[4] Sang G W,Lorenzo B,Reidenberg M M.Inhibitory effects of gossypol on corticosteroid 11beta-hydroxysteroid dehydrogenase from guinea pig kidney:a possible mechanism for causing hypokalemia[J].J Steroid Biochem Mol Biol,1991,39(2):169-176.
[5] Chen G,Wang R,Chen H,et al.Gossypol ameliorates liver fibrosis in diabetic rats induced by high-fat diet and streptozocin[J]. Life Sci,2016,149:58-64.
[6]吴亮,吴晓烨,王环,等.T2DM大鼠脑内11β-HSD1和GR的表达与认知功能的关系及棉酚的干预作用[J].中国病理生理杂志,2009,25 (7):1336-1341.
[7] Kottmann R M,Trawick E,Judge J L,et al.Pharmacologic inhibition of lactate production prevents myofibroblast differentiation[J]. Am J PhysiolLung CellMolPhysiol,2015,309(11):L1305-L1312.
[8]郭啸华,刘志红,李恒,等.实验性T2DM大鼠模型的建立[J].肾脏病与透析肾移植杂志,2000,9:351-356.
[9] Toblli J E,Ferder L,Stella I,et al.Enalapril prevents fatty liver in nephrotic rats[J].J Nephrol,2002,15(4):358-367.
[10] Tolman K G,Fonseca V,Tan M H,et al.Narrative review:hepatobiliary disease in type 2 diabetes mellitus[J].Ann Intern Med, 2004,141(12):946-956.
[11] Bugianesi E,Leone N,Vanni E,et al.Expanding the natural history of nonalcoholic steatohepatitis:from cryptogenic cirrhosis to hepatocellular carcinoma[J].Gastroenterology,2002,123(1): 134-140.
[12] Nyrenda MJ,Lindsay R S,Kenyon C J,et al.Glucocorticoid exposure in late gestation permanently programs rat hepatic phosphoenolpyruvate carboxykinase and glucocorticoid receptor expression and cause glucose intolerance in adult offspring[J].J Clin Invest,1998,101(10):2174-2181.
[13] Alberts P,Engblom L,Edling N,et al.Selective inhibition of 11β-hydroxysteroid dehydrogenase type 1 decreases blood glucose oncentrations in hyperglycaemic mice[J].Diabetologia, 2002,45(1):1528-1532.
[14] Gauger K J,Bassa L M,Henchey E M,et al.Mice deficient in Sfrp1 exhibit increased adiposity,dysregulated glucose metabolism,and enhanced macrophage infiltration[J].PLoS One, 2013,8(12):e78320.
[15] Rosen O M.Structure and function of insulin receptor[J].Diabetes,1989,38(12):1508-1511.
[16] West I C.Radicals and oxidative stress in diabetes[J].Diabet Med,2000,17(1):171-180.
[17] Washington K,Wright K,Shyr Y,et al.Hepatic stellate cell activation in nonalcoholic steatohepatitis and fatty liver[J].Human Pathology,2000,31(7):822-828.
[18] Coutinho E M,Athayde C,Atta G,et al.Gossypol blood levels and inhibition of spermatogenesis in men taking gossypol as a contraceptive.A multicenter,international,dose-finding study [J].Contraception,2000,61(1):61-67.
Heptoprotective effect of gossypol in type 2 diabetic rats complicated with non-alcoholic fatty liver disease
WANG Jiayuan,FAN Jianshuang,WU Liang,et al.Pharmacy of Chinese Medicine,Wenzhou Chinese Medical Hospital,Wenzhou 325015,China
2017-02-21)
(本文编辑:陈丹)
10.12056/j.issn.1006-2785.2017.39.9.2017-326
温州市科技计划项目(Y20120010)
325015 浙江中医药大学附属温州市中医院中药房(王家员、樊建霜);温州医科大学附属第一医院病理科(吴亮、黄卡特、王蓉蓉)
王蓉蓉,E-mail:997683344@qq.com

