Wnt通路及其抑制剂Dickkopf-1在强直性脊柱炎中作用的研究进展
田丽贞 周美菊 张松照 薛静
●综 述
Wnt通路及其抑制剂Dickkopf-1在强直性脊柱炎中作用的研究进展
田丽贞 周美菊 张松照 薛静
Wnt蛋白是一类参与胚胎发生、器官发生、形态发生等过程的分泌性糖蛋白家族。Wnt蛋白与细胞膜上的卷曲蛋白受体结合,引发不同的细胞内信号转导通路,Wnt信号通路调节的失常可引起多种病理变化。Dickkopf-1(DKK1)一种分泌型糖蛋白,通过竞争性结合LRP5/6抑制Wnt信号在细胞内的传递,抑制成骨细胞增值、分化,抑制骨形成。本文就Wnt蛋白信号通路及其抑制物DKK1在强直性脊柱炎(AS)中的作用作一综述,尤其对近几年关于AS患者血清DKK1水平及其与疾病活动度关系研究的相关文献列表作了详尽分析,为AS的发病机制研究提供理论依据。
Wnt信号通路 Dickkopf-1 强直性脊柱炎
强直性脊柱炎(ankylosing spondylitis,AS)是中轴型脊柱关节病(axial spondyloarthropathies,axSPA)中最为经典的疾病类型,是指以炎性腰背痛为主要临床表现、脊柱骨关节受累为主的慢性系统性炎症性疾病,主要侵犯骶髂关节、脊椎关节、外周关节及其邻近的肌腱、韧带等软组织,炎症后往往继发纤维化与钙化,导致骨赘形成,可使脊椎逐渐失去柔软度,晚期可发展到像“竹节”一样无法弯曲或伸展,丧失脊柱原有的功能和形态[1]。流行病学调查结果表明,AS在我国的患病率为0.2%~0.4%,青壮年男性多见,男女患病比例约2∶1~3∶1,估计患病人群超过1 000万,其中约15~100万人有不同程度的残疾,有的甚至为重度残疾,不仅给患者带来高额医疗费用,还造成其巨大的心理负担和劳动力丧失,已经成为了严重的社会公共卫生问题。AS的发病机制尚未完全明确,部分具有较明显的家族聚集现象,其与HLA-B27基因阳性表达密切相关。目前研究认为,与类风湿关节炎(RA)的主要病理表现滑膜炎及骨侵蚀所不同的是,AS的典型病理特征表现为脊柱和肌腱末端过度骨化致韧带骨赘形成。骨结构的破坏过程包括炎症导致骨侵蚀、骨侵蚀处纤维组织过度修复、修复的组织骨化导致新骨形成3个阶段,其中新骨形成则为脊柱畸形及功能丧失的主要原因。而AS现有的治疗方法有功能锻炼、非甾体类抗炎药、TNF拮抗剂及晚期矫形手术治疗等,其中非甾体类抗炎药及TNF拮抗剂的治疗仍主要针对控制疼痛及炎症,对于脊柱及韧带骨化则无能为力。因此,进一步明确其发病机制,围绕骨代谢及新骨形成的机制并拓展相关治疗思路对本病诊治可能开辟全新的途径。本文将对Wnt信号通路及其抑制物Dickkopf-1(DKK1)与骨代谢的关系、以及DKK1在AS中的作用作一综述。
1 Wnt蛋白与Wnt通路及其与骨代谢的关系
Wnt蛋白是一类参与胚胎发生、器官发生、形态发生等过程的分泌性糖蛋白家族。Wnt蛋白与细胞膜上的卷曲蛋白(Frizzled)受体结合,引发不同的细胞内信号转导通路,Wnt信号通路调节的失常可引起多种病理变化。Wnt信号通路包括Wnt/β-连环蛋白(β-catenin)信号通路、Wnt/Ca2+信号通路、Wnt/PCP(平面细胞极性)信号通路等。其中Wnt/β-catenin信号通路也被称为Wnt经典信号通路,当Wnt通路未启动时,β-catenin与支架蛋白,肠腺瘤息肉蛋白,糖原合酶激酶3β(GSK-3β)形成降解复合物,促进了β-catenin的磷酸化,导致βcatenin降解;当Wnt蛋白与卷曲蛋白-低密度脂蛋白受体相关蛋白5/6(LRP5/6)复合受体结合,Wnt信号通路启动,激活胞内的蓬乱蛋白(Dvl),抑制GSK-3β的激活,使降解复合物失去活性,抑制了β-catenin的磷酸化,β-catenin在胞内累积,而后由胞质进入胞核,与T细胞因子/淋巴增强因子转录因子家族成员结合,启动下游靶基因的转录和表达[2](图1)。近年对Wnt信号通路的研究发现Wnt信号通路与骨代谢有着密切的联系,其一方面参与调节骨髓间充质干细胞向成骨细胞分化,同时抑制其向脂肪细胞或软骨细胞分化,促进成骨细胞的增殖及分化,另一方面也可以抑制成骨细胞的程序性死亡,间接影响破骨细胞的功能。因此,Wnt信号通路在维持骨组织的平衡中发挥至关重要的作用,Wnt通路及其相关蛋白也已经成为目前研究骨关节系统相关疾病的热点之一。
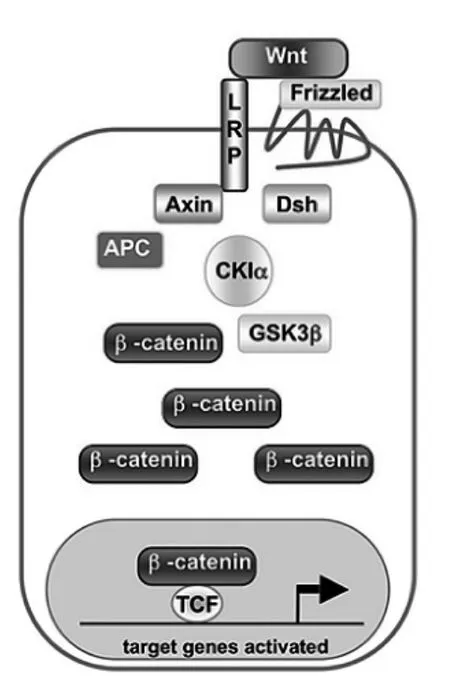
图1 Wnt与Frizzled及LRP结合后激活经典途径,进而促进胞核内靶基因激活
2 DKK1及其对Wnt通路的抑制作用
Wnt信号通路通过对成骨细胞、软骨细胞及破骨细胞等骨组织细胞的调节作用,参与了多种骨关节疾病的骨代谢紊乱过程。DKK1是一种分泌型糖蛋白,它通过竞争性结合LRP5/6抑制Wnt信号在细胞内的传递,从而参与调节细胞的增殖、分化及迁徙等过程[3](图2)。DKK1是通过关闭Wnt信号通路,导致Wnt/β-catenin的经典激活途径受阻,从而抑制成骨细胞增值、分化,抑制骨形成,故也被认为是Wnt信号通路的天然抑制物。以往对DKK1的研究主要集中在肿瘤领域,近年来,随着对Wnt信号通路与骨形成关系的认识逐渐深入,进一步探索DKK1在骨关节疾病中的作用及将DKKl作为新的生物标记物及治疗干预靶点已成为新的研究热点。实验也证实过度表达的DKK1能抑制骨髓基质细胞向成骨细胞分化,使成骨细胞数量减少,还能抑制骨基质的矿化及骨折后的修复[4]。而在一些破骨细胞活性增加的疾病中,抑制DKK1的作用使其表达降低,进而激活Wnt通路使成骨细胞活动增加,对于骨量减少性疾病的治疗具有一定的意义。有研究发现在骨质疏松及RA患者中具有高表达的DKK1,其作为Wnt通路信号的抑制剂,可使成骨细胞分化进程受阻,从而抑制骨形成,并可能间接作用于破骨细胞而诱导骨侵蚀[5]。因此,最近研究开发的DKK1多表位DNA疫苗正是通过中和DKK1的作用达到对关节炎动物模型骨侵蚀保护作用的目的。

图2DKK1通过与LRP结合阻断Wnt通路
3 DKK1与AS关系的研究现状
目前关于DKK1与AS的研究相对较少,由于AS病理变化不同于RA、骨质疏松等骨关节疾病,其异位骨化的病理过程更为突出,因此Wnt通路及DKK1在该病中的可能作用机制也成为了研究热点之一。已有研究发现,AS患者中DKK1表达降低,从而诱导Wnt家族成员高表达,促使成骨细胞特异性基因表达增加,促进骨形成。可能对AS晚期的软骨细胞再生、韧带骨化及假关节形成都起着重要作用。但是,也有部分研究表明在某些AS患者血清中DKK1表达反而升高,可能是其疾病活动期诱发骨侵蚀的机制之一。因此,进一步明确AS不同病情活动状态下DKK1表达及其对Wnt通路的作用具有重要的临床意义。
Yucong等[6]近期报道了在AS患者血清中功能型DKK1表达下降,且与该类患者影像学评分呈负相关,初步提示了DKK1在本类疾病的作用和潜在应用价值。但对于SPA中不同疾病亚型及不同疾病活动度的患者中DKK1表达情况并未进行深入探讨,其是否通过Wnt/β-catenin经典途径发挥作用也属未知。因此,深入了解DKK1在SPA中的作用机制及其与病情活动及疾病亚型的相关性对于SPA的治疗选择具有重要意义,也可能为SPA的治疗提供全新视角。
实验动物研究方面,Diarra等[7]研究用DKK1拮抗剂处理TNF-转基因小鼠,发现DKK1拮抗剂组小鼠成骨细胞增多并有骨赘形成,表明DKK1可抑制Wnt信号通路从而抑制骨形成。另外,实验表明DKK1除了直接干扰Wnt通路的信号转导过程,还可通过影响NF-κB受体活化因子(RANKL)和骨保护素的表达,作用于破骨细胞的产生及骨吸收过程。Uderhardt等[8]发现应用DKK1拮抗剂的小鼠模型阻断DKK1后小鼠X型胶原的表达上调,肥大软骨细胞数量增加,骶髂关节内βcatenin含量明显增加,并出现骶髂关节的融合,说明阻断DKK1能促进骶髂关节的融合,进一步提示其在SPA骶髂关节的病变中起了重要的作用。其次,小鼠血清中骨保护素水平明显增加,关节的破骨细胞数量减少,骨吸收受到抑制,提示DKK1还能通过骨保护素影响骨代谢的过程。然而检索近几年关于AS患者血清DKK1水平的18篇相关研究文献,发现在不同的文献中结论不一。其中有9篇报道结果表明AS患者血清的DKK1较健康对照组明显降低,支持DKK1降低与AS新骨形成有关[8-16];6篇报道得出了结论相反的研究结果,AS患者血清中DKK1水平较对照组明显升高[17-23];2篇报道则认为AS患者与对照组外周血中DKK1水平相似,无统计学差异[11,24];还有1篇分别测定了AS患者血清中总的DKK1水平和与LRP-6-FC结合的功能型DKK1水平,结果表明血清总DKK1水平在AS患者和健康对照组中差异无统计学意义,而功能型DKK1在AS患者组明显低于健康对照组[6]。Kwon等[9]测定了56例AS患者和40例对照组的血清DKK1水平,发现AS患者血清的DKK1较对照组明显降低,支持DKK1降低与AS新骨形成有关。Heiland等[10]随访了65例AS患者2年,发现有新的韧带骨赘形成患者血清功能型DKK1水平较无韧带骨赘形成患者低,提示上调DKK1可能是AS患者避免形成韧带骨赘的保护性因素,该研究还发现DKK1与骨硬化蛋白相关,因此认为功能型DKK1可作为患者预测韧带骨赘形成的生物标记物之一,但是DKK1与C反应蛋白(CRP)无关,提示DKK1与急性炎症反应无关。Ustun等[17]检测了44例AS患者和41例健康对照组的血清DKK1和骨硬化蛋白水平,并把AS组分成接受和未接受抗TNF-α治疗的两组,发现AS患者外周血DKK1和骨硬化蛋白水平低于健康对照组,差异有统计学意义,而接受和未接受抗TNF-α治疗的两组血清DKK1和骨硬化蛋白水平相似,活动和非活动患者水平相似,巴氏AS放射学评分(BASRI)与血清DKK1及骨硬化蛋白水平不相关。而Wang等[18]研究发现AS患者(126例)DKK1水平与RA患者(41例)相近,均明显高于对照组,且DKK1与骨生物学标志物、Bath强直性脊柱炎疾病活动指数(BASDAI)、夜间痛、晨僵及CRP之间未见显著相关性。Daoussis等[19]发现AS患者血清DKK1水平较健康对照组升高(P<0.05),且在不同性别AS患者中DKK1差异无统计学意义。Elshishtawy等[20]发现AS患者DKK1水平虽然较对照组升高,但其中人类白细胞抗原(HLA)-B27阳性组DKK1水平较HLA-B27阴性组低,而且发现DKK1水平与脊柱巴氏AS放射学指数(BASRI-S)及修订后的Stoke-AS脊柱评分(mSASSS)评分呈负相关。国内单振兴等[21]测定了45例AS患者和20例对照组的DKK1水平,发现AS患者血清的DKK1较对照组明显升高,进一步研究发现中晚期AS患者DKK1水平较早期患者明显降低,随着AS骨化程度的进展,DKK1表达呈下调趋势;陈枝琼等[22]测定了45例AS患者和20例对照组的DKK1水平,发现AS患者血清的DDK1较对照组明显升高,且与BASDAI评分呈正相关,而使用TNF-α拮抗剂组DKK1水平降低。de Andrade等[11]和Taylan等[24]则认为AS患者外周血DKK1水平与健康对照组无统计学差异。Yucong等[6]分别测定了AS患者血清中总的DKK1水平和与LRP-6-FC结合的功能型DKK1水平,结果表明血清总DKK1水平在AS患者和健康对照组中差异无统计学意义,而功能型DKK1在AS患者组明显低于健康对照组,且与该类患者影像学评分呈负相关。总之,AS患者DKK1及Wnt/β-catenin通路在不同文献中结论不一,更需要进一步研究明确。
4 总结与展望
综上所述,DKK1作为Wnt通路的调节蛋白,其在脊柱关节病患者血清中表达升高或是降低是否与病程、疾病活动度、血清型别、骨赘形成与否等病变亚型进一步相关,又或者与检测方法有关,应该检测与受体LRP-6-Fc结合的功能型DKK1,目前均尚无统一的结论,同时联合检测其经典代谢途径中Wnt/β-catenin通路蛋白表达的水平也尚属空白,DKK1联合相关指标检测是否能作为AS新骨形成的标记物等问题还有待进一步研究明确。近几年兴起的精准医学治疗理念就是指在充分了解患者的遗传背景和临床特征之后,根据各临床指标对患者的预后发展和适用药物作出精准预判,选择最符合患者个性特点的治疗方案。SPA等风湿性疾病是临床上最富有个性和差异的一大类疾病,是最适合应用精准医学理念的一大类疾病。因此,通过研究Wnt通路及其抑制剂DKK1在AS中的作用机制,对AS患者的遗传学、分子生物学、病理学等特征进行更深入的了解,对于其发病机制的探讨和发现新的干预靶点具有重要意义,更加促进其趋向于精准医疗。进一步研究DKK1在SPA患者血清中的表达对患者病情评价和预后判断也具有重要的指导意义。
[1] Braun J,Sieper.Ankylosing spondylitis[J].Lancet,2007,369 (5970):1379-1390.
[2] Rao TP,K hl M.An updated overview on Wnt signaling pathways:a prelude for more[J].Circ Res,2010,106(12):1798-1806.
[3] Niehrs C.Function and biological roles of the Dickkopf family of Wnt modulators[J].Oncogene,2006,25(10):7469-7481.
[4] Lia J,Sarosib I,Russell C,et al.DKK1 mediated inhibition of wnt signaling in bone results in osteopenia[J].Bone,2006,39(4): 754-766.
[5] Wang S Y,Liu YY,Ye H,et al.Circulating dickkopf-1 is correlated with bone erosion and inflammation in rheumatoid arthritis[J].J Rheumatol,2011,38(5):821-827
[6] Yucong L,Lu L,Shengfa Y,et al.Serum functional dickkopf-1 levels are inversely correlated with radiographic severity of ankylosing spondylitis[J].Clin lab,2014,60(9):1527-1531.
[7] Diarra D,Stolina M,Polzer K,et al.Dickkopf-1 is a master regulator of joint remodeling[J].Nat Med,2007,13(3):156-163.
[8] Uderhardt S,Diarra D,Katzenbeisser J,et al.Blockade of Dickkopf(DKK)-1 induces fusion of sacroiliac joints[J].Ann Rheum Dis,2010,6(9):592-597.
[9] Kwon S R,Lim M J,Suh C H,et al.Dickkopf-1 level is lower in patients with ankylosing spondylitis than inhealthy people and is not influenced by anti-tumer necrosis factor therapy[J]. Rheumatolint,2012,32(8):2523-2527.
[10] Heiland G R,Appel H,Poddubnyy D,et al.High level of functional dickkopf-1 predicts protection from syndesmophyte formation in patients with ankylosing spondylitis[J].Ann Rheum Dls,2012,71(4):572-574.
[11] de Andrade K R,de Carstro D R,Vicente G,et al.Evaluation of circulating leveols of inflammatory and bone formation marks in axial spondyloarthritis[J].Int immunopharmacol,2014,21(2): 481-486.
[12] Korkosz M,Gasowski J,Leszczynski P,et al.High disease activity in ankylosing spondylitis is associated with increased serum sclerostin level and decreased wingless protein-3a signaling but is not linked with greater structural damage[J].BMC Musculoskelet Disord,2013,14(3):338-342.
[13] Klingberg E,Nurkkala M,Carlsten H.Biomarkers of bone metabolism in ankylosing spondylitis in relation to osteproliferation and osteoporosis[J].J Rheumatol,2014,41(7):1349-1356.
[14] Rossini N,Viapiana O,Idolazzi L,et al.Higher level of Dickkopf-1 is asociated with low bone mineral density and higher prevalence of vertebral fractures in pationts with ankylosing spondylitis[J].Calcif Tissue Int,2015,98(5):438-445.
[15] 章懿婷,陈志伟,邓迎苏,等.强直性脊柱炎患者血清Dickkopf-1、抗酒石酸酸性磷酸酶5b的意义[J].中国血液流变学杂志,2014,24 (3):383-386.
[16] 谢建民,赵成.强直性脊柱炎患者血清DKK-1水平与骨影像学变化的相关分析[J].风湿病与关节炎,2015,4(5):13-17.
[17] Ustun N,Tok F,Kalyoncu U,et al.Sclerostin and DKK1 in patient with ankylosing spondylitis[J].Acta Reumatol port,2014,39(2): 146-151.
[18] Wang,Moitow S,Mallon C,et al.DKK-1 levelsare comparably increased in patients with as and RA,show similar decreases with anti-TNF therapy,and are not associated with markers of bone remodeling[J].Ann Rheum Dis,2008,67(2):129-134.
[19] Daoussis D,iossis S N,Solomou E E,et al.Evidence that DKKl dysfunctionalIn ankylosing spondylitis[J].Arthritis Rheum,2010, 62(1):150-158.
[20] Elshishtawy H,Assaf N,Farouk N.Diekkopf-1 in ankylosing spondylitis:relation To spinal dysmobility and radio findings[J]. Egypt Rheumatol,2012,34(3):111-117.
[21]单振兴,韩金祥,崔亚洲,等.强直性脊柱炎患者血清中DKK1的表达及其意义[J].医学检验与临床,2011,22(1):1-2.
[22]陈枝琼,李向培,厉小梅,等.强直性脊柱炎患者血清中Dickkopf-1和硬骨素的表达及临床意义[J].安徽医科大学学报,2013,48(6):671-674.
[23]崔银凤,张莉芸,张改连,等.中轴型脊柱关节炎血清Dickkopf-1表达及相关性分析[J].当代医学,2015,21(5):8-11.
[24] Taylan A,Sari I,Akinci B,et al.biomarkers and cytokines of bone turnover:extensive evaluation in a cohort of patients with ankylosing spondylitis[J].BMC Musculoskelet Disord,2012,13 (6):1-7.
(本文编辑:严玮雯)
更正启事
本刊2017年第39卷第8期第648页沈晓勇《多层螺旋CT与MRI对胰腺囊性肿瘤诊断价值的比较研究》一文其中一位作者“江晓华”应改为“江小华”。特此更正,并向读者致歉。
本刊编辑部
2016-11-25)
10.12056/j.issn.1006-2785.2017.39.9.2016-1966
321000 金华市中医医院风湿免疫科(田丽贞);浙江大学医学院附属第二医院风湿免疫科(周美菊、薛静),检验科(张松照)
薛静,E-mail:jingxue@zju.edu.cn

