肺癌化疗患者院内感染病原菌及耐药性分析
郭 阳,孙玉玲,王海英
(首都医科大学附属北京世纪坛医院 感染科,北京100038)
肺癌化疗患者院内感染病原菌及耐药性分析
郭 阳,孙玉玲,王海英
(首都医科大学附属北京世纪坛医院 感染科,北京100038)
目的 分析肺癌化疗者医院感染的病原菌特点及耐药性情况。方法 2013年2月至2016年10月在我院接受化疗治疗的104例肺癌患者的临床资料,分析入选者的感染部位、感染病原菌及不同病原菌对抗菌药物的耐药性情况。结果 出现医院感染的104例肺癌化疗者中,呼吸道感染者比例最高(56,53.8%)。共分离出110株感染病原菌,其中以革兰阴性菌为主(73株,66.4%),其次是革兰阳性菌(30株,27.3%),真菌(7株,6.4%)。革兰阴性菌对青霉素的耐药率最高(57株,78.1%),革兰阳性菌对青霉素G的耐药率最高(22株,73.3%),真菌对氟康唑耐药率最高(5株,71.4%)。 结论 了解行化疗治疗的肺癌医院感染者的病原菌及其耐药性特点,促进临床抗菌药物的合理使用,给临床诊断提供一定的理论依据。
医院感染;化疗;肺癌;耐药性;病原菌
(ChinJLabDiagn,2017,21:0813)
目前肺癌的发病率和病死率增长均较快[1];我国恶性肿瘤病发率中肺癌的发病率位居榜首。临床上诊治、预防肺癌的技术随着现代医学水平的发展而不断提升[2]。迄今为止,化疗是晚期肺癌患者最重要的一种治疗方式,然而化疗会降低患者的免疫细胞数量,导致机体的免疫功能大幅下降,显著增加患者医院感染率[3]。相关研究结果显示,接受化疗治疗的肺癌患者继发感染是引发患者死亡的主要原因[4]。目前临床上主要以抗菌药物来对抗病菌的侵袭,然而,肺癌感染者由于致病菌对一些抗菌药物有了一定的耐药性,大大降低了治疗效果,故掌握接受化疗的晚期肺癌者医院感染的病原学特点,调查其具体的耐药情况对患者生存期的延长有着十分重要的临床意义。本研究旨在通过对行化疗治疗的肺癌患者出现医院感染的病原菌特点与耐药性结果的分析,以期为出现医院感染的肺癌化疗者的治疗提供一定的理论依据。
1 资料与方法
1.1 研究对象
分析2013年2月至2016年10月在我院接受化疗治疗的104例肺癌患者的临床资料。入选者均由手术活检与病理学穿刺术确诊,其中男57例,女47例,平均(59.1±3.2)岁,住院时间(41.2±9.3)d。根据病理类型可以分成非小细胞肺癌(NSCLC)40例、肺鳞癌30例和肺腺癌34例三种。入选者均经细胞学或病理学证实,并经病原学、体征及影像学检查均确诊为医院感染者,诊断依据为我国卫生部2001年颁布的《医院感染诊断标准》。本研究经我院医学伦理委员会批准,患者知情同意此次研究并签署相关知情同意书。
1.2 研究方法
将入选者呼吸道标本保留,其中7例肺泡灌洗液、28例咽拭子、69例痰液,采用由法国生物梅里埃公司生产的培养基、常规哥伦比亚琼脂实验室培养细菌。每份标本均接种巧克力平板、羊血平板及萨布罗培养基进行苛养菌、普通细菌及真菌的培养,同时通过API检定系统给予菌种鉴定。通过药敏试验检测所有的菌株的耐药性,用纸片法扩散法药敏检测头孢呋辛、环丙沙星、头孢他啶、哌拉西林、亚胺培南、庆大霉素,采用由英国Oxoid公司提供的药敏纸片,根据国家制定的抗菌药的相关药敏试验标准判断抗菌药物的敏感性。
1.3 统计学方法

2 结果
2.1 医院感染部位的分布情况
出现医院感染的104例肺癌化疗者中,呼吸道感染者56例(53.8%),泌尿道感染者22例(21.2%),口咽部感染者19例(18.3%),胃肠道感染者4例(3.8%),其它部位感染者3例(2.9%)。
2.2 入选者病原菌分布情况
表1结果提示,104例出现医院感染的肺癌化疗者的送检标本共分离出病原菌110株,其中真菌7株(白色假丝酵母菌),革兰阳性菌30株(金黄色葡萄球菌等),革兰阴性菌73株(铜绿假单胞菌等)。
2.3 真菌对常规抗菌药物的耐药情况
表2结果提示,真菌对常用抗菌药物(包括伊曲康唑、氟康唑及氟胞嘧啶等)的耐药率均比较高。
2.4 革兰阳性菌对常规抗菌药物的耐药情况
表3结果提示,革兰阳性菌对常用抗菌药物(包括环丙沙星、青霉素G、林可霉素等)的耐药率均比较高。
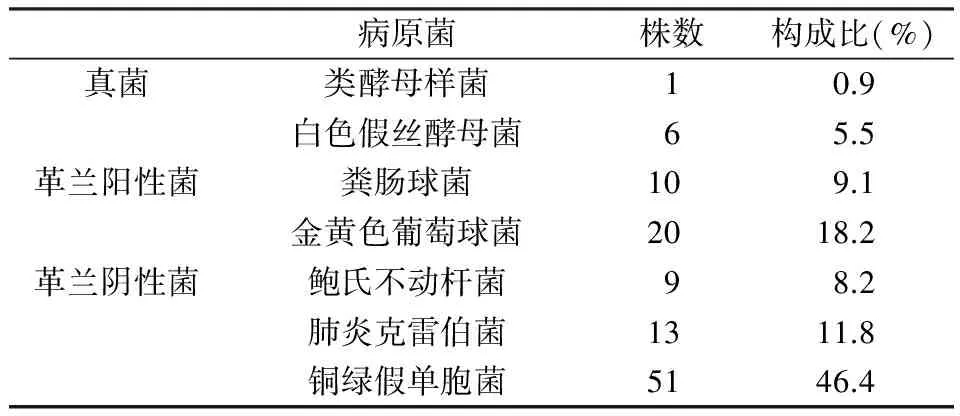
表1 入选者病原菌分布情况

表2 真菌对常规抗菌药物的耐药情况

表3 革兰阳性菌对抗菌药物的耐药情况
2.5 革兰阴性菌对常用抗菌药物的耐药性
表4结果提示,革兰阴性菌对常用抗菌药物(包括环丙沙星、阿奇霉素、林可霉素、青霉素等)的耐药率均比较高。

表4 革兰阴性菌对抗菌药物的耐药情况
3 讨论
目前肺癌患者的发病率及病死率呈逐年递增趋势,临床上主要通过化疗方式治疗,然而化疗在灭杀癌细胞时,也会杀死患者的正常免疫因子及细胞,故行化疗治疗的肺癌患者往往会出现各种并发症,其中医院肺部感染就是一种最常见、最严重的并发症,此类患者的发生率呈显著上升趋势[5]。目前虽然采用综合治疗提升了患者的生存率,但化疗期间还是无法避免由于骨髓抑制而引发细菌感染,使患者病情进一步加重,故控制肺癌化疗者的医院感染率已是广大学者的研究焦点[6]。目前我国主要通过常规抗菌药物来控制医院感染发生率,然而病原菌对常规抗菌药物的敏感性随着治疗时间的不断延长而逐渐降低,部分还产生了耐药性,故掌握出现医院感染的肺癌化疗者的病原菌及其耐药性特点,对降低行化疗的肺癌患者的医院感染率有着极其重要的意义[7]。
本研究发现,肺癌化疗者的感染部位大多集中在呼吸道,考虑原因可能是此类患者的呼吸道黏膜损伤严重,而化疗药物对患者的呼吸道有着很大的杀伤力有关。此外,医院感染病原菌中大部分为革兰阴性菌,其次是革兰阳性菌,其中革兰阴性菌中主要是铜绿假单胞菌,革兰阳性菌中主要是金黄色葡萄球菌,此结果与以往的大量研究结果相吻合。目前我国临床上主要采用头孢曲松、青霉素及阿奇霉素等常规抗菌药物治疗出现医院感染的肺癌化疗者[8]。细菌存在个体差异,对抗菌药物的耐药性也各有不同,大量研究结果显示,病原菌对氨基糖苷类药物的耐药性普遍较高,对头孢类抗菌药物的耐药性普遍较低[9,10]。
[1]Yamazaki N,Kawabe M,Tanaka H,et al.[Open Drainage for Mediastinitis after Endobronchial Ultras,onography-guided Transbronchial Needle Aspiration][J].Kyobu Geka,2016,69(5):384.
[2]熊华联.肺癌住院患者医院感染的临床分析[J].现代诊断与治疗,2014,25(19):4473.
[3]Hwang KE,Hwang YR,Seol CH,et al.Clostridium difficile Infection in lung cancer patients[J].Jpn J Infect Dis,2013,66(5):379.
[4]Goss GD,O'Callaghan C,Lorimer I,et al.Gefitinib versus placebo in completely resected non-small-cell lung cancer:results of the NCIC CTG BR19 study[J].J Clin Oncol,2013,31(27):3320.
[5]Kanda S,Horinouchi H,Fujiwara Y,et al.Cytotoxic chemotherapy may overcome the development of acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors (EGFR-TKIs) therapy[J].Lung Cancer,2015,89(3):287.
[6]Kubota K,Sakai H,Katakami N,et al.A randomized phase Ⅲ trial of oral S-1 plus cisplatin versus docetaxel plus cisplatin in Japanese patients with advanced non-small-cell lung cancer:TCOG0701 CATS trial[J].Ann Oncol,2015,26(7):1401.
[7]Noro R,Yoshimura A,Yamamoto K,et al.Alternating chemotherapy with amrubicin plus cisplatin and weekly administration of irinotecan plus cisplatin for extensive-stage small cell lung cancer[J].Anticancer Res,2013,33(3):1117.
[8]贾 磊,马燮峰,蔡 莹,等.肺癌患者术后感染的危险因素分析[J].中国消毒学杂志,2015,32(2):178.
[9]Díaz-Ravetllat V,Ferrer M,Gimferrer-Garolera JM,et al.Risk factors of postoperative nosocomial pneumonia after resection of bronchogenic carcinoma[J].Respir Med,2012,106(10):1463.
[10]Joo EJ,Kang CI,Ha YE,et al.Clinical predictors of Pseudomonas aeruginosa bacteremia among Gram-negative bacterial infections in non-neutropenic patients with solid tumor[J].J Infect,2011,63(3):207.
Analysis of the etiologic characteristics of nosocomial infections for patients with lung cancer treated chemotherapy
GUOYang,SUNYu-ling,WANGHai-ying.
(DepartmentofInfectiousDiseases,BeijingShijitanHospitalofCapitalMedicalUniversity,Beijing100038,China)
Objective Our retrospective study was aimed to analyze the etiologic characteristics of nosocomial infections for patients with lung cancer treated chemotherapy.Methods Clinical data of 104 patients with lung cancer
treatment of chemotherapy at our hospital from February,2013 to October,2016 was retrospectively analyzed.The infection site distribution,species susceptible to pathogens as well as their constituent ratio,and drug resistance of different pathogens to commonly used antibiotic was performed was analyzed.Results Among 104 patients with lung cancer received treatment of chemotherapy,the patients with respiratory tract infections accounted for 53.8% (56 cases).A total of 110 strains pathogenic bacteria infection isolated,the major pathogens were the gram-negative bacteria (66.4%),followed by the gram-positive bacteria (27.3%) and fungus (6.4%).The drug resistance rate of the gram-negative bacteria to penicillin was the highest (78.1%).The drug resistance rate of the gram-positive bacteria to penicillin G was the highest (73.3%).The drug resistance rate of the fungus to fluconazole was the highest (71.4%).Conclusion The understanding of the etiologic characteristics of nosocomial infections for patients with lung cancer treated chemotherapy can relatively low resistance for patients infected with different types of bacterial is of great clinical significance to effectively treat patients with pulmonary infections,promote clinically rational use of antibiotics,increase the efficiency of infection control,which offering certain theoretical basis for clinical diagnosis.
Nosocomial infections;chemotherapy;lung cancer;drug resistance;pathogen
1007-4287(2017)05-0813-03
R378
A
2016-12-23)

