人小涎腺间充质干细胞与骨髓间充质干细胞的增殖和成脂比较
曹 蕊,严 笠,张 辰,孙雪健,赵振民
人小涎腺间充质干细胞与骨髓间充质干细胞的增殖和成脂比较
曹 蕊,严 笠,张 辰,孙雪健,赵振民
(中国医学科学院整形外科医院研究中心 北京 100144)
目的:通过对人小涎腺干细胞(human Minor Salivary Gland Mesenchymal Stem Cells, hMSGMSCs)与人骨髓间充质干细胞(human Bone Marrow Mesenchymal Stem Cells,hBMSCs)的增殖、活力、凋亡以及成脂分化能力等生物学特性的比较,证实小涎腺干细胞具有高度自我更新能力并具有向脂肪细胞分化的潜能,为其成为新型的理想种子细胞提供理论基础。方法:提取临床患者的hMSGMSCs和hBMSCs各3例,利用MTS细胞增殖与毒性检测试剂盒,检测两种细胞的490nm吸光度值(optical density,OD490nm)的变化并绘制增殖曲线,比较两种细胞的增殖能力;利用MUSE细胞分析仪检测两种细胞的活力和凋亡,并加以比较;对两种细胞进行成脂诱导,2周后油红O染色,镜下观察及用异丙醇溶解成脂细胞吸附的油红O染料,检测OD490nm,比较脂滴形成情况。结果:hMSGMSCs 比hBMSCs具有更强的增殖能力(P<0.05),将其传至30代仍很好地保持细胞的活性;两种干细胞活力及凋亡情况检测无明显差异(P>0.05);两种细胞成脂诱导2周后OD490nm无明显差异(P>0.05)。结论:hMSGMSCs 将有望成为理想的种子细胞,应用于细胞治疗和再生医学研究。
小涎腺干细胞;骨髓间充质干细胞;细胞增殖曲线;凋亡;成脂诱导
人成体干细胞是一类具有自我更新能力和多向分化潜能的细胞,在合适的条件下或给予合适的信号,可以分化成多种功能细胞或组织器官用于治疗多种传统方法难以治愈的疾病。人骨髓中存在一定量的hBMSCs,能够在一定条件下分化为脂肪细胞、骨细胞、软骨细胞等,相关研究报道证实其为理想的种子细胞来源[1-3]。但因取材较为困难,创伤大,获得的细胞数量有限,因此研究者陆续从其它组织中寻找间充质干细胞。近年来,已有研究证实大唾液腺组织中含有间充质干细胞,可作为种子细胞,应用于细胞治疗和再生医学研究[4-8]。本课题组已成功从小涎腺中提取成纤维样细胞,并对其进行流式细胞学和免疫相关标志物检测,证实hMSGMSCs强表达间充质干细胞的标志物[9-10]。本次研究主要是对小涎腺干细胞和骨髓干细胞的一些生物学特性做比较,进一步证实hMSGMSCs具有很强的自我复制能力并具有良好的成脂分化潜能,可为今后的细胞治疗提供理想的种子细胞。
1 材料和方法
1.1 材料:hMSGMSCs来源于3例中国医学科学院整形外科医院唇部手术需要切除的小涎腺组织,3例hBMSCs同样来源于本院的髂骨松质骨切取时髂骨伤口内流出的骨髓血组织,患者平均年龄10岁,无腺体相关疾病和自身免疫性疾病病史。本研究所使用样本均获患者知情同意,经医学伦理委员会批准。
1.2 主要试剂和仪器:DMEM 高糖培养基(Gibco)、胎牛血清(Gibco)、青链霉素(Hyclone)、胰蛋白酶(Hyclone)、3-异丁基-1-甲基黄嘌呤(IBMX)(Sigma)、胰岛素(Sigma)、吲哚美辛(Sigma)、地塞米松(Sigma)、主要仪器:二氧化碳孵箱(美国Thermo)、倒置显微镜(Nikon TE2000-S)、酶标仪(Enspire)、生物电脉冲分析仪(Muse Cell Analyer)、流式细胞仪(BD FACSAriaTMⅡ Cell Sorter)。
1.3 培养基配方:①普通完全培养基:DMEM 高糖、10%胎牛血清、1%青链霉素;②成脂诱导液(100ml);DMEM高糖、10%胎牛血清、1%青链霉素、IBMX0.5mmol/L、胰岛素10µmol/L、吲哚美辛200µmol/L、地塞米松10nmol/L。
1.4 实验方法
1.4.1 hBMSCs体外分离培养:临床上手术中收集从髂骨伤口内流出的5ml骨髓血采用淋巴细胞分离液梯度离心提取骨髓间充质干细胞,将5ml骨髓血沿管壁缓慢加入到已有等体积淋巴细胞分离液的离心管内,离心15min,1500rpm,小心吸取上中层交界处的白色絮状层,即单核细胞层,放入另一个离心管中,用等体积无血清培养基洗涤2次(每次离心5min,1500rpm),轻轻吸除上清液,加入10%FBS DMEM约5ml,制成细胞悬液,接种培养,3d后换液。细胞汇合至80%后1:2或1:3传代。
1.4.2 hMSGMSCs的体外分离培养:将采集到的小涎腺组织标本转移到培养皿中,用冷的PBS洗两遍,尽量去除分泌液。用眼科剪和眼科镊去除多余的结缔组织,分离出完整的小涎腺。吸去培养皿中的全部液体,用眼科剪将其剪成大约0.5mm3的小块,操作过程中避免组织过度干燥。用眼科镊将剪碎的组织块均匀铺在T25培养瓶的底部,每个组织块间距5mm,小心放入完全培养基后竖立放于37℃,5%CO2培养箱中,6h后组织块贴附于瓶底时慢慢放倒培养瓶,使组织块完全浸在完全培养基中。接种4d后换液,弃去未贴壁的组织块。之后每3d换液一次。细胞汇合至80%后1:2或1:3传代。
1.4.3 对hMSGMSCs细胞表面标志物进行流式细胞学检测:将第5代hMSGMSCs细胞消化至单细胞悬液,1 000rpm离心5min,弃上清,加PBS重悬,再重复本步骤一次。细胞计数后,用Staining Buffer重悬细胞至106/100µl,分装至1.5ml离心管中,100µl/管。根据抗体说明书加入抗体,避光冰上孵育30min。每管添加1ml Staining Buffer吹打细胞,离心300g,5min,弃上清,重复本步骤,弃上清后每管细胞重悬于300µl Staining Buffer,2h内上机检测。
1.4.4 hBMSCs和hMSGMSCs的生长曲线的比较:将第5代的两种细胞消化后分别计数,接种于96孔板中,每孔加入200µl细胞悬液,约2 000个/孔,共计每种细胞接种21孔。细胞接种第2天开始,每天选择3孔吸除上清液后,加入无血清培养基100µl,再采用细胞增殖与毒性检测试剂盒(CellTiter 96® Aqueous One Solution Assay),加入甲臢化合物3-(4,5-二甲基噻唑-2-基)-5-(3-羧甲酯基)-2-(4-磺苯基)-2H-四唑(金翁),内盐(MTS)溶液20µl,摇匀后37℃孵育4h,在酶联免疫检测仪上测定每孔在490nm波长的光密度值(OD值)。连续检测7d,绘制生长曲线,未检测的细胞3d换液一次。
1.4.5 hMSGMSCs和 hBMSCs细胞活力以及细胞凋亡情况的比较:取第5代同等数量的两种细胞经胰蛋白酶消化,完全培养基终止后将细胞悬液离心,用1%FBS的PBS洗一次后,加1%FBS PBS 1ml重悬细胞,分别取两种细胞的细胞悬液20µl加入380µl MuseTMCount & Viability Cell Reagent MCH100102,轻轻吹打混匀后常温避光孵育5min,利用Muse细胞分析仪进行细胞活力检测。分别取两种细胞悬液100µl加入100µl MuseTMAnnexin V &Dead Cell Reagent MCH100105,轻轻吹打混匀后常温避光孵育20min,利用Muse细胞分析仪进行细胞凋亡检测。
1.4.6 hBMSCs和hMSGMSCs成脂诱导和检测:将第5代的hMSGMSCs和hBMSCs分别以5×104/孔各接种一个六孔板的四孔,孵育24h后将四孔分为两组,一组两孔是对照组,加入普通完全培养基,另一组两孔加入成脂诱导培养基。培养14d后固定,进行油红O染色,显微镜下观察细胞成脂分化情况。以60%的异丙醇溶解染色后的成脂细胞[11],采用酶标仪检测490nm时的吸光度值,吸光度值与成脂细胞的多少成正比,从而对两种细胞成脂分化能力进行比较。
1.4.7 统计学方法:采用SPSS17.0软件,数据以均数±标准差表示,用独立样本t检验(Independ-Samples t test)对检测结果进行统计学分析,当P<0.05时认为差异有统计学意义。
2 结果
2.1 hBMSCs原代及传代细胞镜下观察结果:原代培养24h后细胞开始贴壁生长,贴壁细胞逐渐由圆形转化成为长梭形,并呈集落样分布,随着培养时间的延长,细胞的形态方向趋于一致,漩涡样生长,每3d换液一次,细胞汇合至90%时进行1:3传代。细胞传至10代后细胞生长明显减慢,细胞状态变差,传代的间隔延长许多。见图1A、图1B。
2.2 hMSGMSCs原代及传代细胞镜下观察结果:体外分离得到的1~2个小涎腺,接种于一个25cm2培养瓶,接种5~6d开始有细胞爬出,有的呈上皮样从组织周围爬出,也有的为成纤维样细胞散在生长。每3d换液一次,原代培养10d左右传第一代,用0.25%胰酶37℃消化1min,成纤维样细胞基本全部消下来,转移至另一个培养瓶中,从而达到两种形态的细胞分离,传2~3代后可得到纯化的细胞,本研究对象是成纤维样细胞。成纤维样细胞平均每3d传代一次,传至30代细胞状态良好。见图1C、图1D。
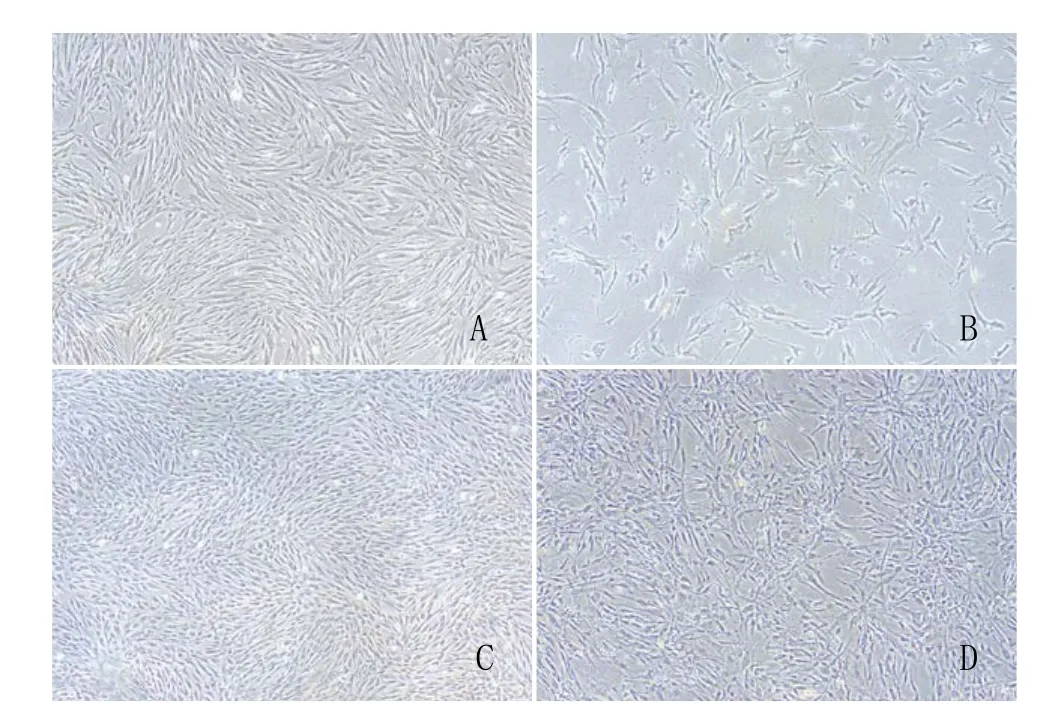
图1 hBMSCs和hMSGMSCs原代及传代细胞镜下观察结果
2.3 hMSGMSCs细胞表型流式细胞学检测结果:对培养至第5代的hMSGMSCs细胞标志物进行流式细胞学检测,结果发现hMSGMSCs高表达的表面标志物大多与间充质干细胞一致,包括:CD29、CD73、CD90、CD105和CD166,但有一个例外CD44,该标志物被认为在上皮细胞中表达。上皮细胞标志物CD49f及造血干细胞标志物CD34和CD45为阴性。见表1。

表1 hMSGMSCs流式细胞学检测结果
2.4 细胞增殖检测结果:采用MTS方法检测细胞在培养24、48、72、96、120、144、168h的吸光度值(OD490nm),结果如图2所示,在培养72、120、144、168h后,小涎腺间充质干细胞的增殖比骨髓间充质干细胞显著升高,差异均具有统计学意义(P72=0.0329,P120=0.0498, P144=0.0154, P168=0.0145)。
2.5 细胞凋亡检测结果:采用Annexin V & Dead Cell Reagent检测,结果证实hMSGMSCs的凋亡细胞百分比为(23.35±3.633)%,hBMSCs的凋亡细胞百分比为(17.88±2.105)%,二者无显著性差异(P=0.868)。见图3。
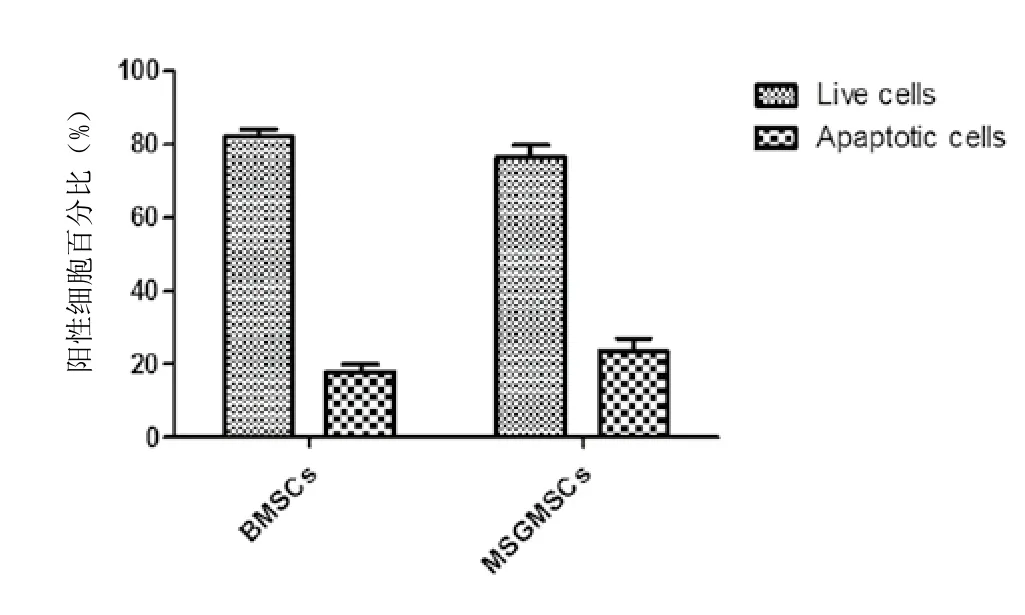
图3 hBMSCs和hMSGMSCs细胞凋亡检测比较
2.6 细胞活力检测结果:采用Count & Viability Cell Reagent检测,结果证实hMSGMSCs的活性细胞百分比为(78.45±6.809)%,hBMSCs的活性细胞百分比为(71.72±9.986)%,二者无显著性差异(P=0.389)。见图4。
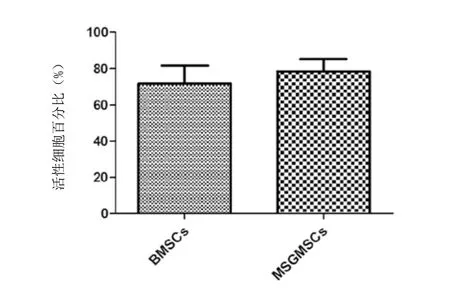
图4 hBMSCs和 hMSGMSCs 细胞活力检测比较
2.7 细胞成脂诱导分化能力检测结果:以成脂诱导培养基诱导14d后,采用油红O染色并采用酶标仪检测490nm时的吸光度值,结果证实hMSGMSCs在诱导后OD490nm为0.3679±0.2006, hBMSCs在诱导后OD490nm为0.2526±0.1402,二者无显著性差异(P=0.4604)。见图5、图6。
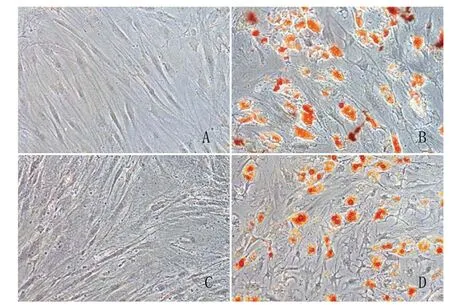
图5 hBMSCs 和hMSGMSCs成脂诱导14d后油红O染色脂滴形成情况比较(×200)
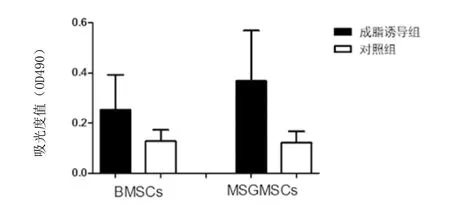
图6 hBMSCs和hMSGMSCs成脂诱导分化能力检测比较
3 讨论
已有文献报道人的腮腺存在间充质干细胞,小涎腺与其组织结构和细胞成分类似,可能同样含有此种干细胞,而且小涎腺位于口腔粘膜下,取材方便,来源丰富,切取后不影响供区的结构和功能[9,12]。目前对于人小涎腺组织中的成体干细胞的研究很少,无详细报道。本研究已成功利用组织贴壁法从小涎腺中提取小涎腺间充质干细胞,在原代培养初期从组织周围长出一些混杂的细胞,一种是紧密排列在组织周围的铺路石样的上皮细胞,另一种是散在生长的成纤维样细胞,通过胰酶消化时间差异将两种细胞分离,在富含血清的完全培养基中,上皮细胞不能生长,故细胞传至3代后就得到纯化的间充质干细胞,细胞在体外扩增传至30代时,通过对30代细胞活力的检测证实它很好地保持了干细胞的一些增殖活性,由此可以经体外培养扩增得到足量的种子细胞。
本研究中通过hMSGMSCs细胞表型流式细胞学检测结果可知,hMSGMSCs可强表达间充质干细胞通常表达的标记物,包括CD29、CD44、CD73、CD90、CD105以及CD166[13],与BMSC一致;细胞增殖检测结果显示小涎腺来源的间充质干细胞比骨髓来源的间充质干细胞具有更强的增殖能力;细胞成脂诱导分化能力检测结果表明二者成脂诱导分化能力无差异。且单个小涎腺原代培养的效率与5ml骨髓原代培养的效率相似[14],因此获得同样多的原代细胞需要的小涎腺组织量较少。相关研究表明,hMSGMSC还具有SOX2和巢蛋白阳性表达,SOX2可以调控成体干细胞的多能性,并且在多种上皮组织中可维持组织稳态[15-16]。提示hMSGMSCs具有未成熟干细胞的特质,具有分化潜能。一项研究发现巢蛋白阳性的细胞在组织受损后可以很快做出反应,进入增殖状态修复组织的损伤。可见巢蛋白的表达提示hMSGMSCs具有组织储备干细胞的特征[17]。
综上,hMSGMSCs在体外培养扩增方面优于hBMSCs,能够通过较少的小涎腺组织量培养获得充足的间充质干细胞,并具有与hBMSCs相似的干细胞特性,因此hMSGMSCs将有望成为理想的种子细胞,应用于细胞治疗和再生医学研究中。
[1]赵勤鹏.定向诱导分化环境下骨髓间充质干细胞向成骨及成脂细胞的分化[J].中国组织工程研究,2015,19(32):5103-5107.
[2]鲁先闯,张志峰,黄健.骨髓间充质干细胞修复软骨损伤的应用前景[J].中国组织工程研究,2015,19(19):3083-3088.
[3]范公忍,李树玲,郑海燕,等.骨髓干细胞移植治疗肝硬化的基础与临床研究现状[J].现代生物医学进展,2015,15(10):1957-1960.
[4]林铃,牛道立.下颌下腺放射性损伤及干细胞治疗的研究进展[J].广州医科大学学报,2014,42(6):101-104.
[5]颜兴,李扬,许诺,等.多样本人腮腺间充质干细胞诱导ips细胞的对比研究[J].口腔医学,2016,36(11):972-975,979.
[6]JensenD H,Oliveri R S,Trojahn Kolle S F,et al. Mesenchymal stem cell therapy for salivary gland dysfunction and xerostomia:a systematic review of preclinical studies[J].Oral Surg Oral Med Oral Pathol Oral Radiol,2014,117(3):335-342,e331.
[7]Gao Z,Wu T,Xu J,et al.Generation of Bioartificial Salivary Gland Using Whole-Organ Decellularized Bioscaffold[J].Cells Tissues Organs,2014,200(3-4):171-180.
[8]Lim JY,Yi T, Lee S,et al.Establishment and Characterization of Mesenchymal Stem Cell-Like Clonal Stem Cells from Mouse Salivary Glands[J]. Tissue Eng Part C Methods,2015,21(5):447-457.
[9]杜明娟,赵振民,严笠,等.人小涎腺成纤维样单克隆细胞的成骨分化[J].中国美容医学,2010,19(4):523-526.
[10]Lu L,Li Y,Du MJ,et al.Characterization of a Self-renewing and Multi-potent Cell Population Isolated from Homan Minor Salivary Glands[J].Sci Rep,2015,5:10106.
[11]龚志锦,詹镕洲.病理组织制片和染色技术[M].上海:上海科学技术出版社,1994:136-137.
[12]蒋练,黄桂林,姜群,等.腺体组织损伤后体外分离下颌下腺干/祖细胞后的克隆化培养[J].中国组织工程研究与临床康复,2009,13(49):9765-9768.
[13]裴雪涛.干细胞生物学[M].北京:科学出版社,2003:108-112.
[14]Russell KC,Phinney DG,Lacey MR,et al.In vitro high-capacity assay to quantify the clonal heterogeneity in trilineage potential of mesenchymal stem cells reveals a complex hierarchy of lineage commitment[J].Stem Cells,2010,28(4):788-798.
[15]Ellis P,Fagan BM,Magness ST,et al.SOX2,a persistent marker for multipotential neural stem cells derived from embryonic stem cells,the embryo or the adult[J].Dev Neurosci,2004,26(2-4):148-165.
[16]Arnold K,Sarkar A,Yram MA,et al.SOX2(+) adult stem and progenitor cells are important for tissue regeneration and survival of mice[J].Cell Stem Cell,2011,9(4):317-329.
[17]Wiese C,Rolletschek A,Kania G,et al.Nestin expression–a property of multi-lineage progenitor cells [J]. Cell Mol Life Sci,2004,61(19-20):2510-2522.
Comparative Study on Proliferative and Adipogenic Ability of Human Minor Salivary Gland Mesenchymal Stem Cells and Bone Marrow Mesenchymal Stem Cells
CAO Rui,YAN Li,ZHANG Chen,SUN Xue-jian,ZHAO Zhen-min
(Plastic Surgery Hospital,Chinese Academy of Medical Sciences & Peking Union Medical College,Beijing 100144,China)
Objective To identify the self-renewal and adipogenic differentiation potential and explore ideal seed cells for cell therapy and bioengineered organ, we compared the biological characters including cell proliferation,vitality, apoptosis and adipogenic differentiation ability between human minor salivary gland mesenchymal stem cells (hMSGMSCs) and human bone marrow mesenchymal stem cells (hBMSCs). Methods hMSGMSCs and hBMSCs derived from 3 patients were isolated and cultured. 3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sul-fophenyl)-2H-tetrazolium, inner salt (MTS) assay were used to detect proliferative ability of cells, and the growth curve was plotted according to the absorbance of 490 nm. Cell vitality and apoptosis were measured by MUSE cell analyzer. The adipogenic differentiation of cells was induced for two weeks, and the lipid droplets formation in cells were stained with the Oil Red O and were observed under the microscope, and the optical density at 490 nm (OD490nm) was detected after being dissolved in isopropanol. Results The proliferative ability of hMSGMSCs was higher than hBMSC, and hMSGMSCs could maintain stem cell vitality until the passage 30 (P<0.05). No statistically signif i cant differences of the cell vitality, apoptosis and adipogenic differentiation ability between hMSGMSCs and hBMSCs were found (P>0.05). Conclusion hMSGMSCs has the potential to become one kind of desirable seed cell for basic research and cell therapy in regenerative medicine.
hMSGMSCs;hBMSCs;the cells growth curve;apoptosis;adipogenic differentiation.
Q813.1
A
1008-6455(2017)05-0031-04
2017-01-21
2017-03-28
编辑/张惠娟
赵振民,中国医学科学院整形外科医院研究中心,教授,研究方向:整形外科和再生医学;E-mail:zhaozhenmin0098@vip.sina.com
曹蕊,中国医学科学院整形外科医院研究中心,主管技师;研究方向:细胞生物学;E-mail:caorui660428@sina.com

