运动上调GPR48-RANKL通路影响2型糖尿病小鼠破骨细胞分化
陈祥和,孙 朋,杨念恩,李世昌,徐会金,张娜娜
运动上调GPR48-RANKL通路影响2型糖尿病小鼠破骨细胞分化
陈祥和1,孙 朋2,杨念恩3,李世昌2,徐会金2,张娜娜4
目的:探究T2DM小鼠OC分化变化及不同力学刺激通过GPR48-RANKL通路对T2DM小鼠OC分化的分子调控作用。方法:40只4周龄雄性C57BL/6小鼠,适应性喂养1周后随机分为T2DM造模组(30只)和正常对照组(ZC,10只)。T2DM造模组小鼠6周高脂膳食结束空腹12 h后注射STZ,2周后检测小鼠血糖,有27只造模成功并将其随机分为T2DM对照组(TC,9只)、T2DM游泳组(TS,9只)和T2DM游泳组(TD,9只),TS和TD组小鼠分别进行8周游泳和下坡跑训练。结束后,取右侧股骨并利用RT-PCR法检测相关因子mRNA表达;取左侧胫骨并利用West-blotting法检测相关因子蛋白表达;取小鼠BMM并诱导其向OC分化,利用TRAP染液对OC染色;取右侧胫骨并利用游标卡尺检测其大小。结果:与ZC组相比,TC组GPR48、OPG、RANKL、RANK、NFATc2、CTSK的mRNA和GPR48、RANKL、RANK蛋白表达均显著变化(P<0.05或P<0.01),OC数量显著增多,远端冠状面宽度和近端冠状面宽度显著变小(P<0.05)。与TC组相比,TS组GPR48、OPG、RANKL、NFATc2、CTSKmRNA和GPR48、RANKL蛋白表达均显著变化(P<0.05或P<0.01),OC数量显著减少;TD组GPR48、OPG、RANKL、RANK、NFATc2、CTSKmRNA和GPR48、RANKL、RANK蛋白表达均显著上调(P<0.05或P<0.01),OC数量显著减少,胫骨长度和中间矢状轴宽度显著减少(P<0.05或P<0.01)。与TS组相比,TD组OPG和CTSKmRNA及GPR48、RANK、RANKL蛋白表达均显著变化(P<0.05或P<0.01),OC数量显著减少。结论:T2DM小鼠OC分化显著增强;直接作用力激活T2DM小鼠骨中GPR48-RANKL通路,进而抑制RANK及其下游靶基因表达,抑制OC分化,且其作用效果优于间接作用力。
G蛋白偶联受体48;核因子κB受体活化因子配体;不同力学刺激;Ⅱ型糖尿病;破骨细胞
Ⅱ型糖尿病(Type 2 diabetes mellitus,T2DM)作为一内分泌代谢疾病,其破骨细胞(Osteoclast,OC)分化异常升高,骨吸收增强,导致骨质疏松并发症发生[1]。而G蛋白偶联受体48(G protein coupled-receptor 48,GPR48)作为膜上一个7次跨膜受体,其在骨代谢中扮演关键角色[2]。研究证实,GPR48可负向调控RANKL,进而通过OPG-RANKL-RANK分子轴上调其靶基因NFATc2、CTSK等表达,促进小鼠骨髓巨噬细胞(Bone marrow-derived macrophage,BMM)向OC分化[3]。运动作为调控骨吸收的重要手段,其通过OPG-RANKL-RANK分子轴失活进而抑制OC分化[4]。并且研究发现,因运动方式不同对骨产生的力学刺激方式(分为直接和间接力学刺激)存在较大差异,且直接力学刺激抑制骨吸收的作用效果优于间接力学刺激[5]。然而,目前有关运动影响T2DM小鼠OC分化及其分子调控机制的相关研究尚鲜有报道。基于以上,本研究进行T2DM小鼠造模,并利用游泳和下坡跑分别模拟间接和直接力学刺激对其进行干预。通过检测相关因子的mRNA和蛋白表达、OC分化等指标,探究不同力学刺激对T2DM小鼠OC分化的影响及其分子调控机制。
1 材料与方法
1.1 实验动物
4周龄雄性C57BL/6小鼠40只[生产证号:SYXX(沪)2015-0011],适应性喂养1周后随机选取30只进行T2DM造模(前6周高脂膳食,结束空腹12 h后按80 mg/Kg体重标准一次性注射链脲佐菌素(Streptozotocin,STZ),2周后检测血糖,血糖≥8 mmol/L为T2DM小鼠[6],27只造模成功),剩余10只为正常对照组(ZC)。将T2DM小鼠随机分为T2DM对照组(TC,n=9)、T2DM游泳组(TS,n=9)和T2DM下坡跑组(TD,n=9)。T2DM小鼠继续进行高脂膳食,ZC小鼠喂以普通饲料,自由饮水,每天光照时间12 h。(动物伦理编号:M20150311)。
1.2 运动方案
利用游泳和下坡跑分别对TS组和TD组小鼠进行运动干预。具体方案如下:游泳:水温(32±1)℃、50 min/次、1次/天、6天/周、共8周;下坡跑:50 min/次、坡度-9 ℃,1次/天、6天/周、共8周。
1.3 指标检测
1.3.1 骨中相关因子mRNA表达检测 最后1次训练结束24 h后,断颈椎处死小鼠。取小鼠右侧股骨,Omni匀浆机研磨后,按标准步骤提取RNA并将其反转为cDNA,再按定量试剂盒步骤对相关靶基因mRNA表达进行检测。利用Primer premer软件设计相关引物序列(表1)并由上海生工生物工程有限公司进行合成。

表1 引物序列Table 1 Primer sequence

表2 运动对T2DM小鼠骨中相关因子mRNA表达影响
注:与ZC组相比,*表示P<0.05,**表示P<0.01;与TC组相比,★表示P<0.05,★★表示P<0.01;与TS组相比,●表示P<0.05,●●表示P<0.01,下同。
1.3.2 骨中相关因子蛋白表达检测 右侧胫骨研磨后,提取蛋白并用BCA法测其浓度。利用PBS将蛋白调到统一浓度后,加等量Loading buffer并于95 ℃进行5 min变性(同时配制分离胶和浓缩胶)。结束后,12 000 g×2 min离心,混匀,再重复1次。加样并进行电泳。结束后,PVDF膜甲醇浸泡后,进行转膜。将膜于0.2%丽春红中50 s后,ddH2O洗膜,随后5%脱脂奶粉封闭1~2 h。然后,孵Ⅰ抗(稀释1 000倍)且4 ℃过夜。TBST洗膜,10 min/次,共4次。孵Ⅱ抗2 h,TBST洗膜4次,10 min/次。将PVDF膜置于显影液中并用Alpha凝胶成像系统进行显影拍照并用自带软件进行数据分析。
1.3.3 BMM分化产生OC检测 断颈椎处死小鼠,按标准步骤取BMM并诱导其向OC分化[3]。于分化的第5天,利用4% PFA固定OC后,进行TRAP染色[7],利用Canon相机和Leica显微镜进行拍照并利用Blindness法进行计数。
1.3.4 胫骨形态大小检测 取小鼠右侧胫骨并利用游标卡尺对其形态大小指标进行测量。
1.4 数据分析
利用Excel、GraphPad Prism 5和SPSS18.0对实验检测的数据进行分析(ZC组和TC组进行独立样本T检验,TC组、TS组和TD组进行单因素方差分析),P<0.05和P<0.01分别表示差异具有显著性和差异具有非常显著性。
2 研究结果
2.1 不同力学刺激对T2DM小鼠骨中相关因子mRNA表达的影响
分析表2可知,与ZC组相比,TC组GPR48、OPG、RANKL、RANK、NFATc2和CTSK的mRNA表达均显著变化(P<0.05或P<0.01)。与TC组相比,TS组GPR48、OPG、RANKL、NFATc2和CTSK的mRNA表达均显著变化(P<0.05或P<0.01);TD组GPR48、OPG、RANKL、RANK、NFATc2和CTSK的mRNA表达均显著变化(P<0.05或P<0.01)。与TS组相比,TD组OPG和CTSK的mRNA表达显著变化(P<0.05)。
2.2 不同力学刺激对T2DM小鼠骨中相关因子蛋白表达的影响
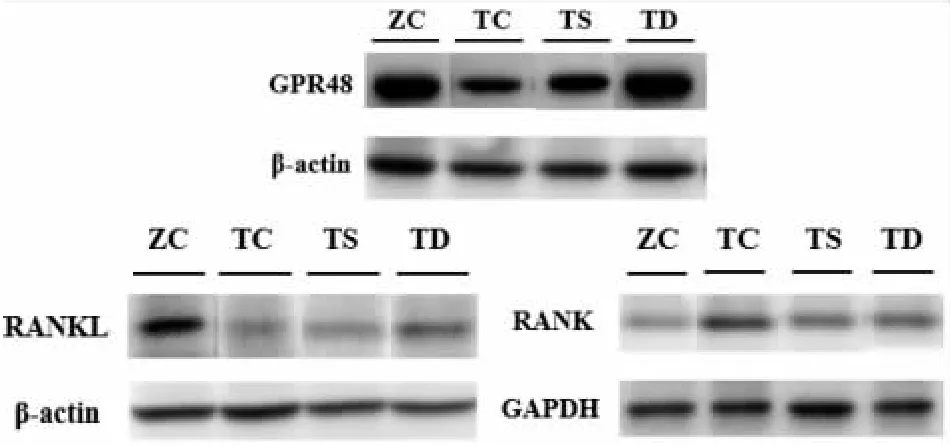
图1 不同运动组T2DM小鼠相关因子蛋白表达示意图Graph 1 Expression of related factors in T2DM mice with different exercise

表3 不同力学刺激对T2DM小鼠骨中相关因子蛋白表达影响
由图1和表3可知,与ZC组相比,TC组GPR48和RANKL蛋白表达下调(P<0.05或P<0.01),RANK蛋白表达上调(P<0.01)。与TC组相比,TS组GPR48和RANKL蛋白表达上调(P<0.05);TD组GPR48和RANKL蛋白表达上调(P<0.05或P<0.01),而RANK蛋白表达显著下调(P<0.05)。与TS组相比,TD组GPR48蛋白表达上调(P<0.05),RANK蛋白表达下调(P<0.01)。
2.3 不同力学刺激对T2DM小鼠OC分化的影响
由图2所示,与ZC组相比,TC组OC数量显著增多。与TC组相比,TS组OC数量显著减少,而TD组OC数量亦出现显著减少。与TS组相比,TD组OC数量显著减少。

图2 不同力学刺激对T2DM小鼠OC分化的影响Graph 2 Effect of mechanics stimulation on OC differentiation in T2DM mice
2.4 不同力学刺激对T2DM小鼠胫骨骨形态大小的影响

表4 不同力学刺激对T2DM小鼠胫骨骨形态大小的影响
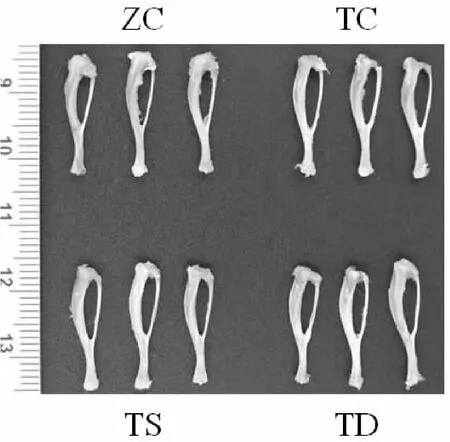
图3 不同力学刺激对T2DM小鼠胫骨骨形态的影响(1×)Graph 3 Effect of mechanical stimulation on tibial morphology in T2DM mice (1×)
由图3和表4可知,与ZC组小鼠相比,TC组胫骨远端冠状面宽度和胫骨近端冠状面宽度显著变小(P<0.05)。与TC组相比,TD组胫骨长度和中间矢状轴宽度显著减少(P<0.05或P<0.01)。
3 讨论分析
T2DM的OC分化异常升高,导致骨吸收增强,骨量和骨形态大小下降[8-9]。该过程受众多关键分子或途径调控。GPR48作为膜上7次跨膜受体[10],敲除GPR48或其表达下调后,小鼠OC分化及骨吸收能力增强,使得骨形态大小下降[2,11]。而OPG-RANKL-RANK分子轴作为调控OC分化的重要途径,其下游靶基因活化T细胞核因子2 (Nuclear factor of activated T cells ,NFATc2)、组织蛋白酶K(Cathepsin K,CTSK)、AP-1等表达上调,促进T2DM的OC分化产生[12]。最近研究发现,GPR48是RANKL的另一膜上受体,其通过胞外结构域(ECD)同RANKL竞争性与RANK结合,激活Gαq 和GSK-3β信号通路及下游靶基因NFATc2、CTSK、抗酒石酸酸性磷酸酶(Tartrate-resistant acid phosphatase,TRAP)等表达,促进OC分化[3]。目前有关T2DM小鼠骨中GPR48-RANKL途径被抑制后促进RANK激活,上调其靶基因表达的相关研究较少报道。本研究中,TC组GPR48mRNA和蛋白表达及OPG和RANKLmRNA表达均下调,而RANK、NFATc2和CTSK表达上调,说明T2DM通过GPR48-RANKL途径,上调RANK及下游靶基因表达。这与T2DM小鼠骨中胰岛素样生长因子(Insulin-like growth factors,IGFs)信号途径被抑制有关,研究发现,IGF-1表达下调会抑制GPR48表达[13]。
OPG-RANKL-RANK分子轴在运动改善OC分化及骨吸收中起重要介导作用[14]。T2DM促进OC分化,而运动可抑制T2DM的OC分化[15]。目前有关运动改善T2DM骨代谢的研究集中在骨表型上,其分子调控机制尚不清晰。探究GPR48-RANKL通路在运动抑制T2DM小鼠OC分化中调控作用的研究较少。本研究中,与TC组相比,TS组GPR48、OPG、RANKL、NFATc2和CTSKmRNA表达上调,但RANK的mRNA和蛋白表达均无变化,表明游泳虽可激活GPR48,但并不能抑制OPG-RANKL-RANK分子轴及其下游靶基因。究其原因,与游泳对T2DM小鼠骨产生的间接作用力抑制OC分化的作用效果不显著,GPR48/RANKL比值低,RANKL仍可激活RANK有关。而TD组GPR48、OPG、RANKL、RANK、NFATc2和CTSK表达均显著变化且与TS组相比,TD组OPG和CTSKmRNA表达下调,而GPR48和RANK蛋白表达均显著变化。表明下坡跑可上调T2DM小鼠骨中GPR48-RANKL通路及下游靶基因表达。分析两种运动结果差异,与T2DM小鼠骨受到的力学刺激方式不同密切相关[5]。下坡跑对T2DM小鼠骨产生的直接力学刺激可上调作为GPR48配体的R-Spondin1/2/5表达,通过作用于GPR48胞外肽链N端并将其激活后抑制OPG-RANKL-RANK分子轴及其靶基因NFATc2、CTSK等表达[16]。再者与直接力学刺激上调活性转录因子4 (Activating transcriptional factor4,ATF4)[17]和激活血管内皮细胞生长因子受体2 (Vascular endothelial growth factor receptor 2, VEGFR2)-RAS信号通路[18]有关,ATF4与GPR48具有联控作用且ATF4表达上调可激活GPR48-RANKL途径[19]。而VEGFR2可通过MEK-ERK/JNK通路作用于Ras蛋白进而上调T2DM小鼠骨中GPR48-RANKL途径及下游靶基因表达[20]。
T2DM小鼠BMM向OC的分化异常升高[21],而有关T2DM促OC分化的研究较多[22-23],在此不多赘述。本研究中,TC组OC数量显著增多,这与前人研究结果相一致。这与T2DM小鼠骨中GPR48-RANKL通路被抑制后,RANK及其下游靶基因表达上调密切相关。运动作为改善骨吸收的有效手段,其对T2DM小鼠OC分化的作用又如何呢?本研究中,与TC组相比,TS和TD组OC数量均显著减少,而TD组OC数量更少。说明,下坡跑抑制T2DM小鼠OC分化的作用效果优于游泳。下坡跑对T2DM小鼠产生的直接力学刺激可激活GPR48-RANKL通路,抑制RANK及其下游靶基因NFATc2和CTSK表达,从而抑制造血祖细胞向TRAP阳性单核前OC分化及单核OC向多核OC融核[24]。直接力学刺激促进T2DM小鼠成骨细胞(Osteoblast,OB)分化,OB分化增多上调RANKL表达,下游PI3K/Akt和ERK信号通路及靶基因DAP12表达失活,抑制T2DM小鼠OC分化[25]。
骨形态是宏观上评价骨代谢的经典指标,T2DM小鼠骨代谢紊乱使的骨形态显著下降[26]。Camerino C等[27]研究发现,T2DM小鼠胫骨长度和骨形态宽度均显著降低。Burkemper KM等[28]研究亦发现,T2DM小鼠第1~5腰椎的长度显著降低。本研究中,TC组远/近端冠状面宽度均显著降低,说明T2DM小鼠胫骨冠状面宽度显著减少。这与T2DM小鼠分化产生的OC数量增多,骨吸收增强有关[29]。再者与主导T2DM小鼠骨变粗的膜内成骨下降,使得骨形态变小亦有关[30]。运动可显著改善T2DM的BMD、骨生物力学等指标[31]。本研究中,TS组各指标呈下降趋势但变化不显著,而TD组胫骨长度和中间矢状轴宽度显著增加。说明下坡跑可显著增加T2DM小鼠骨形态大小,而游泳作用影响不显著。分析原因,下坡跑对骨产生的直接力学刺激可显著抑制T2DM小鼠OC分化,使得骨吸收降低及骨丢失减少[32]。再者与直接力学刺激提高T2DM小鼠骨形成,骨中Col1、OCN、BSP等有机质增多,利于钙、磷等矿物质沉积,使得骨形态大小增加[33]。
4 结论
T2DM小鼠OC分化显著增强; 直接力学刺激激活T2DM小鼠骨中GPR48-RANKL通路,进而抑制RANK及其下游靶基因表达,抑制OC分化,且其作用效果优于间接作用力。
[1] CAO J J. Effects of obesity on bone metabolism[J]. J Orthop Surg Res,2011,15(6):30-35.
[2] LUO J,ZHOU W,ZHOU X,et al. Regulation of bone formation and remodeling by G-protein -coupled receptor 48[J]. Development,2009,136(16):2747-2756.
[3] LUO J,YANG Z,MA Y,et al. LGR4 is a receptor for RANKL and negatively regulates osteoclast differentiation and bone resorption[J]. Nat Med,2016,22(5):539-546.
[4] 李世昌,季浏,马涛,等. 不同方式跑台运动对去卵巢小鼠破骨细胞分化及相关调节因子的影响[J]. 中国体育科技,2011,47(5):134-140.
[5] 陈祥和,李世昌,严伟良,等. 不同方式运动对生长期雄性小鼠骨形成和骨吸收代谢影响的研究[J]. 西安体育学院学报,2015,32(2):205-211.
[6] KANAZAWA I,YAMAGUCHI T,YAMAUCHI M,et al. Serum under carboxylated osteocalcin was inversely associated with plasma glucose level and fat mass in type 2 diabetes mellitus[J]. Osteoporos Int,2011,22(1):187-194.
[7] 杨正峰. RANKL新受体LGR4负调控破骨细胞分化与功能[D]. 上海:华东师范大学,2014.
[8] 陈祥和,李世昌,严伟良,等. Hedgehog 信号通路对成骨细胞分化和骨形成的影响及不同方式运动的调控[J]. 北京体育大学学报,2015,38(11):59-64.
[9] PALERMO A,D'ONOFRIO L,EASTELL R,et al. Oral anti-diabetic drugs and fracture risk,cut to the bone:safe or dangerous A narrative review[J]. Osteoporos Int,2015,26 (8):2073-2089.
[10] LOH E D,BROUSSARD S R,LIU Q,et al. Chromosomal localization of GPR48,a novel glycoprotein hormone receptor like GPCR,in human and mouse with radiation hybrid and interspecific backcross mapping[J]. Cytogenet Cell Genet,2000,89(1-2):2-5.
[11] STYRKARSDOTTIR U,THORLEIFSSON G,SULEM P,et al. Nonsense mutation in the LGR4 gene is associated with several human diseases and other traits[J]. Nature,2013,497(50):517-520.
[12] WANG J,CHEN T Y,QIN S,et al. Inhibitory effect of metformin on bone metastasis of cancer via OPG/RANKL/RANK system[J]. Med Hypotheses,2013,81(5):805-806.
[13] 宋会平.血液成分与骨组织的内在联系及组织工程学评价[D].广州:南方医科大学,2008.
[14] 李世昌,马涛,陈祥和,等.上、下坡跑台运动对去卵巢小鼠骨组织OPG-RANKL-RANK系统的影响[C].第九届全国体育科学大会,2011:489 .
[15] MARTIN M,KRYSTOF S,JIRI R,et al. Modulation of energy intake and expenditure due to habitual physical exercise[J]. Curr Pharm Des,2016,22(24):3681-3699.
[16] ZHU C,ZHENG X F,YANG Y H,et al. LGR4 acts as a key receptor for R-spondin 2 to promote osteogenesis through Wnt signaling pathway[J]. Cell Signal,2016,28(8):989-1000.
[17] HONG Y,KIM J H,JIN Y,et al. Melatonin treatment combined with treadmill exercise accelerates muscular adaptation through early inhibition of CHOP-mediated autophagy in the gastrocnemius of rats with intra-articular collagenase-induced knee laxity[J]. J Pineal Res,2014,56(2):175-188.
[18] LUTZ A H,BLUMENTHAL J B,LANDERS-RAMOS R Q,et al. Exercise-induced endothelial progenitor cell mobilization is attenuated in impaired glucose tolerance and type 2 diabetes[J]. J Appl Physiol,2016,121(1):36-41.
[19] 宋会平,王志强,毕若杰,等. 大鼠创伤性股骨头坏死进程中ATF4与GPR48的表达联控[J]. 山东大学学报(医学版),2014,52(1):42-46.
[20] 赖力. 白花丹醌通过VEGFR2-RAS信号通路抑制肿瘤血管新生以及LGR4通过调节肿瘤干细胞促进乳腺癌发生发展的机制研究[D]. 上海:华东师范大学,2013.
[21] DANKBAR B,FENNEN M,BRUNERT D,et al. Myostatin is a direct regulator of osteoclast differentiation and its inhibition reduces inflammatory joint destruction in mice[J]. Nat Med,2015,21(9):1085-1090.
[22] 马剑侠,成翕悦,薛鹏,等.2型糖尿病大鼠破骨细胞变化[J].河北医科大学学报,2015,36(6):625-627.
[23] 王燕.2型糖尿病骨质疏松症的基础与临床研究[D].石家庄:河北医科大学,2011.
[24] XIE W,LORENZ S,DOLDER S,et al. Extracellular iron is a modulator of the differentiation of osteoclast lineage cells[J]. Calcif Tissue Int,2016,98(3):275-283..
[25] KAMEDA Y,TAKAHATA M,KOMATSU M,et al. Siglec-15 regulates osteoclast differentiation by modulating RANKL-induced phosphatidylinositol 3-kinase/Akt and Erk pathways in association with signaling adaptor DAP12[J]. J Bone Miner Res,2013,28(12):2463- 2475.
[26] MüLLER-BIERL B,LOUIS O,FIERENS Y,et al. Cylinders or walls:A new computational model to estimate the MR transverse relaxation rate dependence on trabecular bone architecture[J]. MAGMA,2014,27(4):349-361.
[27] CAMERINO C,ZAYZAFOON M,RYMASZEWSKI M,et al. Central depletion of brain-derived neurotrophic factor in mice results in high bone mass and metabolic phenotype[J]. Endocrinology,2012,153(11):5394-5405.
[28] BURKEMPER K M,GARRIS D R. Influences of obese (ob/ob) and diabetes (db/db) genotype mutations on lumber vertebral radiological and morphometric indices:skeletal deformation associated with dysregulated systemic glucometabolism[J]. BMC Musculoskelet Disord,2006,7 (1):13-19.
[29] WANG ML,MASSIE J,PERRY A,et al. A rat osteoporotic spine model for the evaluation of bioresorbable bone cements[J]. Spine J,2007,7(4):466-474.
[30] IGNJATOVIC N L,AJDUKOVIC Z R,SAVIC V P,et al. Size effect of calcium phosphate coated with poly-DL-lactide-co-glycolide on healing processes in bone reconstruction[J]. J Biomed Mater Res B Appl Biomater,2010,94(1):108-117.
[31] VOLPON J B,SILVA A V,FALCAI M J,et al. The osteogenic effects of swimming on bone mass,strength,and microarchitecture in rats with unloading-induced bone loss[J]. Microsc Res Tech,2015,78(9):784-791.
[32] LERTSINTHAI P,CHAROENPHANDHU J,SUNTORNSARATOON P,et al. Voluntary wheel running mitigates the stress-induced bone loss in ovariectomized rats[J].J Bone Miner Metab,2015,33(3):261-269.
[33] MARINHO S M,MAFRA D,PELLETIER S,et al. In hemodialysis patients,intradialytic resistance exercise improves osteoblast function:A pilot study[J]. J Ren Nutr,2016,21(16):1051- 1062.
(编辑 李新)
Effects of Exercise on Osteoclast Differentiation through the Up-regulation GPR48-RANKL Pathway in Type 2 Diabetic Mice
CHEN Xianghe1,SUN Peng2,YANG Nianen3,LI Shichang2,XU Huijin2,ZHANG Nana2
Objective:To investigate the change of OC differentiation in T2DM mice and effect of different mechanical stimulation on OC differentiation by GPR48- RANKL pathway in T2DM mice. Methods:Forty four-week old C57BL/6 male mice were randomly divided into normal control group (ZC) and T2DM group. Use the method of high-fat diet and STZ to build the model of T2DM mice,and the T2DM mice were randomly divided into T2DM control group (TC),T2DM swimming group (TS) and T2DM downhill run group (TD). And use the swimming and downhill running to train the T2DM mice for eight weeks. After this,use the RT-PCR to test the mRNA expression in the left tibia. Use the WB to test the protein expression in right femur. Take the BMM and induced it differentiation into osteoclast,use the TRAP solution to dye the osteoclasts. Use the vernier caliper to test the shape size of right tibia. Results:Compared to ZC group,the mRNA expression of GPR48、OPG、RANKL、RANK,NFATc2,CTSK and protein expression of GPR48、RANKL、RANK of TC group were all significantly changed (P<0.05 orP<0.01),the number of OC was significantly increased,the width of distal coronary surface and the surface of the proximal coronary was significantly reduced(P<0.05). Compared to TC group,the mRNA expression of GPR48,OPG,RANKL,NFATc2,CTSK and the protein expression of GPR48 and RANKLof TS group were significantly changed(P<0.05 orP<0.01). The number of osteoclast was significantly reduced. The mRNA expression of GPR48,OPG,RANKL,RANK,NFATc2,CTSK and the protein expression of GPR48,RANKL,RANK were all significantly changed(P<0.05 orP<0.01). The number of osteoclast was significantly reduced,the length of tibia and width of the middle sagittal axis were significantly increased(P<0.05). Compared to TS group,the mRNA expression of OPG,CTSK and the protein expression of GPR48,RANK,RANKL of TD group were significantly changed(P<0.05 orP<0.01),OC number were drastically reduced. Conclusion:The osteoclast differentiation of type 2 diabetic mice was significantly increased. The direct mechanical stimulation activited the GPR48-RANKL pathway,which inhibited the RANK and their target gene expression,and then inhibited the osteoclast differentiation of type 2 diabetic mice. The effect of direct mechanical stimulation was better than that of indirect one.
GProteinCoupledReceptor48;ReceptorActivatorforNuclearFactor-κBLigand;DifferentMechanicalStimulation;Type2DiabetesMellitus;Osteoclast
G804.2 Document code:A Article ID:1001-9154(2017)03-0090-06
江苏省教育科学“十三五”规划课题“跳跃运动对小学生体质与骨健康的影响及其相关性分析研究”(T-b/2016/08);中国博士后科学基金第8批特别资助课题“运动强度调控肥胖青少年生理血压的自主神经机制的研究”(2015T80412)。
陈祥和,博士,讲师,研究方向:运动与骨代谢的机制研究,E-mail:huashixh@163.com。
1. 扬州大学 体育学院,江苏 扬州 225127;2. 华东师范大学 体育与健康学院,上海 200241;3. 安庆师范大学 体育学院,安徽 安庆 246000;4. 海口经济学院 拳星时代体育学院,海南 海口 571127
1. College of Physical Education,Yangzhou University,Yangzhou Zhejiang 225127; 2. College of Physical Education and Health,East China Normal University,Shanghai 200241; 3. College of Physical Education,AnQing Normal University,Anqing Anhui 24600; 4. QUANXING College of Physical,Haikou College of Economics,Haikou Hainan 571127
2017-01-19
2017-03-31
G804.2
A
1001-9154(2017)03-0090-06

