有氧运动和二甲双胍对糖尿病大鼠血清IL-1β、TNF-α和MCP-1的影响
李 俊,王少兵,许桂清 ,姬丽丽,刘一平
有氧运动和二甲双胍对糖尿病大鼠血清IL-1β、TNF-α和MCP-1的影响
李 俊1,2,王少兵2,许桂清2,姬丽丽2,刘一平2
目的:评价有氧运动和二甲双胍对糖尿病大鼠血管炎症反应的影响。方法:对糖尿病大鼠(通过高脂饮食+腹腔注射链脲佐菌素制备)分别进行8周有氧运动、二甲双胍与二甲双胍和运动联合治疗干预,检测干预后糖尿病大鼠糖脂代谢、血管内皮和血管炎症标志物的相关指标,并探讨影响血管炎症反应的途径。结果:糖尿病对照组血清IL-1β、TNF-α和MCP-1浓度均明显高于正常对照组,二甲双胍组血清IL-1β、TNF-α和MCP-1浓度与糖尿病对照组相比没有明显变化,运动组大鼠血清IL-1β、TNF-α和MCP-1浓度显著低于糖尿病对照组,二甲双胍+运动组血清TNF-α浓度明显低于糖尿病对照组、二甲双胍组和运动组,MCP-1浓度明显低于糖尿病对照组。3个干预组血清IL-10浓度均高于糖尿病对照组,但仅有二甲双胍+运动组具有显著性差异。结论:有氧运动和二甲双胍+运动联合干预均能有效缓解糖尿病大鼠血管炎症反应。
糖尿病;有氧运动;二甲双胍;炎症
糖尿病是一种以高血糖为主要特征的非传染性慢性疾病,糖尿病诱导的血管病变是导致糖尿病致残、致死的主要原因, 因此,抑制和缓解糖尿病血管病症在糖尿病的预防和治疗中显得尤为重要。临床研究认为,动脉粥样硬化是引起糖尿病血管病症的直接原因, 而血管炎症在动脉粥样斑块形成过程中 发挥关键作用[14,22],慢性炎症反应贯穿于整个血管病变的发病过程[18]。大量证据显示,肥胖、高血糖、胰岛素抵抗能够诱导慢性炎症的发生,2型糖尿病患者循环血液中炎症因子浓度明显升高[12]。因此,缓解血管炎症对预防和治疗糖尿病血管并发症具有十分重要的意义。
我国对2型糖尿病的临床治疗上主要以降血糖为主,二甲双胍是最常用的双胍类药物,其主要通过减少肝脏糖异生、抑制肠粘膜细胞吸收葡萄糖发挥降糖作用。除此之外,二甲双胍还可以通过增加外周组织胰岛素敏感性,降低血液胰岛素水平[20]。糖尿病血管并发症除了与血糖水平有关,还受到其他多种因素影响,目前仍然需要寻找新的方法和手段来弥补糖尿病治疗的不足。除了临床干预外,生活方式改变,尤其是运动,已被认为是控制2型糖尿病常用的推荐方法。大量实验表明,规律性有氧运动除了可以调节血糖平衡,同时还具有心血管保护作用[10],但其作用的机制还并不十分清楚。本研究试图通过有氧运动和二甲双胍这两种不同的干预手段对血管炎症标志物:促炎因子白介素-1β(IL-1β)、肿瘤坏死因子(TNF-α)、单核细胞趋化因子(MCP-1)和抗炎因子白介素-10(IL-10)的影响作用,评价有氧运动、二甲双胍以及两者联合治疗对糖尿病大鼠血管炎症反应的影响,并探讨其影响的可能途径。
1 研究方法
1.1 实验动物
6周龄清洁级雄性SD大鼠45只[吴氏实验动物中心提供,合格证号:SCXK(闽)2012~0001],体重在200~250 g,分笼饲养,自由进食饮水。室温控制在22oC~24oC,湿度在50%~70%,昼夜循环12 h:12 h。
1.2 糖尿病大鼠制备
适应性喂养1周后,随机选取6只作为正常组,并以普通饲料喂养;其余39只为糖尿病组,采取高脂饲料喂养(15%蔗糖,15%猪油,5%蛋黄粉,0.2%胆酸钠,64.8%基础饲料)。
4周喂养后,大鼠禁食12 h,高脂饮食组大鼠腹腔注射链脲佐菌素(STZ,溶于0.1 mol/L柠檬酸缓冲液),注射剂量为30 mg/kg,正常组同时也腹腔注射相同容量的柠檬酸缓冲液。注射后注意观察大鼠的摄食,饮水和排尿变化。STZ注射后第3、7、14天,大鼠尾部采血测定血糖,最终空腹血糖值大于11.1 mmol/L,确定为糖尿病。
1.3 研究设计
1.3.1 实验分组
正常对照组(Con)6只;糖尿病模型组 分为4组:糖尿病对照组(DM)7只,糖尿病二甲双胍干预组(DM+Met)7只,糖尿病运动干预组(DM+Exe)9只和糖尿病药物运动干预组(DM+Exe+Met)9只。Con组和DM组不进行任何干预;DM+Exe进行8周运动干预;DM+Met组进行8周药物干预;DM+Exe+Met组同时给予二甲双胍和运动2种干预8周。
1.3.2 运动方案
运动采用游泳方式。正式运动干预前,先进行1周适应性游泳训练,第1次游泳时间为15 min,之后逐次增加10 min,共5次。正式干预为1小时/天,5天/周,共8周时间。第1~4周无负重游泳,第5~8周负重1%体重负荷。游泳池为圆形塑料桶,尺寸为60 cm(直径)×75 cm(高),水深45~50 cm,水温控制在32oC~35oC,每桶容纳3只大鼠同时游泳。游泳过程中,时刻监控大鼠游泳状况,防止大鼠溺水淹死。游泳完毕后,及时用干毛巾擦干大鼠身体,并用吹风机烘干。
1.3.3 给药方法
给予喂食二甲双胍药物,药物剂量及喂养方法参考已有研究[13,17],将药物溶入饮水瓶中,第1周剂量为150 mg•kg-1•天-1,第2周为300 mg•kg-1•天-1,第3周调整为400 mg.kg-1.day-1,该剂量一直保持到实验结束。每日监控大鼠饮水量,每周根据体重变化调整一次药物剂量。DM+Met组和DM+Exe+Met组给药方案相同。
1.3.4 样本制备
最后1次运动结束后24 h处死动物,处死前12 h禁食。血液标本以4oC,3 500 r.min-1离心10 min,取上清液,-20oC保存。迅速剥离主动脉,取约5 mm血管放置事先配好的4%多聚甲醛溶液中固定,其余放入冷冻管中,置于-80oC保存。
1.4 血清样本检测
血糖采用血糖仪检测(罗氏卓越血糖仪及配套试纸),总胆固醇(TC)、甘油三酯(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)采用相应试剂盒检测(南京建成生物工程研究所),胰岛素(Insulin)、IL-1β、IL-10、 MCP-1、TNF-α采用ELISA检测法测定(南京建成生物工程研究所),以上指标检测均按照试剂盒说明书进行操作。
1.5 HE染色
取出固定好的主动脉组织,浓度梯度乙醇脱水,二甲苯透明,浸蜡后进行石蜡包埋。将组织样本切片4 um,涂于载玻片上。按照HE染色操作步骤,二甲苯脱蜡,梯度乙醇复水,苏木素-伊红染色,乙醇脱水,二甲苯透明,树胶封片,最后显微镜拍照。
1.6 数据统计
运用SPSS 19.0统计软件,数据采用平均数+标准误表示,组间差异采用T检验或one-way ANOVA,P<0.05认为具有显著性差异。
2 研究结果
2.1 糖尿病模型
STZ注射2周后最终符合糖尿病模型大鼠共32只,造模成功率为80%(表1)。糖尿病模型组注射STZ后,大鼠饮水量明显上升,尿量增加,体重呈现先低后高的变化趋势。糖尿病模型组大鼠空腹血糖(FPG)明显升高,空腹胰岛素(FINS)也明显高于正常对照组,已完全超出正常胰岛素分泌范围,且胰岛素敏感性指数(ISI)显著低于正常对照组,说明糖尿病模型组胰岛素敏感性降低。从这些参数来看,糖尿病模型组大鼠已具有明显的糖尿病特征。
表1 STZ注射后糖尿病模型的基本参数(±S)Table 1 Basic Parameter of Diabetic Model after STZ Injection(±S)
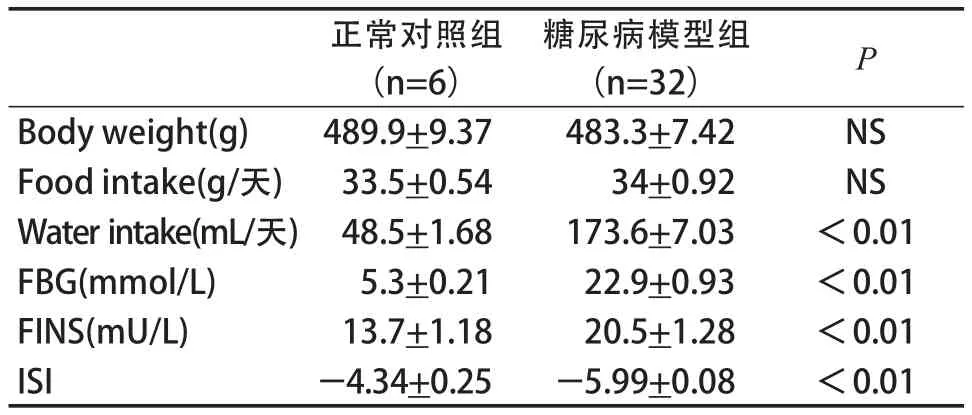
表1 STZ注射后糖尿病模型的基本参数(±S)Table 1 Basic Parameter of Diabetic Model after STZ Injection(±S)
注:Body weight:体重;Food intake:摄食量;Water intake:饮水量;FBG:空腹血糖;FINS:空腹胰 岛素;ISI:胰岛素敏感指数=ln(FBG×FINS)-1。
正常对照组(n=6)糖尿病模型组(n=32) P Body weight(g)483.3+7.42 NS Food intake(g/天) 489.9+9.37 34+0.92 NS Water intake(mL/天) 33.5+0.54 173.6+7.03 <0.01 FBG(mmol/L) 48.5+1.68 22.9+0.93 <0.01 FINS(mU/L) 5.3+0.21-5.99+0.08 <0.01 20.5+1.28 <0.01 ISI 13.7+1.18-4.34+0.25
2.2 有氧运动和二甲双胍对大鼠糖脂代谢的影响
图1显示了STZ诱导的糖尿病大鼠8周干预期内的空腹血糖值的变化。从图中可以看出,所有糖尿病大鼠血糖值随时间推移均呈下降趋势,尤其是4~6周血糖值下降较 为明显,部分可能是由于损伤的胰岛β细胞自我修复的结果。8周干预后,DM+Exe+Met组空腹血糖值最低,而DM组血糖值最高。
表2显示了8周有氧运动和二甲双胍干预后大鼠糖脂代谢的基本指标。从表中可以看出,DM组大鼠总胆固醇(TC)和甘油三酯(TG)明显高于Con组,经过干预后,DM+Exe和DM+Exe+Met组大鼠出现了不同程度的下降,但数据上并没有呈现出统计性差异(P>0.05),DM+Met组没有表现出任何变化。糖尿病对照组高密度脂蛋白胆固醇(HDL-C)水平明显低于正常组,通过有氧运动和二甲双胍干预后,糖尿病大鼠HDL-C和LDL-C出现了一定程度的缓解状态。在血糖代谢方面,DM组FBG、FINS明显高于Con,胰岛素敏感指数较低,DM+Met和DM+Exe+Met组大鼠空腹血糖下降幅度较为明显,DM+Exe组虽然血糖低于糖尿病对照组,但没有表现出统计性差异。3种干预方式均明显改善了糖尿病大鼠胰岛素水平,其中,DM+Exe+Met组在增加胰岛素敏感性上的效果更加突出。

图1 糖尿病大鼠干预周期内空腹血糖变化Figure 1 Fast Glucose Change in Period of Intervention for Diabetic Rats
表2 8周有氧运动和二甲胍干预片大鼠糖脂代谢指标(±S)Table 2 Indicators of Glycolipid Metabolism in Rats(±S)
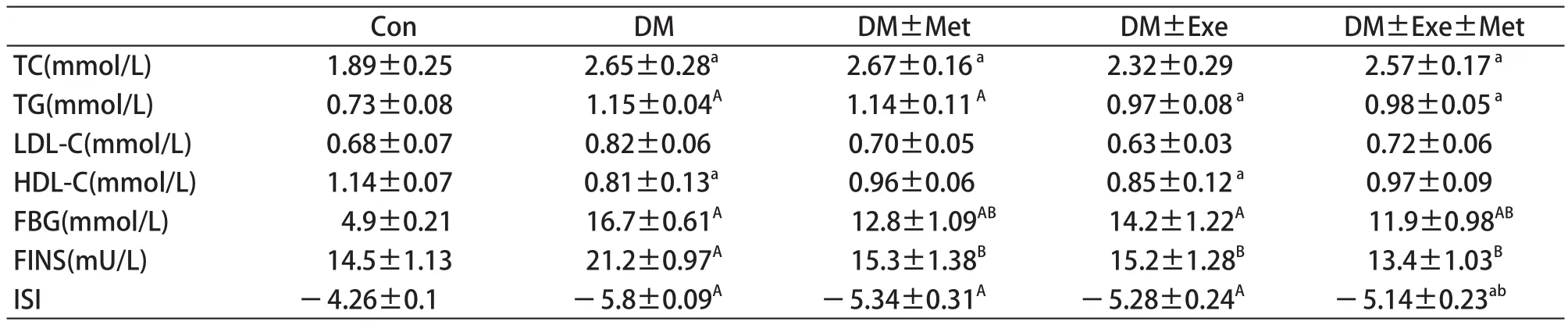
表2 8周有氧运动和二甲胍干预片大鼠糖脂代谢指标(±S)Table 2 Indicators of Glycolipid Metabolism in Rats(±S)
注:a ,P< 0.05,A,P<0.01 vers us Con group;b,P<0.05,B,P<0.01 versus DM group。
Con DM DM±Met DM±Exe DM±Exe±Met TC(mmol/L) 1.89±0.25 2.65±0.28a 2.67±0.16a 2.32±0.29 2.57±0.17aTG(mmol/L) 0.73±0.08 1.15±0.04A 1.14±0.11A 0.97±0.08a 0.98±0.05aLDL-C(mmol/L) 0.68±0.07 0.82±0.06 0.70±0.05 0.63±0.03 0.72±0.06 HDL-C(mmol/L) 1.14±0.07 0.81±0.13a 0.96±0.06 0.85±0.12a 0.97±0.09 FBG(mmol/L) 4.9±0.21 16.7±0.61A 12.8±1.09AB 14.2±1.22A 11.9±0.98ABFINS(mU/L) 14.5±1.13 21.2±0.97A 15.3±1.38B 15.2±1.28B 13.4±1.03BISI -4.26±0.1 -5.8±0.09A -5.34±0.31A -5.28±0.24A -5.14±0.23ab
2.3 有氧运动和二甲双胍对主 动脉血管形态的影响
大鼠主动脉经HE染色后于显微镜下观察血管的形态(图2)。可以看出,Con组血管内侧壁光滑平整,内皮细胞完整,平滑肌细胞排列整齐,而DM组与正常对照组相比,血管内膜粗糙,内皮细胞有脱落现象,损伤较为严重,且血管中层平滑肌细胞排列不整齐。DM+Met和DM+Exe+Met组与正常对照组相比,内皮细胞轻微损伤,平滑肌细胞排列整齐,DM+Exe组血管内皮细胞较正常组具有一定程度损伤,平滑肌细胞排列不规则,但与DM组相比,病变有所缓解。
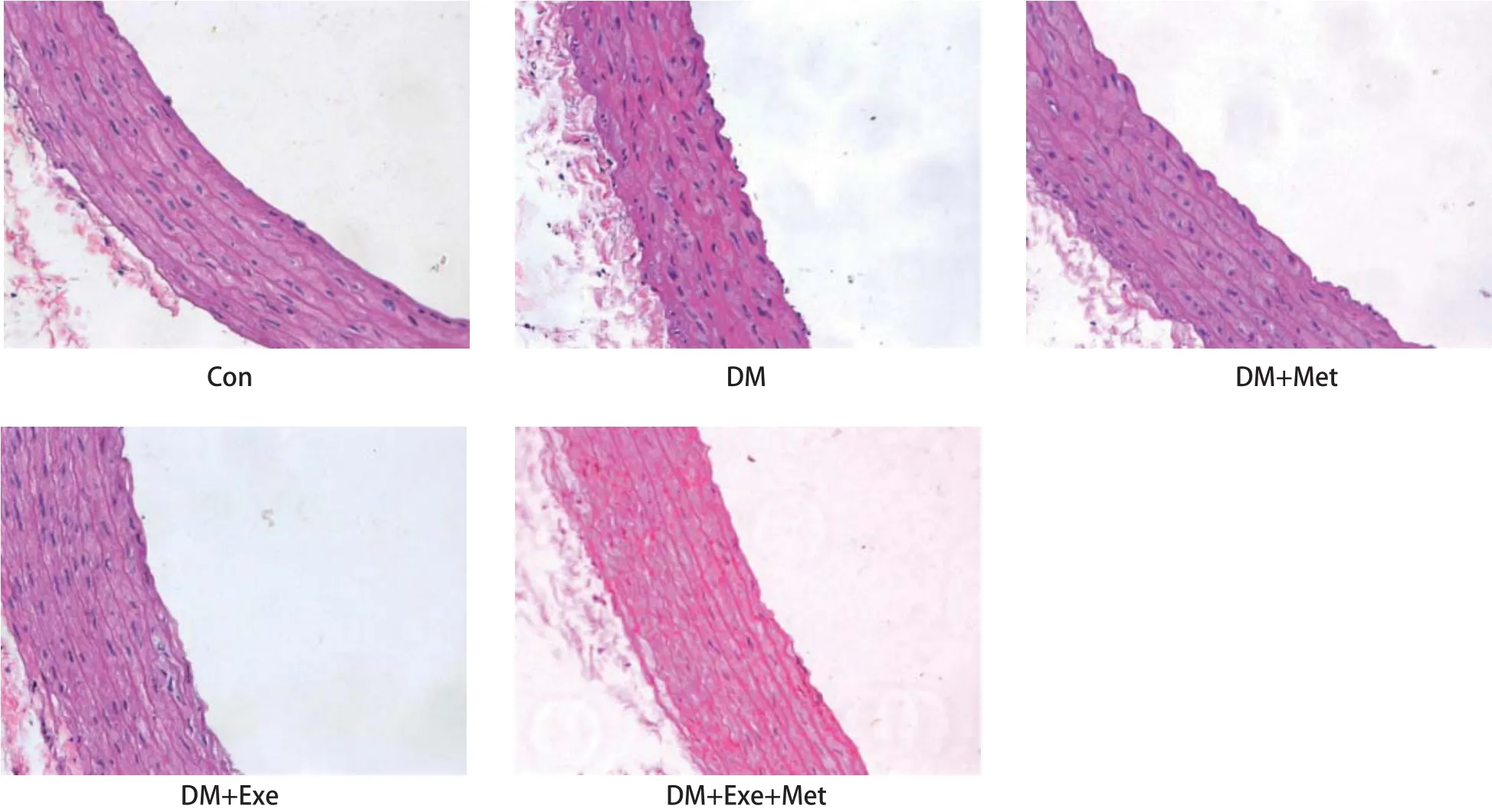
图2 有氧运动与药物干预对STZ诱导的糖尿病大鼠主动脉形态的影响 HE染色 (200X)Figure 2 Effects of Aerobic Exercise and Metformin on Aortic Morphology of STZ-treated Rats
2.4 血糖代谢指标与炎症因子之间关系
表3列举了血糖代谢指标与炎症因子相关性结果,从表中可以看出,FBG与MCP-1成正相关(r=0.449,P<0.05),FINS分别与IL-1β(r=0.417,P<0.05),MCP-1(r=0.532,P<0.01)成正相关,ISI分别与IL-1β(r=-0.401,P<0.05),TNF-α(r=-0.503,P<0.01)成负相关。
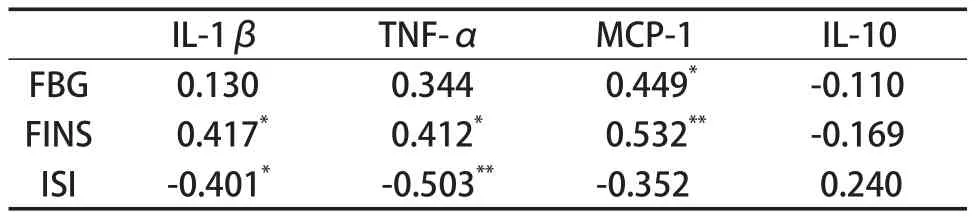
表3 血糖代谢指标与炎症因子相关性Table 3 The Correlation of Glucose Metabolism
2.5 有氧运动和二甲双胍对大鼠血清炎症标志物的影响
8周干预后对大鼠血清炎症指标进行检测,从图3中可以看出,DM 组血清IL-1β, TNF-α和MCP-1均明显高于正常组(P<0.01)。从干预结果来看,干预组糖尿病大鼠IL -1β,TNF-α和MCP-1都有下降的趋势,但变化程度并不相同。DM+Met组降低幅度 较小,DM+Exe组IL-1β,TNF-α和MCP-1水平显著低于DM组(P<0.05),DM+Exe+Met组血清TNF-α浓度明显低于DM组、DM+Met组和DM+Exe组(P<0.05),MCP-1浓度明显低于DM组(P<0.05)。IL-10具有抗炎症效应,根据数据显示结果来看,Con组和DM组血清IL-10浓度较低,DM+Met组和DM+Exe+Met组 血清IL-10浓度明显高于正常对照组(P<0.05),其中DM+Exe+Met组明显高于DM组(P<0.05)。
3 讨论与分析
3.1 糖尿病模型的构建
2型糖尿病是以高血糖为主要特征的代谢性疾病,其发病的主要原因是胰岛素分泌失调和外周组织对胰岛素敏感性下降[28]。高脂喂养并以小剂量STZ处理是构建2型糖尿病模型最常用的方法之一,由于该模型的发病机制与人类糖尿病较为类似,因此常被作为糖尿病病理性治疗的研究模型。大量研究表明,高脂喂养4周以上的肥胖大鼠已出现胰岛素抵抗现象,而小剂量STZ能够轻微破坏胰岛β细胞,使胰岛素分泌相对不足。本研究经4周高脂膳食喂养,并以30 mg/kg STZ处理后,大鼠血糖浓度明显上升,尿量升高, 并出现体重暂时降低现象(数据未列)。经检测,糖尿病大鼠空腹胰岛素水平明显高于正常对照组,且胰岛素敏感性显著降低,说明已经出现了明显的外周胰岛素抵抗现象,使得胰岛素分泌代偿性地增加,该模型符合2型糖尿病病理性特征。
3.2 影响糖尿病大鼠血管炎症的因素
高血糖、胰岛素抵抗、脂质代谢紊乱、内皮功能紊乱等因素均可能诱导血管炎症反应的发生。高血糖以及高糖诱导的氧化应激可以直接激活NF-κB炎症信号通路,引起多种炎症介质和细胞因子的过度释放,造成血管内皮细胞损伤,同时,受损的内皮细胞激活免疫系统促使炎症细胞向损伤部位聚集,并释放大量的炎症介质,促使血管发生炎症反应。我们的数据显示了空腹血糖和MCP-1呈显著正相关,说明随着血糖升高,MCP-1浓度不断增加,证实了高血糖与炎症之间的关系。除此之外,本研究还发现,空腹胰岛素与IL-1β,TNF-α和MCP-1呈显著正相关,胰岛素敏感指数与IL-1β,TNF-α呈显著负相关,说明胰岛素抵抗与炎症密切相关。之前研究认为,胰岛素不仅可以通过调节血糖间接发挥抗炎作用,还能够直接抑制炎症介质的生成,减轻机体的炎症损伤[1]。但当胰岛素抵抗时,由于胰岛素浓度的升高,直接或间接地诱导炎症因子表达的增加,因此也可以认为胰岛素抵抗是一个炎症过程,这与本研究结果相似。脂质代谢紊乱也是诱导身体炎症的重要原因,虽然我们数据显示出糖尿病对照组表现出明显的脂质代谢紊乱状态,但代谢指标与炎症因子之间没有显示出明显的相关性(数据未列),而且3种方式的干预也没有明显改善脂质代谢水平。除此之外,血管内皮损伤也会引起血管炎症的发生。一方面,血管内皮损伤将导致血管内皮功能紊乱,而内皮功能紊乱与慢性炎症密切相关[27];另一方面,血管腔内壁受损的内皮细胞激活免疫反应,诱导炎性细胞向损伤部位迁移,导致炎性细胞浸润[3]。本研究HE染色结果可以看出,糖尿病组血管结构发生了明显的病理性改变,尤其是糖尿病对照组内皮细胞受损较为严重,同时糖尿病对照组血管炎症标志物浓度最高,进一步证实了血管内皮损伤与血管炎症有关。
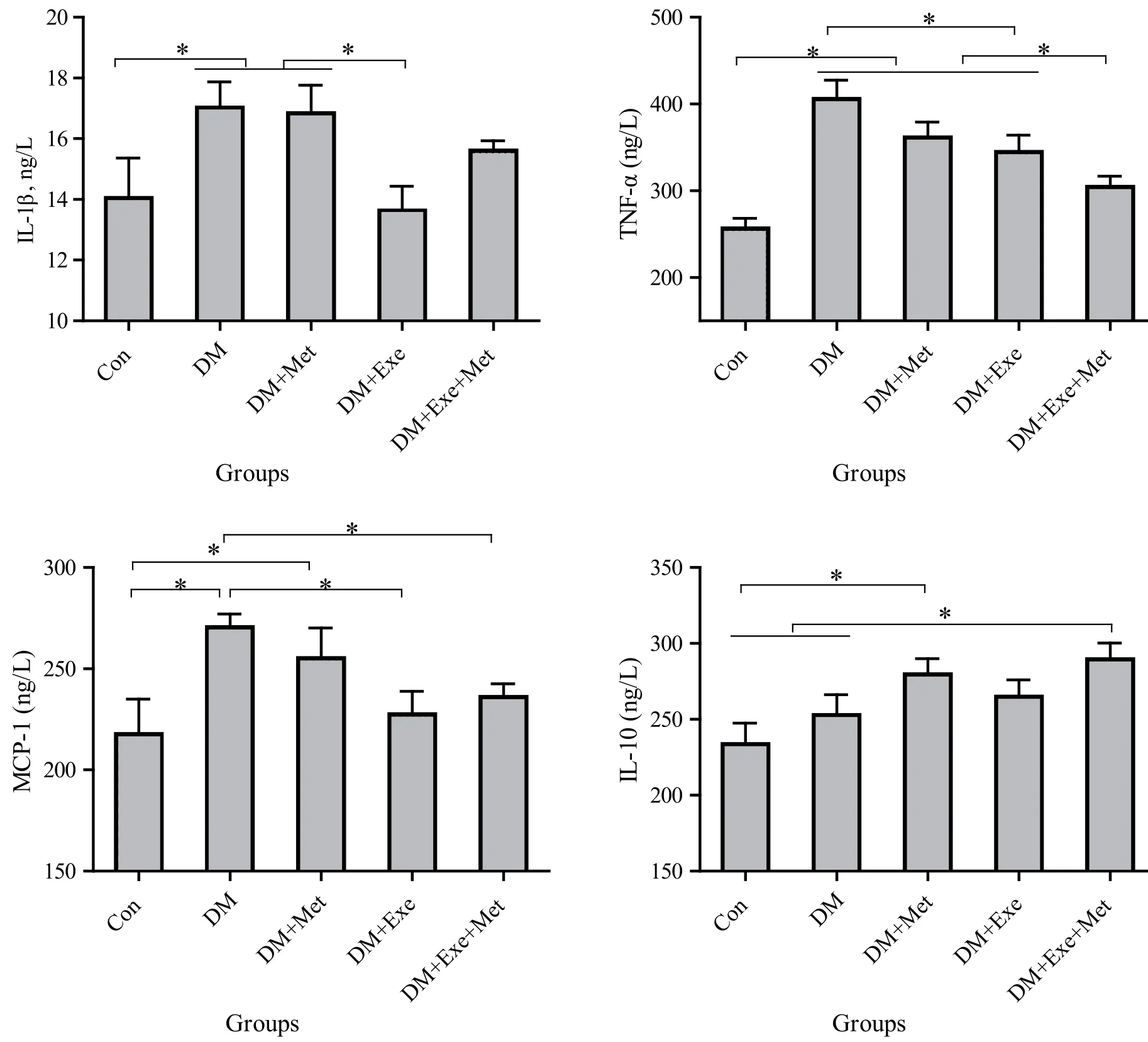
图3 大鼠血清炎 症因子IL-1β,TNF-α,MCP-1和IL-10(±S)Figure 3 Serum Inflammatory Factors in Rats:IL-1β,TNF-α,MCP-1 and IL-10(±S)
3.3 有氧运动和二甲双胍对糖尿病大鼠血清IL-1β、TNF-α、MCP-1的影响作用
尽管目前对2型糖尿病的研究取得了一些进展,但对糖尿病的发病机理还并不十分清楚。从糖耐量受损向糖尿病转变过程中,胰岛β细胞功能起着决定性作用。目前认为,2型糖尿病胰岛素抵抗和胰岛β细胞功能异常存在着以下几种机制:氧化应激,内质网应激,胰腺淀粉样物沉积,肌肉、肝脏、胰腺异位脂质沉积,脂毒性和糖毒性等[7]。虽然无法确定哪一种机制在糖尿病发病中最为重要,但这些细胞应激都能够诱导炎症反应[8]。炎症参与了2型糖尿病及并发症的发病过程,认为2型糖尿病属于自身炎症性疾病[7]。炎症因子主要是由胰腺、脂肪、肝脏等组织细胞分泌并释放到循环血液中,因此,循环血液中炎症因子浓度并不能反映特异性组织的炎症状态,但血管是储存和运输血液的主要器官,血管腔内的内皮细胞不断受到循环血液的刺激,可以认为循环血液中炎症因子浓度以及内皮损伤程度可以反映出血管炎症状态。本研究选取了促炎因子,趋化因子和抗炎症因子3种类型细胞因子以及血管内皮损伤程度来反映血管炎症状态。促炎因子IL-1β和TNF-α主要由单核巨噬细胞分泌,在血管炎症反应和促动脉粥样硬化中发挥重要作用,是炎症因子级联反应的启动因子,通过激活 内皮细胞炎症信号通路,促使下游炎症因子和细胞粘附分子的释放,形成炎症反应的正反馈循环,加剧血管的炎症反应。趋化因子MCP-l是由单核巨噬细胞、脂肪细胞、内皮细胞等多种细胞产生,主要功能是趋化单核细胞和T淋巴细胞,诱导单核细胞、内皮细胞表达粘附分子,诱导炎症细胞尤其是单核细胞向血管炎症部位迁移,促进动脉粥样硬化的形成[4]。抗炎因子IL-10是由免疫和非免疫细胞分泌的一种抗炎因子,主要生物功能是抑制炎症因子的产生,对单核细胞粘附内皮细胞具有抗炎作用[26]。
本研究发现,单纯二甲双胍干预虽然能够降低IL-1β,TNF-α和MCP-1水平,但影响幅度较小,近期的研究也显示了相同的结果[13],说明二甲双胍无法有效缓解糖尿病炎症反应。有氧运动与二甲双胍运动联合干预可以不同程度地降低血清IL-1β,TNF-α和MCP-1炎症因子水平,说明有氧运动以及运动和二甲双胍联合干预可以改善血管炎症反应,但对不同炎症因子的影响并不相同。之前的研究已经发现,长期规律性运动可以降低血清IL-1β,TNF-α和MCP-1,缓解机体炎症反应[15,23]。从我们研究的数据来看,单纯运动组血清IL-1β浓度明显降低,二甲双胍运动组浓度虽然有所下降,但在统计意义上没有差异,这可能是由于二甲双胍通过某种作用降低了运动产生的效应,但机制却不清楚。有氧运动与二甲双胍运动联合干预均可以显著降低血清TNF-α浓度,但二甲双胍运动组干预效果更为显著,降低幅度明显大于单纯运动组。脂肪组织是血液循环中TNF-α的主要来源,长期规律运动可以降低体重,二甲双胍同样也有控制体重作用,二者联合干预可以更加有效地减少脂肪积累,从而减少脂肪细胞分泌TNF-α。对促炎因子MCP-1的影响上,运动与二甲双胍和运动联合干预均能明显降低血清MCP-1水平。虽然认识到运动对缓解机体炎症有一定的作用,但其机制还并不清楚。有研究认为,运动可以直接抑制内皮细胞NF-κB炎症信号的激活,降低TLR4信号,减少粘附分子表达[9,16]。除此之外,运动还具有抗炎效应,运动过程中,骨骼肌细胞分泌大量IL-6,研究证明,IL-6具有抗炎作用,能够抑制TNF-α和IL-1β分泌,同时还能促进抗炎因子如IL-10和IL-1ra分泌[21]。本研究对IL-10进行了检测,发现有氧运动、二甲双胍及二甲双胍运动组血清IL-10浓度均比糖尿病对照组高,但仅有二甲双胍运动联合干预组具有显著性差异。说明二甲双胍和运动联合干预具有直接抗炎作用。Babbitt等对高血压人群进行6个月的有氧干预,结果发现,有氧运动可以增加IL-10浓度,但没有显著性差异,与本研究结果相似。除此之外,该研究还发现最大摄氧量变化可以预测IL-10变化,认为心肺耐力改善与血清IL-10增加有关[5]。Ribeiro等检测了有氧运动对心肌梗死血清炎症状态影响,认为有氧运动可以增加IL-10浓度,具有抗炎效应[24]。
3.4 有氧运动和二甲双胍影响糖尿病大鼠血管炎症反应的途径
本研究数据同样说明了高血糖、胰岛素抵抗和血管内皮损伤可能与血管炎症有关,那么,有氧运动和二甲双胍是否有可能通过降低血糖,改善胰岛素抵抗,缓解内皮损伤来间接影响血管炎症。数据显示,二甲双胍、有氧运动及二甲双胍运动联合治疗均可以改善血糖,但二甲双胍和二甲双胍运动组与有氧运动组相比在控制血糖方面具有更加明显的优势。二甲双胍主要是通过降低肝脏糖异生作用来维持血糖平衡[20],其作用机制还并不十分清楚。运动可以增加骨骼肌对血糖的吸收来降低血糖[11],骨骼肌收缩导致骨骼肌和循环血液中IL-6浓度显著增加,研究发现,肌源性IL-6能够增加骨骼肌葡萄糖转运蛋白4(GLUT4)转运,促进葡萄糖的吸收,改善血糖代谢[6]。数据还发现,二甲双胍和运动联合治疗在改善糖尿病大鼠胰岛素水平,增加胰岛素敏感性上的作用要优于单纯药物和运动的治疗效果,这说明二甲双胍和运动联合治疗在改善胰岛素敏感性上可能存在着叠加效应,这与之前的研究结果一致[17,25]。运动能够通过影响胰岛素信号转导通路逆转胰岛素抵抗的发生,改善胰岛素敏感性[2],二甲双胍可能是通过激活骨骼肌AMPK信号来增加外周胰岛素敏感性[19]。可以认为,有氧运动和二甲双胍可能部分是通过降低血糖、胰岛素间接影响糖尿病大鼠血清IL-1β,TNF-α和MCP-1浓度。
血管内皮细胞损伤既是血管炎症的原因也是结果,本研究数据显示,二甲双胍、有氧运动和二甲双胍运动联合治疗均能明显缓解血管内皮损伤,说明二甲双胍和运动对血管结构和功能起到一定的保护作用。这可能是因为降低血糖间接缓解了高糖诱导的血管内皮损伤,同时,有氧运动还可以提高内源性抗氧化能力,减少血管氧化应激,缓解ROS诱导的内皮损伤。由此可见,二甲双胍和有氧运动也有可能是通过减少血管内皮损伤来缓解血管炎症。
4 结论
有氧运动能够有效地缓解糖尿病大鼠血管炎症,二甲双胍抗炎效果并不明显,但二甲双胍与运动联合治疗能够显著降低糖尿病大鼠血管炎症反应。有氧运动和二甲双胍可能是通过改善胰岛素敏感性,降低血糖,减轻机体糖应激,减少血管内皮损伤来缓解糖尿病大鼠血管炎症反应。
参考文献
[1] 刘高华,李嘉,高峰.胰岛素的抗炎作用—不仅依赖于血糖控制[J].生理科学进展,2011,4 2(5):366-370.
[2] 米春娟,任维,高峰.运动改善心血管胰岛素敏感性及其信号转导机制[J].生理科学进展,2012,43(4):306-309.
[3] 王春梅.黄连素对2型糖尿病血管内皮功能障碍的保护作用及机制研究[D].吉林:吉林大学,2010:7-10.
[4] 夏婷婷. MCP-1等炎症因子在胰岛素抵抗促进动脉粥样硬化发展中关系的研究[D]. 沈阳:中国医科大学,2007:6-7.
[5] BABBITT D M,DIAZ K M,FEAIRHELLER D L,et al. Endothelial activation microparticles and inf l ammation status improve with exercise training in African Americans[J]. Int J Hypertens,2013:1-8.
[6] CAREY A L,STEINBERG G R,MACAULAY S L,et al. Interleukin-6 increases insulin-stimulated glucose disposal in humans and glucose uptake and fatty acid oxidation in vitro via AMP-activated protein kinase[J]. Diabetes,2006,55(10):2688-2697.
[7] DONATH M Y,SHOELSON S E. Type 2 diabetes as an inf l ammatory disease[J]. Nat Rev Immunol,2011,11(2):98-107.
[8] DONATH M Y,SCHUMANN D M,FAULENBACH M,et al. Islet inflammation in type 2 diabetes:from metabolic stress to therapy[J]. Diabetes Care,2008,31:161-164 .
[9] FRANCESCOMARINO S D,SCICIARTILLI A,VALERIO V D,et al. The effect of physical exercise on endothelial function[J]. Sports Med,2009,39 (10):797-812.
[10] GOLBIDI S,LAHER I. Exercise and the aging endothelium[J]. J Diabetes Res,2013,(22):1-12.
[11] HANSEN M,PALSøE M K,HELGE J W,et al. The effect of metformin on glucose homeostasis during moderate exercise[J]. Diabetes Care,2015,38(2):293-301.
[12] HERDER C,BRUNNER E J,WITTE D R,et al. Elevated levels of the anti-inflammatory interleukin-1 receptor antagonist precede the onset of type 2 diabetes:the whitehall II study[J]. Diabetes Care,2009,32(3):421-423 .
[13] JENKINS N T,PADILLA J,ARCE-ESQUIVEL A A,et al. Effects of endurance exercise training,metformin,and their combination on adipose tissue leptin and IL-10 secretion in OLETF rats[J]. J Appl Physiol,2012,113(12):1873-83.
[14] KOCH E,PIRCHER J,CZERMAK T. The endothelial tyrosine phosphatase SHP-1 plays an important role for vascular haemostasis in TNFα-induced inflammation in vivo[J]. Mediat Inf l amm,2013,(1):1-11.
[15] LEMOS E T D,PINTO R,OLIVEIRA J,et al. Differential effects of acute (extenuating) and chronic(training) exercise on inflammation and oxidative stress status in an animal model of type 2 diabetes mellitus[J]. Mediat Inf l amm,2011,(1):1-8.
[16] LEE J,CHO J Y,KIM W K. Anti-inf l ammation effect of Exercise and Korean red ginseng in aging model rats with diet-induced atherosclerosis[J]. Nutr Res Pract,2014,8(3):284-291.
[17] LINDEN M A,FLETCHER J A,MORRIS E M,et al. Combining metformin and aerobic exercise training in the treatment of type 2 diabetes and NAFLD in OLETF rats[J]. Am J Physiol Endocrinol Metab,2013,306(3):300-310.
[18] MATHUR N,PEDERSEN B K. Exercise as a mean to control low-grade systemic Inf l ammation[J]. Mediat Inf l amm,2008,(1):1-6.
[19] NATALI A,FERRANNINI E. Effects of metformin and thiazolidinediones on suppression of hepatic glucose production and stimulation of glucose uptake in type 2 diabetes:a systematic review[J]. Diabetologia,2006,49(3):434-441.
[20] PHIELIX E,SZENDROEDI J,RODEN M. The role of metformin and thiazolidinediones in the regulation of hepatic glucose metabolism and its clinical impact[J]. Trends Pharmacol Sci,2011,32(10):607-616.
[21] PEDERSEN B K,FEBBRAIO M A. Muscles,exercise and obesity:skeletal muscle as a secretory organ[J]. Nat Rev Endocrinol,2012,8(8):457-465.
[22] PETERSEN A M,PEDERSEN B K. The anti-inf l ammatory effect of exercise[J]. J Appl Physiol,2005,98(4):1154-1162.
[23] PLAISANCE E P,GRANDJEAN P W. Physical activity and high sensitivity C- reactive protein[J]. Sports Med,2006,36(5):443-458.
[24] RIBEIRO F,ALVES A J,TEIXEIRA M,et al. Exercise training increases interleukin-10 after an acute myocardial infarction:a randomised clinical trial[J]. Int J Sports Med,2012,33(3):192-198.
[25] SMITH A C,MULLEN K L,JUNKIN K A,et al. Metformin and exercise reduce muscle FAT/CD36 and lipid accumulation and blunt the progression of high-fat diet-induced hyperglycemia[J]. Am J Physiol Endocrinol Metab,2007,293:172-181.
[26] SIKKA G,MILLER K L,STEPPAN J,et al. Interleukin 10 knockout frail mice develop cardiac and vascular dysfunction with increased age[J]. Exp Gerontol,2013,48(2):128-135.
[27] VILA E,SALAICES M. Cytokines and vascular reactivity in resistance arteries[J]. Am J Physiol Heart Circ Physiol,2005,288(3):1016–1021.
[28] ZHANG M,LV X Y,LI J,et al. The characterization of high-fat diet and multiple low-dose streptozotocin induced type 2 diabetes rat model[J]. Exp Diabetes Res,2008,(6) :1-9.
Effects of Aerobic Exercise and Metformin on Serum IL-1β,TNF-α and MCP-1 in Diabetic Rats
LI Jun1,2,WANG Shao-bing2,XU Gui-qing2,JI Li-li2,LIU Yi-ping2
Objective:To evaluate the effects of aerobic exercise and metformin on vascular inf l ammatory reaction in diabetic rats. Methods:Diabetic rates,prepared through high-fat diet and intraperitoneal STZ injections,were treated with aerobic exercise,metformin and the combination of aerobic exercise and metformin respectively for 8 weeks. After receiving interventional treatment,diabetic rats were tested to obtain relevant indicators such as glycolipid metabolism,vascular endothelium and vascular inf l ammatory markers. Based on the experiment,the approach to inf l uencing vascular inf l ammatory reaction is explored. Results:Serum concentrations of IL-1β,TNF-α and MCP-1 in DM group were signif i cantly higher than those in Con group;serum concentrations of IL-1β,TNF-α and MCP-1 in DM+Met group had no obvious change compared with those in DM g roup;serum concentration s of IL-1β,TNF-α and MCP-1 in DM+Exe group were evidently lower than those in DM group;serum concentration of TNF-α in DM+Exe+Met group was greatly lower than it in DM,DM+Met and DM+ Exe groups,and MCP-1 was lower markedly than it in DM group. Serum concentration of IL -10 in three interventional grou ps was higher than it in Con group,but there was a signif i cant discrepancy only in the DM+Exe+Met group. Conclusion:Both aerobic exercise and the combination of aerobic exercise and metformin can effectively relieve the vascular inf l ammator y reaction in diabetic rats.
diabetes mellitus;aerobic exercise;metformin;inf l ammation
G804.7
A
1002-9826(2017)03-0041-08
10. 16470/j. csst. 201703007
2016-11-29;
2017-03-25
福建省自然科学基金资助项目(2016J01150);南京信息工程大学126工程资助项目(2016tyb003)。
李俊,男,副教授,在读博士研究生,主要研究方向为运动与健康,Email:njxx gcdx lj@aliyun.com。
刘一平,女,教授,博士,主要研究方向为运动与心血管保护,Email:ypliu1966@126.com。
1. 南京信息工程大学 体育文化研究基地,江苏 南京210044;2. 福建师范大学 体育科学学院 国家体育总局运动机能评定重点实验室,福建 福州 350117
1. Nanjing University of Information Science and Technology,Nanjing 210044,China;2.Fujian Normal University,Fuzhou 350117,China.

