温度对猪粪浆N2O转化的影响
陆 扬,王 通,,成艳芬,夏 东∗
(1上海市农业科学院畜牧兽医研究所,上海201106;2南京农业大学消化道微生物实验室,南京210095)
氧化亚氮(N2O)是农业温室气体的重要来源,其温室效应是二氧化碳(CO2)的310倍,甲烷(CH4)的15倍[1]。畜牧源N2O排放量占农业源N2O排放量的21.54%[2],主要来自畜禽粪便管理[3],其产生与消解涉及微生物的硝化和反硝化代谢反应[4]。硝化反应的第一限速酶氨单加氧酶(Ammonia monooxygenaes,AMO)的编码基因amoA常被用于氨氧化菌(Ammonia oxidizing bacteria,AOB)的分子标记;分别编码不同类群反硝化菌的亚硝酸还原酶(Nitrite reductase,NIR)的nirK和nirS,以及编码反硝化菌的氧化亚氮还原酶(Nitrous oxide reductase,NOS)的nosZ则常被用于反硝化菌的分子标记。
温度是影响N2O转化的重要因素之一,但对此报道不一。有研究认为,温度升高会增加N2O排放[5-6]。但也有研究报道,N2O的排放与气温和粪污温度均没有关系[7]。其不一致的原因一方面可能是N2O浓度远低于其他两种温室气体,检测相对误差高,且在现场测定时易受风等自然因素的干扰;另一方面N2O是反硝化反应的中间代谢产物,参与N2O转化的各阶段反应相对速度的改变可能会直接影响N2O的排放。本试验通过研究不同温度条件下N2O的产生与消解规律及代谢底物和可能参与代谢的功能基因丰度变化,旨在探究温度影响N2O产生与消解机制。
1 材料与方法
1.1 试验材料、方法与分组
新鲜猪粪用去离子水以1∕2稀释混匀制成粪浆,分装于45个150 mL容积血清瓶。用橡胶塞和螺口盖密封后,抽真空2 min,通高纯空气(78.09%N2,20.94%O2,0.93%Ar和0.033%CO2),重复抽、充气3次后平衡气压。试验按照培养温度不同分为3组,每组15瓶,分别放入15℃、25℃和35℃的培养箱中培养。每组设5个采样时间点(1 d、3 d、5 d、10 d和15 d),每个时间点取3个血清瓶进行采样,作为3个重复。取样方法如下,首先用经三通阀连接的气密性注射器与压力传感器测定血清瓶中的气体压力和产气量,然后将气密式注射器取出的气体保存在提前用高纯氮气反复抽洗3次以上的气袋中保存,待测N2O浓度。取部分粪样-20℃保存,用于测定三氮(氨态氮、亚硝态氮和硝态氮)浓度。
1.2 N2O浓度测定
气相色谱法[俊齐仪器设备(上海)有限公司,GC-9890A]检测N2O浓度[8]。检测条件为Porapak Q填充柱(内径4 m×3 mm),电子捕获检测器(ECD),进样室100℃,柱温50℃,检测室320℃,载气为99.999%氮气,柱压0.17 MPa,进样量5 mL。标准气体购自上海伟创标准气体有限公司。
1.3 三氮的提取与测定
用1 mol∕L KCl溶液浸提,固液比为1∶10,浸提粪浆中的铵态氮、亚硝态氮和硝态氮,加1%硫酸锌溶液,0.5%氢氧化钠溶液和10%氢氧化铝悬浮液,混匀后,12 000 r∕min离心5 min,上清液用于3种不同形态氮的测定。纳氏试剂法用于测定铵态氮;格利斯试剂用于亚硝态氮测定;双波长分光光度法用于硝态氮测定。
1.4 DNA提取与qPCR
取0.3 g粪浆,经PBS(120 mmol∕L,pH 8.0)洗3次后,加800 μL CTAB溶液(十六烷基三甲基溴化铵),用珠磨法机械破碎样品(上海净信科技有限公司),而后用酚和氯仿∕异戊醇提取其总DNA[9]。粪浆中氨氧化菌代谢酶(amoA)、反硝化菌代谢酶(nirK、nirS和nosZ)及总菌(tot)用qPCR方法定量(引物及反应条件见表 1)。 反应体系 20 μL:10 μL SYBR Green PCR Master Mix(Qiagen),1 μmol∕L 上、下游引物和80 ng DNA模板。所有qPCR反应在ABI 7500 Real-time PCR仪上进行。相应目的片段PCR产物经克隆测序验证后,其质粒经梯度稀释后用作标准曲线模板,无菌水做阴性对照模板。
1.5 数据分析
产气量用气压进行校正。所有试验数据经Excel进行初步计算后,用SPSS 13.0软件中的单多因子方差分析法(One Way Anova)和一般线性模型(GLM Multivariate)进行方差统计,用最小显著差异法(LSD)进行多重比较,P<0.05为差异显著,P<0.01为差异极显著。所得数据均以“平均值±标准差(Mean±SD)”表示。用Pearson法进行相关性分析,P<0.05相关性显著,P<0.01为相关性极显著。

表1 定量PCR各引物序列及温度Table 1 Primer sequences and thermal cycling conditions used for qPCR
2 结果与分析
2.1 温度对粪浆的产气量及N2O转化的影响
如图1所示,35℃、25℃和15℃三个温度处理组,分别在第1天、第3天和第10天开始检测到有气体产生,其后产气量随时间呈线性增加;同一时间点,以35℃组的产气量最高,25℃次之,15℃最低,差异极显著(P<0.01)。

图1 储存粪浆的产气量以及N2O浓度、含量和速率的变化Fig.1 Variation of emission of N2O from pig maure slurry with time
试验开始时,粪浆上方为高纯空气,其中N2O浓度均在检测下限,N2O含量可忽略不计。试验开始后,3个组的N2O的浓度和含量都经历了先升高后降低的过程(图1)。3组的N2O累积量都在第3天达到峰值,按照温度由低到高,N2O累积量依次为1.70 mg∕kg、2.57 mg∕kg和4.65 mg∕kg,3组之间差异极显著(P<0.01);从10 d开始,15℃处理组的N2O浓度就维持在0.6 mg∕L左右,该值接近大气中N2O的背景值,而25℃和35℃处理组N2O浓度则低于大气N2O浓度,并能继续下降。
在试验前3 d速率为正值(图1),说明N2O的产生速度快于还原速度,N2O的累积主要发生在第1天,以35℃组最快,25℃次之,15℃最慢,3组之间差异极显著(P<0.01);在试验后期速率为负值,说明N2O的还原速度快于产生速度,N2O的消解主要发生在5—10 d,仍以35℃组最快,25℃次之,15℃最慢,3组之间差异极显著(P<0.01)。
2.2 粪浆的三氮变化
粪浆中的铵态氮和硝态氮浓度在试验期内持续增加,35℃处理组的铵态氮浓度极显著高于其他两组(P<0.01),15℃处理组的硝态氮浓度在5 d以后显著低于其他两组(P<0.05,图2)。粪浆中亚硝态氮浓度仅为1.5—4.5 mg∕kg,各组亚硝态氮在5 d达到峰值,随后逐渐降低,不同温度处理组亚硝态氮没有显著差异(P>0.05,图2)。
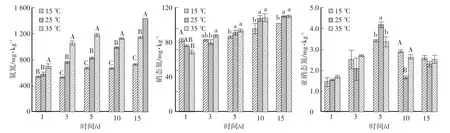
图2 粪浆的三氮变化情况Fig.2 Variation of concentrations of NH4+-N,N2O and NO3--N of pig manure slurry with time
2.3 粪浆中总菌及硝化、反硝化反应功能基因的变化
粪浆中总菌及硝化、反硝化反应功能基因的变化见表2。试验前3 d的总菌、amoA、nirK和nirS丰度均显著高于5 d及以后的相应基因丰度(P<0.01),仅nosZ丰度差异不显著(P>0.05)。35℃组的总菌和nirK丰度显著低于15℃和25℃组(P<0.05),后两组之间差异不显著(P>0.05)。温度对nosZ丰度的影响有显著的时间效应(P<0.05),表现为3 d时,25℃组nosZ丰度显著低于其他两组(P<0.05),15℃和35℃组之间差异不显著(P>0.05);15 d时15℃组nosZ丰度显著高于其他两组(P<0.01),25℃和35℃组之间差异不显著(P>0.05),其他时间3组之间无显著差异(P>0.05)。温度对amoA和nirS丰度的影响则不显著(P>0.05)。相关性分析结果表明,N2O的排放速率与总菌、amoA、nirK、nirS和nosZ丰度都显著相关,相关系数分别为0.64、0.62、0.66、0.58和0.49(P<0.01,表2)。由于nosZ是唯一的N2O还原酶,用其他各基因丰度与nosZ丰度的差值进行相关性分析,结果表明仅nirK∕nosZ与N2O的排放速率显著相关,相关系数为0.57(P<0.01,未列出)。
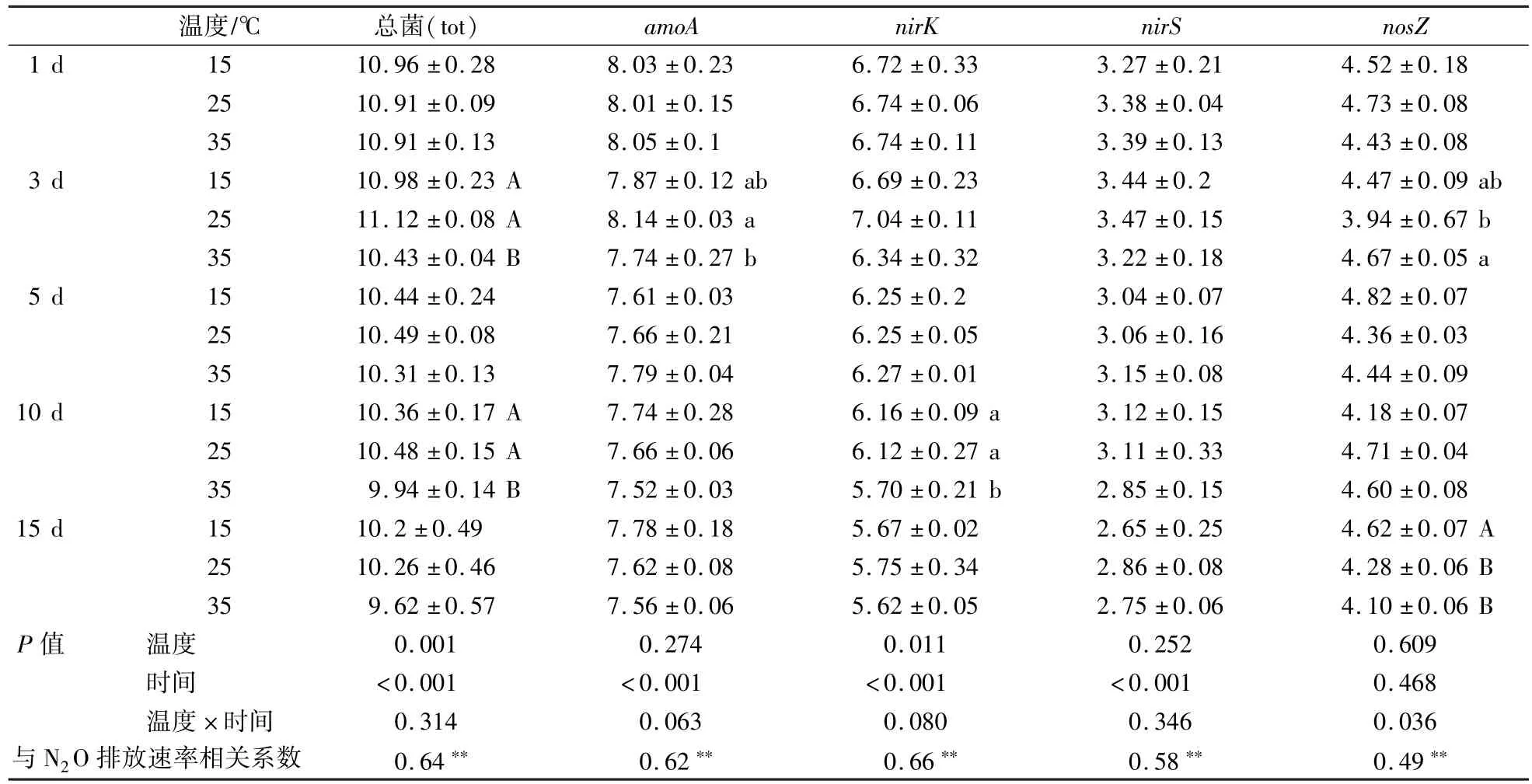
表2 每克粪浆中总菌及硝化、反硝化反应功能基因拷贝数的变化Table 2 Variations of total bacteria and amoA,nirK,nirS and nosZ gene copy numbers per gram manure slurry
3 讨论
畜牧源N2O排放主要来自粪污后期管理,包括粪污的储存与处理。Wang等[5]报道,沼液的存储温度从5℃上升到25℃,其总氮排放从8.9%上升到41.9%,25℃是N2O排放显著增加的临界温度。陆日东等[6]报道,5—35℃范围内,温度越高牛粪N2O排放越多。本试验开始时,粪浆上方是高纯空气,因此,前期结果与上述在开放条件下测定的结果基本一致。由于是密闭的试验体系,随着氧的耗竭,血清瓶内形成严格厌氧环境,试验前期累积的N2O被进一步还原成N2,N2O浓度和含量开始下降。温度升高不但会加速N2O累积,还会加速N2O还原,3个处理组的N2O浓度和含量都同时在第3天达到峰值,并在10 d后,N2O浓度都下降到甚至低于大气的本底值。以上结果说明,过短的厌氧处理时间会增加N2O的排放,当厌氧处理时间超过10 d时,N2O排放可忽略不计。提示,为了减少N2O排放,养殖场粪污厌氧处理时间不可少于10 d。
N2O产生与消解涉及微生物的硝化和反硝化代谢反应[4]。定量PCR结果表明,在N2O减少的阶段(5—15 d)粪浆中的总菌、amoA、nirK和nirS丰度均显著低于N2O增加的阶段(1—3 d),但两个阶段的nosZ丰度差异不显著,而后者是将N2O还原的关键代谢酶,因此,在试验后期N2O的含量下降可能是由于N2O的生成速度降低,还原速度超过了生成速度造成的。Levy-Booth等[12]报道,土壤中的amoA、nirK、nirS和nosZ丰度与N2O排放显著相关;Cui等[13]报道土壤中nirK和nirS与N2O排放都显著相关,但nirS相关性更强。本研究中amoA、nirK、nirS和nosZ丰度都与N2O排放显著相关,相关系数分别为0.62、0.66、0.58和0.49(P<0.01),说明硝化和反硝化反应的各阶段都可影响粪浆N2O的排放。
Poh等[14]认为,反硝化反应各环节的还原速度受温度影响不一致,是温度升高引起N2O排放增加的原因之一,如从25℃升高到35℃时,反硝化反应过程中的硝态氮、亚硝态氮和N2O还原速率分别上升了62%、61%和41%。本试验并未发现各代谢酶基因随温度的升高而丰度增加,相反,35℃组的总菌和nirK丰度显著低于15℃和25℃组(P<0.05);35℃组的nosZ丰度也在3 d和15 d时显著低于15℃组(P<0.05),温度对amoA和nirS丰度的影响则不显著(P>0.05)。出现以上结果的可能原因是在任何一个封闭的环境都存在群体效应,受营养物质或代谢产物的限制,会出现衰退期,温度的升高可能会加快菌的新陈代谢,在提高代谢效率的同时加速了菌的死亡。事实上,N2O的排放同时受其生成和还原的共同影响,不是由单一的菌或单一的酶决定的,本试验将与N2O生成可能有关的代谢酶丰度与其唯一还原酶nosZ的丰度相减后进行相关性分析,结果表明仅nirK∕nosZ与N2O的排放速率显著相关(0.57,P<0.01),说明N2O排放可能与反硝化菌中nirK与nosZ的相对数量关系更密切。
除温度外,底物浓度也会影响N2O的排放。Huang等[15]报道,高氨氮会引起亚硝态氮的积累,增加N2O排放。Kim等[16]报道,硝酸盐浓度为1 500 mg∕L时,污水中25%—40%的硝酸盐转化为N2O,当硝酸盐浓度降为750 mg∕L时,反硝化终产物中则检测不到N2O。以往研究认为,亚硝酸氮是引起N2O累积的重要原因,但近来研究表明,质子化的亚硝酸氮,即游离亚硝酸(Free nitrous acid,FNA)才是污水处理过程中抑制细菌生长和增加N2O产生的真正原因[17]。当FNA浓度达到0.42—1.72 mg N∕L时,AOB的活性降低50%;当 FNA浓度达到 0.011—0.070 mg N∕L时,硝化反应开始受到抑制,当达到 0.026—0.220 mg N∕L时,硝化反应完全受到抑制;当FNA浓度达到0.010—0.025 mg N∕L时,反硝化反应下降40%,当达到0.2 mg N∕L时,反硝化反应完全停止。本试验中,随着有机氮被分解成无机氮,粪浆内铵态氮和硝态氮都持续升高,在第15天时35℃的分别达到1 500 mg N∕L和100 mg N∕L,虽然亚硝酸氮在前5 d升高,随后降低,似乎与N2O的累积的变化规律相似。FNA受硝酸氮浓度、温度和pH的共同影响,通过公式[18]计算,本试验的FNA浓度在0.08—0.69 μg N∕L,远低于以上报道阈值,说明厌氧处理粪浆时,不会因亚硝酸的累积而导致N2O的大量生成。
4 结论
温度升高会加快粪浆N2O生成和还原,提高其排放峰值,但不影响其转化的时间节律。硝化和反硝化菌可能都参与了N2O的转化,但反硝化代谢酶nirK与nosZ可能在N2O排放中起关键作用。
[1]IPCC.Guidelines for national greenhouse gas inventories,Volume 4:Agriculture,forestry and other land use[M].Kanagawa,Japan:The IPCC National Greenhouse Gas Inventories Program,2006.
[2]谭秋成.中国农业温室气体排放:现状及挑战[J].中国人口·资源与环境,2011,21(10):69-75.
[3]国家发展和改革委员会应对气候变化司.中华人民共和国气候变化第二次国家信息通报[M].北京:中国经济出版社,2013.
[4]刘秀红,杨庆,吴昌永,等.不同污水生物脱氮工艺中N2O释放量及影响因素[J].环境科学学报,2006,26(12):1940-1947.
[5]WANG Y,DONG H,ZHU Z,et al.CH4,NH3,N2O and NO emissions from stored biogas digester effluent of pig manure at different temperatures[J].Agriculture,Ecosystems&Environment,2016,217:1-12.
[6]陆日东,李玉娥,万运帆,等.温度对奶牛粪便温室气体排放的影响[J].生态与农村环境学报,2008,24(1):29-31.
[7]SOMMER S G,PETERSEN S O,SOGAARD H T.Greenhouse gas emission form stored livestock slurry[J].J Environ Qual,2000,29:744-751.
[8]王跃思,郑循华,王明星,等.气相色谱法检测大气中N2O浓度[J].分析测试技术与仪器,1994(2):19-24.
[9]ZOETENDAL E G,AKKERMANS A D,DE VOS W M.Temperature gradient gel electrophoresis analysis of 16S rRNA from human fecal samples reveals stable and host-specific communities of active bacteria[J].Appl Environ Microbiol,1998,64(10):3854-3859.
[10]CASTILLO M,MARTIN-ORUE S M,ROCA M,et al.The response of gastrointestinal microbiota to avilamycin,butyrate,and plant extracts in early-weaned pigs[J].J Anim Sci,2006,84(10):2725-2734.
[11]HALLIN S,JONES C M,SCHLOTER M,et al.Relationship between N-cycling communities and ecosystem functioning in a 50-year-old fertilization experiment[J].Isme Journal,2009,3(5):597-605.
[12]LEVY-BOOTH D J,PRESCOTT C E,GRAYSTON S J.Microbial functional genes involved in nitrogen fixation,nitrification and denitrification in forest ecosystems[J].Soil Biology and Biochemistry,2014,75:11-25.
[13]CUI P,FAN F,YIN C,et al.Long-term organic and inorganic fertilization alters temperature sensitivity of potential N2O emissions and associated microbes[J].Soil Biology and Biochemistry,2016,93:131-141.
[14]POH L S,JIANG X,ZHANG Z,et al.N2O accumulation from denitrification under different temperatures[J].Appl Microbiol Biotechnol,2015,99(21):9215-9226.
[15]HUANG T,GAO B,HU X K,et al.Ammonia-oxidation as an engine to generate nitrous oxide in an intensively managed calcareous fluvo-aquic soil[J].Sci Rep,2014,4:3950.
[16]KIM E W,BAE J H.Alkalinity requirements and the possibility of simultaneous hetemtmphic denitritifiation during sulfur utilizing autotrophic denitrification[J].Water Science and Technology,2000,42(34):233-238.
[17]ZHOU Y,OEHMEN A,LIM M,et al.The role of nitrite and free nitrous acid(FNA)in wastewater treatment plants[J].Water Res,2011,45(15):4672-4682.
[18]ANTHONISEN A C,LOEHR R C,PRAKASAM T B,et al.Inhibition of nitrification by ammonia and nitrous acid[J].J Water Pollut Control Fed,1976,48(5):835-852.

