针刺对一次离心运动后大鼠炎症反麻的影响
白胜超 赵晓琴 孙君志 周越


摘要:探究针刺干预对一次离心运动后大鼠炎症反应的影响。方法:114只雄性(SD)大鼠,随机分为4组:安静对照组(C)、单纯针刺组(A)、单纯运动组(E)、运动针刺组(EA),E组和EA组均在坡度-16°的跑台上进行一次离心运动,A组和EA组进行比目鱼肌部位斜刺,之后按0h、2 h、24 h、48 h、72 h、120 h等时相进行取材。HE染色观察比目鱼肌细胞形态结构;Western Blot法分别检测比目鱼肌、股直肌中肿瘤坏死因子-α(TNF-α)的蛋白表达;Elisa法检测血浆中TNF-α的含量。结果:1)HE染色发现c组和A组均无显著变化,E组出现不同程度的炎性细胞浸润,运动后进行针刺使炎性细胞浸润的峰值提前。2)比目鱼肌中TNF-α,A组与c组相比均无显著性差异(P>0.05);E组与C组、EA组具有显著性差异(P<0.05),在E组72 h达到峰值,在EA组48 h时相达到峰值。3)股直肌和血浆中TNF-~结果基本一致,A组与C组相比均无显著性差异(P>0.05);E组与C组具有显著性差异(P<0.05),E组与EA组无显著性差异(P>0.05)。结论:单纯进行针刺干预不会引起骨骼肌和血浆中明显的炎症反应,离心运动可以导致骨骼肌出现一定程度的炎症反应,离心运动后进行针刺干预使针刺部位骨骼肌炎症反应的程度增加,并在峰值之后促使其消退;针刺产生的作用是局部效果,对非针刺部位骨骼肌和血浆的炎症反应不会产生显著影响。
关键词:离心运动;骨骼肌;血浆;炎症;针刺
中图分类号:G 804.2 文章编号:1009-783X(2017)01-0085-06 文献标志码:A
针刺在中国传统医学中具有重要地位,许多研究领域中已有较为广泛应用,不同学科也对其机理进行了大量探讨。研究证实,运动能引起骨骼肌细胞内钙离子(Ca2+)产生变化,进而诱发后续的一系列生理反应,而运动后对骨骼肌进行针刺干预可以使胞浆内Ca2+更快地恢复至正常水平,因此,针刺在运动领域也有较多应用。本实验室前期研究发现针刺具有促进骨骼肌机能恢复及治疗肌肉损伤等作用,之后从骨骼肌与运动方面进行了一系列的机理探索,其中有些研究发现针刺能够促进离心运动后大鼠骨骼肌肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的表达。TNF-α具有较多的生物学功能,可以促进内皮细胞表达粘附分子,有促使白细胞游出,具有强烈的趋化和激活嗜中性粒细胞的作用,可以作为炎症反应的重要指标,这提示我们针刺干预对离心运动后大鼠炎症反应有一定影响。
20世纪70年代Tullson提出机体运动后会产生与急性免疫有关的反应,之后较多研究者认为大鼠进行一次性长时间离心运动,产生的炎症反应在早期阶段局部组织的主要浸润细胞为嗜中性粒细胞,后期炎症反应的主要细胞为巨噬细胞和淋巴细胞。运动导致的这些炎症反应和骨骼肌延迟性肌肉酸痛、骨骼肌微细损伤修复、骨骼肌凋亡自噬等均有重要关系,因此,探究针刺干预对运动后机体炎症反应的影响具有重要意义。
目前针刺对运动后骨骼肌的作用机制已有较多研究,但对于炎症反应的影响方面还尚未有很清楚的认识。本实验通过对离心运动后大鼠进行针刺干预,观察大鼠比目鱼肌细胞形态结构,分析比目鱼肌、股直肌、血浆中TNF-α的变化,结合本实验室以往的研究结果,探究针刺干预对一次离心运动后机体炎症反应的作用效果和部位,以期能够从炎症角度对针刺在运动方面的作用机理进行一定理论补充。
1材料与方法
1.1动物与分组
本实验选用8周龄雄性(SD)大鼠共114只,SPF级别,体重为(199±6.8)g,购于北京华阜康生物科技股份有限公司,许可证编号:SCXK(京)2009-0007。大鼠在中国医学科学院药用植物研究所动物房内进行饲养和相应训练。分笼饲养,每笼6只,按照国家标准啮齿类动物饲料进行喂养,自由进食、饮水,室内温度为(22±2)℃,相对湿度30%~60%,光照12 h+黑暗12 h模拟昼夜交替。大鼠适应性饲养3 d以后,进行相应后续实验。
实验大鼠进行随机分组,分为安静对照组(Control,C)、单纯针刺组(Acupuncture,A)、单纯运动组(Exercise,E)、运动针刺组(Exercise+Acupuncture,EA)4个组。其中,后3组按取材时间又分为O h、2 h、24 h、48 h、72 h、120 h等时相组,每组各6只。
1.2处理方法与取材
运动方案:本实验运动方案参照Armstrong的经典离心运动模型,所有参与运动的大鼠在正式实验之前进行为期3 d适应性跑台训练:第1天跑台坡度0°,跑速16 m/min,时间5min第2天跑台坡度0°,跑速16 m/min,时间10 min第3天进行休息。第4天开始正式实验,坡度-16°,跑速16 m/min,每次训练时间90 min。E组和EA组进行运动,C组和A组不予运动。
针刺方案:在一次大负荷运动后即刻对EA组大鼠进行针刺干预,同期对A组予以相同的针刺处理。用固定器将大鼠固定好,用酒精棉球对双后肢进行消毒,用直径0.25 mm的针灸针沿小腿三头肌的纵向,从离跟腱约5 mm处的远端中心部位进行斜刺,进针角度约30°,进针长度约18 mm,穿过小腿三头肌的肌腹,针刺大鼠比目鱼肌位置,留针2 min。
大鼠腹主动脉采血至抗凝管中,静置10~20 min后,3 000r/min,离心20 min,取上清液,用于ELISA备测。将分离出来的比目鱼肌和股直肌分别装入冻存管中,立即投入液氮速冻,之后移至-80℃冰箱保存,用于Western Blot待測。EA组在离心运动后即刻进行针刺干预,同期对A组进行针刺处理。
1.3主要仪器与试剂endprint
-20℃恒冷切片机(LEICAUC6i莱卡),德国;奥林巴斯(OlympusIX71)倒置显微镜图像采集系统;电泳仪(LKB 2301Macrodrive Power Supply LKBBROMMA),瑞典;垂直电泳槽(Cavoy MiniP-4),北京凯元仪器厂;电转膜槽,BIO-RAD公司,美国;凝胶成像(Chemi Doc TMXRS),BIO-RAD,美国;酶标仪(xMarkTMMicroplate Spectrophotometer),BIO-RAD公司;汉医牌针灸针,直径25mm,津食药监械(准)字2009第2270002号。
BCA蛋白定量试剂盒,货号-23225,Pierce公司;发光液,货号-34080MN Super Signal West Pico化学发光底物ThermoSCIENTIFIC;膜再生液,货号-P1650,普利莱基因技术有限公司;PVDF转膜,Millipore公司;预染蛋白Marker,货号-P7708,NEW ENGLAND BioLabs TNF-α抗体,货号-ab65157,abcam公司;兔抗GAPDH多克隆IgG抗体,杭州至贤生物科技有限公司;HRP标记山羊抗兔IgG,货号-ZB-2301,北京中杉金桥生物技术有限公司;大鼠TNF-α酶联免疫分析(ELISA)试剂盒,北京鑫方程生物技术有限公司。
1.4测试指标与方法
1.4.1比目鱼肌HE染色
恒冷切片机上调节温度为-20℃,将样品沿横向截面切成厚度为8μm的薄片,贴在多聚赖氨酸处理过的载玻片上,将样片放置4%的多聚甲醛中固定30 min,之后放置双蒸水中1min,甩掉水分,用苏木素染色5 min,再用自来水冲洗去切片上的残留染色液直至切片变成蓝色,用配置的含1%盐酸的70%乙醇溶液,浸泡分色3 s左右,之后自来水冲洗5 min,再用蒸馏水浸洗大约1 min,放入伊红水溶液,浸染2 min。将组织切片用蒸馏水洗去附在载玻片上的残余染液,30%、70%、95%、无水乙醇、无水乙醇脱色,每次2 min,透明切片入二甲苯2次进行透明,每次2 min,树胶封片。具体操作步骤严格按照试剂盒说明书进行。每一比目鱼肌切片的中心视野处进行图像采集。
1.4.2 Western Blot方法检测比目鱼肌、股直肌中TNF-α蛋白表达
使用电子天平称取大鼠比目鱼肌和股直肌组织的质量,按照1 mg肌组织加入10μL配置的裂解液比例进行混合,在冰上剪碎,匀浆,低温高速离心机1万4 000 r/min、温度4℃、离心10 min。取离心后的上清液,4℃暂时储存。BCA蛋白定量试剂盒进行蛋白浓度测定,方法按照试剂盒说明书进行,调整所有样品的蛋白浓度,使上样量保持一致,按比例4:1加入5×样品缓冲液,煮沸5 min,备用。配置SDS-PAGE凝胶进行电泳,电压90 V,时间30 min,跑入分离胶以后,电压140 V,电泳60~90 min,根据跑胶具体情况适当调整时间。转膜为恒流300 mA,时间90 min。之后将膜放置于5%BSA封闭液中,室温轻摇封闭3 h。封闭液稀释一抗(TNF-α1:2000,GAPDH1:1 000)将膜放置于一抗溶液中,室温6 h摇床孵育或4℃冰箱过夜。室温TBST进行洗膜6次×5 min。二抗孵育用封闭液按比例1:5 000稀释HRP标记山羊抗兔IgG,室温孵育2 h。室温TBST摇床洗膜6次,5 min。取相同体积量的超敏发光液A液和B液进行混合,并滴加到膜上,使充分与发光液接触。去除气泡,吸去多余的发光工作液,将膜置于凝胶成像系统内,显像。利用Gel-pro软件进行相应的条带灰度值分析。
1.4.3 ELISA方法检测血浆中TNF-α水平
取血漿恢复室温进行测定。主要测试步骤为:稀释标准品、加样并设空白孔和待测样品孔,37℃温育30 min,甩干液体,洗涤液重复洗涤5次,待测样品孔加入酶标试剂液,37℃再温育30 min,洗涤,显色,加入终止液,酶标仪测OD值并进行浓度计算。具体操作步骤严格按照试剂盒说明书进行。
1.5统计学处理
所得数据均使用SPSS 19.0统计软件进行相应的统计分析,实验结果以均数±标准差(X±S)的形式进行表示,实验数据采用多因素方差分析和单因素方差分析,多因素方差分析采用固定效应模型,对固定因素分组方式(安静对照、离心运动、单纯针刺、运动针刺)和取材时间(0、2、24、48、72、120 h)进行主效应及两者的交互作用分析。如果主效应显著(P<0.05)则采用LSD方法进行事后多重比较分析(LSD Post Hoc Tests),对某一因素中单一水平内各观测值之间的相互比较采用单因素方差分析,方差齐性时用LSD方法,方差不齐性时用Tamhanes方法,显著性水平取P<0.05,非常显著性水平取P<0.01。
2结果
2.1 HE染色结果
从图1的染色结果可见,安静组比目鱼肌组织横切片的细胞大多呈多角形,骨骼肌细胞核呈圆形或椭圆形分布于肌膜边缘,未见到肿胀固缩等情况,肌膜清晰完整,肌细胞之间未见到明显的血管改变和炎性反应。
从图2的HE染色结果可见,0、2、24、48、72、120 h肌纤维结构趋于正常,骨骼肌纤维的形态结构和安静组基本相问,细胞间未见到明显的浸润。
从图3的HE染色结果可见,离心运动后0 h、2 h大鼠比目鱼肌局部偶见炎症细胞浸润,24 h大鼠比目鱼肌肌纤维局部有少量的炎性细胞浸润到骨骼肌细胞间,48 h、72 h浸润明显增多,120 h浸润的炎症细胞相比72 h时相可见到有所减少。
从图4的HE染色结果可见,运动针刺组0 h和2 h,并未发现明显的浸润,偶见炎症细胞的浸润,和单纯运动组的相似,在24 h组发现浸润的炎症细胞较多,受此实验条件限制,不能确定此模型下浸润细胞的类型,48 h能够看到浸润程度明显要比单纯运动组48 h严重,72 h开始出现下降的趋势,120 h浸润程度相比同时相的单纯运动组明显减轻,并且细胞结构趋于完整。endprint
2.2大鼠比目鱼肌中TNF-α的变化
对分组方式因素进行主体效应检验,结果显示具有极显著差异(P<0.01),进一步进行事后多重检验,结果显示C组和A组无显著性差异(P>0.05),C组和E组、EA组均有极显著性差异(P<0.01),A组和EA组有极显著性差异(P<0.01),E组和EA组具有显著性性差异(P<0.05)。
对取材时间因素进行主体效应检验,结果显示具有显著影响,进一步的事后多重检验,结果显示,24 h与0、48、120 h,48、72 h与0、2、120 h之间具有显著性差异(P<0.05),其余时相相互比较均未有显著性差异(P>0.05)。对两因素的交互作用进行检验,结果显示具有显著性影响(P<0.01)。各个分组内不同时相的均值及单因素方差分析结果见表1,均值变化趋势如图5所示。
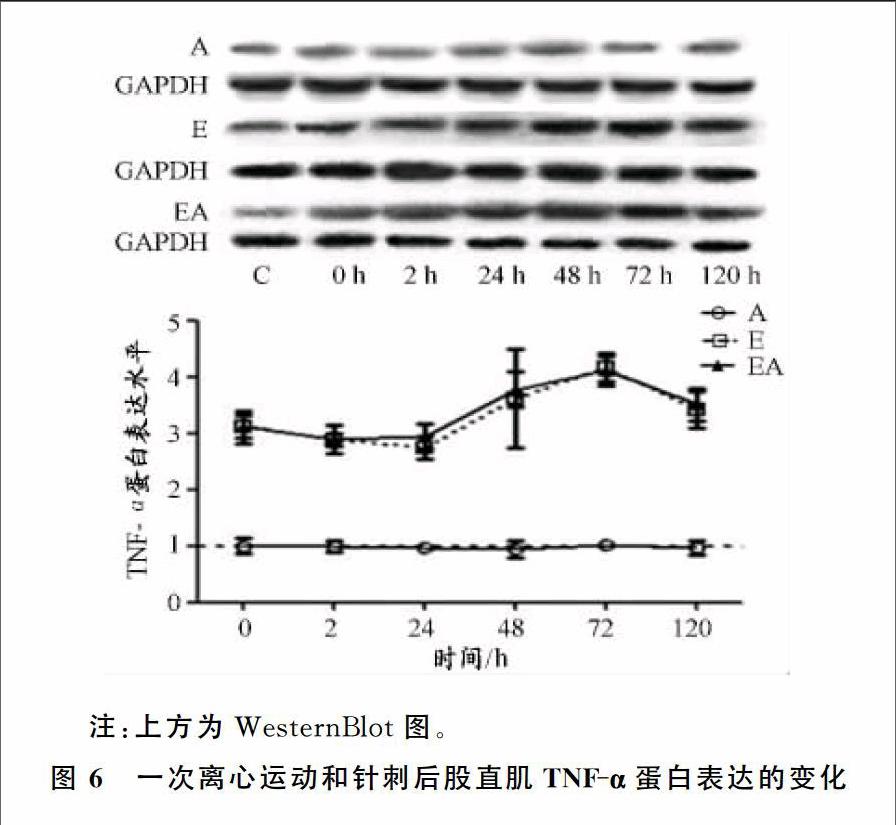
2.3大鼠股直肌中TNF-α的变化
对分组方式因素进行主体效应检验,结果显示具有极显著差异(P<0.01),进一步进行事后多重检验,结果显示C组和A组无显著性差异(P>0.05),C组和E组、EA组均有极显著性差异(P<0.01),A组和EA组有极显著性差異(P<0.01),E组和EA组无显著性差异(P>0.05)。
对取材时间因素进行主体效应检验,结果显示具有显著影响,进一步的事后多重检验,结果显示,48、120 h与0、2、24 h等时相及72 h与所有时相之间都具有显著性差异(P<0.05),其余时相相互比较均未有显著性差异(P>0.05)。对两因素的交互作用进行检验,结果显示具有显著性影响(P<0.01)。
各个分组内不同时相的均值及单因素方差分析结果见表2,均值变化趋势如图6所示。
2.4大鼠血浆中TNF-α的变化
对分组方式因素进行主体效应检验,结果显示具有极显著差异(P<0.01),进一步进行事后多重检验,结果显示C组和A组无显著性差异(P>0.05),C组和E组、EA组均有极显著性差异(P<0.01),A组和EA组有极显著性差异(P<0.01),E组和EA组无显著性性差异(P>0.05)。
对取材时间因素进行主体效应检验,结果显示具有显著影响,进一步的事后多重检验,结果显示,0h与24、48、72、120 h,2 h与120 h之间具有显著性差异,其余时相相互比较均未有显著性差异(P>0.05)。对两因素的交互作用进行检验,数据统计结果显示不具有显著性影响(P>0.05)。各个分组内不同时相的均值及单因素方差分析结果见表3,均值变化趋势如图7所示。
3分析讨论
从事不习惯或长时间大强度运动后会导致骨骼肌结构产生损伤性变化,并伴随着炎症反应,最开始为中性粒细胞进入受损部位,之后巨噬细胞浸润增多并成为主要的炎症细胞,炎症细胞发挥双重作用,一是中性粒细胞和巨噬细胞吞噬坏死细胞和碎片,二是分泌一些生长因子可以激活肌卫星细胞进行修复再生。
HE染色发现,在单纯针刺组并未发现明显浸润的炎症细胞,说明单独进行针刺并不能引起明显的炎症反应,可能是由于并未产生炎症反应,或是炎症反应程度较低,范围较小,在光镜下很难找到针刺所导致炎症的反应区域。屈芳的研究发现比目鱼肌在运动后6 h,肌纤维间出现大量的炎性细胞,在12 h一直到运动后72 h,炎性细胞浸润逐渐增多,在72 h时达到浸润高峰。在本实验单纯运动组中O h和2 h组几乎未见到浸润,是由于炎症细胞浸润到骨骼肌中需要一定的时间,72 h浸润达到峰值,120 h与安静组相比存在较显著的浸润,这与许多研究结果类似,说明骨骼肌在离心运动后的120 h内一直存在着炎症反应。
离心运动后针刺使炎症反应的高峰时相出现在48 h,而在120 h能够看到浸润的炎症细胞明显要比单纯运动组少,说明进行针刺能够使针刺部位骨骼肌炎症反应的峰值时相提前,并能提早结束。在离心运动后对骨骼肌炎症反应进行干预的类似实验中,艾磊的研究发现布洛芬可以加快损伤较重的跖肌的炎症反应速度,并促使肌卫星细胞的增殖。在本模型中针刺比目鱼肌也有类似的结果,但其机理是否相同还有待于进一步研究。
TNF-α作为炎症标志物,在一定程度上能够反映炎症变化情况,结合HE染色可以更准确地分析炎症反应的程度。Kim-berly等研究发现,骨骼肌进行超载负荷后的12 h、24 h、48h、72 h等时相,TNF-α蛋白表达均显著高于对照组。本实验研究结果比目鱼肌、股直肌、血浆中TNF-α均受时相的影响较大,其中比目鱼肌中48 h、72 h时相是本实验中蛋白表达变化的主要时刻点,结合HE染色可知48 h为运动针刺组的峰值,72 h为单纯运动组的峰值,而0h和2 h是血浆质量浓度变化的主要时刻点。
单独进行比目鱼肌针刺,并未明显引起血浆和骨骼肌TNF-α的变化,这与HE的染色结果相符,可能原因是并未引起比目鱼肌TNF-α的产生或是产生量较少,入血后质量浓度较低导致血浆TNF-α质量浓度变化较小,也使得股直肌中几乎无变化。
运动对TNF-α的影响,目前相关研究较多,Vassilakopou-los等发现,没有训练经历的健康男性进行70%最大摄氧量的运动可以引起血浆中TNF-α升高。Andrei等研究发现,健康青年男性进行3 h的60~65%功率自行车和跑台运动,结果发现在运动中1 h和3 h时相血浆中TNF-α显著高于运动前安静水平,在运动结束后3 h和24 h时相仍然高于运动前水平。这些研究均表明,运动能够促使TNF-α高表达。在本实验的研究结果中也表明进行离心运动能引起比目鱼肌、股直肌和血浆中TNF-α的极显著变化,这与目前的研究结论一致。对于运动后TNF-α的峰值变化情况,屈芳采用坡度为-16°的跑台上,实验大鼠以16 m/min的速度进行跑台运动,持续90min,发现比目鱼肌中在72 h时TNF-α的表达达到高峰。在本实验的单纯运动组内比目鱼肌和股直肌中均是在72 h达到峰值,这与屈芳的研究相同。结合HE染色可知是由于骨骼肌的炎症反应加强,并且浸润的巨噬细胞增多,TNF-α分泌较多的缘故。
运动针刺对TNF-α的影响,徐涛对大鼠进行离心运动3周,并进行比目鱼肌针刺干预,发现针刺作为干预手段能够提高TNF-α的表达。在本实验中发现针刺对运动后比目鱼肌TNF-α蛋白有显著影响,但并未引起股直肌和血浆中TNF-α明显的变化。说明针刺对于离心运动后的影响是局部的,局限于针刺部位,而对于非针刺部位骨骼肌和血浆则不能产生明显的作用效果。本研究发现运动针刺比目鱼肌后TNF-α在48 h上升到峰值,与同时相的运动组相比具有显著性差异,结合HE染色可知炎症细胞浸润的峰值时相比单纯运动组提前出现,之后在120 h恢复到较低水平。
运动后进行针刺可能的意义在于,促使针刺部位骨骼肌炎症程度增加并维持在较高水平,有利于加快局部清除受损肌纤维的速度,但对骨骼肌的最终恢复效果是否产生影响还有待于进一步研究。
4结论
本实验中单纯进行针刺干预不会引起骨骼肌和血浆中明显的炎症反应,离心运动可以导致骨骼肌出现一定程度的炎症反应,离心运动后进行针刺干预使针刺部位骨骼肌炎症反应的程度增加,并在峰值之后促使其消退;针刺产生的作用是局部效果,对非针刺部位骨骼肌和血浆不会产生显著影响。endprint

