基于贵金属纳米簇的电化学发光传感器在生命分析中的应用
安晓刚, 杜 捷,*, 卢小泉
(1. 西北师范大学 生命科学学院, 甘肃 兰州 730070;2. 甘肃省生物电化学与环境分析重点实验室, 甘肃 兰州 730070)
基于贵金属纳米簇的电化学发光传感器在生命分析中的应用
安晓刚1, 杜 捷1,2*, 卢小泉2
(1. 西北师范大学 生命科学学院, 甘肃 兰州 730070;2. 甘肃省生物电化学与环境分析重点实验室, 甘肃 兰州 730070)
为了更好地研究贵金属纳米簇的合成机理、扩展贵金属纳米簇-电化学传感器的应用,阐述和比较了贵金属纳米簇的制备方法、电化学发光原理及特点,重点介绍了贵金属纳米簇-电化学传感器在生命分析领域的应用进展及本课题组相关研究,并展望了其发展和应用前景,以期为贵金属纳米簇电化学传感器在生命分析中的研究提供一定的参考。
贵金属纳米簇; 电致化学发光; 电化学生物传感器; 生命分析
1 引 言
电致化学发光(Electrogenerated chemilumines-cence,ECL)是指一些中间体,主要是自由基离子在电的激发下产生于电极表面,继而进行高能电子迁移反应,形成激发态而产生的一种发光现象[1-3]。ECL由于具有快速、高灵敏度以及简化的光学装置等优点,作为一种新型的分析工具,被广泛应用于临床、环境和工业等领域,主要涉及免疫分析[4-6]、食品和水质的分析检测[7-9]、药物分析[10]等。
贵金属纳米簇(Noble metal clusters,MNCs),如Au和Ag纳米簇等,是近年来新兴的一类低毒性的“绿色”荧光标记材料,具有低毒、光学稳定、水溶性好、生物相容性好及优良的电致化学发光性质,可以弥补量子点成像时闪烁的不足。另外,由于MNCs特有的物理尺寸小、荧光可调及生物相容性等优异的性能,使得其在生物成像及检测领域都有着广泛的应用前景[11]。如Ag NCs,由于其具有良好的物理、电学和光学特性,已经应用于表面增强拉曼散射[12]、化学传感[13]、光学器件[14]、生物成像[15]、催化[16]等领域。Liu[16]等用牛血清白蛋白(BSA)作为稳定剂和还原剂,用“一锅法”制备了高水溶性的Au NCs,并将其与ECL有效结合,用于ECL 灵敏、高效地检测多巴胺。
基于贵金属纳米簇的优越性和 ECL 技术的高灵敏性构建的 ECL 生物传感器被广泛应用于生命分析领域,取得了一些可喜的研究成果。一些成果研究应用到了我们的实际生活中,为人类健康服务,如罗氏血糖仪及罗氏电化学发光全自动免疫分析仪等是最好的应用实例。
2 MNCs合成及电化学发光特性
2.1 贵金属团簇的合成
贵金属团簇的制备方法主要包括物理法和化学法两大类,及近年来出现的物理化学综合合成方法。光诱导还原法、惰性气体蒸发冷凝制备法及辐射诱导合成法是物理类中最主要的3种方法。制备金属团簇需要合适的稳定剂作为团簇保护剂与稳定剂,但因为物理法获得的团簇没有适当的稳定剂作为保护,所以极易发生聚集,导致其结构与性质发生改变。另外,物理方法合成时,合成产物一般颗粒较大,粒径分布不均一且稳定性差。因此,化学合成方法在研究中较为常用,主要包括单分子层保护(MPCs)和模板法。
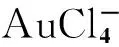
模板法主要基于微乳液[18]、高分子聚合物[19]、聚合电解质[20]以及功能性生物分子如 DNA、多肽和蛋白质等分子[19]的特殊空间结构或功能,在强还原剂(NaBH4)存在条件下获得稳定、荧光可调的贵金属团簇。然而,当运用模板法制备MNCs时,必须选用一些物质制备模板和起到稳定合成的作用,通常选用巯基化合物、蛋白质等作为模板,用于稳定或还原金属离子,否则容易形成聚集现象[19]。
此外,物理化学综合方法是近些年出现且研究比较热的新合成方法,主要包括超声化学合成法和微波辅助化学合成方法。相比物理合成法及化学合成法,超声化学合成法更显优越性,如反应速率快、条件可控、产物纯度高、粒径大小可控等,因此该方法被很多研究者所采用,如Liu等[16]用超声化学合成法制备得到了Ag NCs,大大缩短了反应时间。
微波辅助化学合成具有操作简单、低能耗、反应快速高效、粒径大小可控、环境友好等优越性能,从而被称作“绿色”合成技术。Liu等[21]采用微波辅助合成法以 L 型谷胱甘肽作为合成反应过程中的稳定剂及还原剂,利用微波法在几分钟内快速高效地合成了 GSH/Ag NCs,大大缩短了反应时间。Shang等[22]也采用微波法成功制备了二氢硫辛酸包裹的Au NCs,将反应时间从传统合成方法的几个小时缩减到几分钟,进一步显示出微波法的优越性。
2.2 贵金属团簇的电化学发光性质
贵金属团簇的物理尺寸较小(< 2 nm),当其尺寸接近或小于电子的费米波长时,金属连续的能级会变为准连续甚至是离散能级,从而使团簇产生光致发光现象。荧光是团簇最为重要的性质,当构成团簇的原子数目不同即团簇大小不同时,能级之间能量差值也不同,因此其荧光性质也随之变化。通常具有荧光性质的金属纳米簇都具有电化学发光特性,但是电化学发光原理与一般化学发光不同,主要是自由基离子在外加电的激发下产生于电极表面,继而形成激发态,随后当激发态向基态能级跃迁时伴随光子产生。

ECL 技术由于具有快速、高选择性、高灵敏性、高稳定性、便于操作和控制等特点,已经发展成为一种非常强大的分析工具被应用于各个领域。近年来,基于贵金属纳米簇-ECL生物传感器的研究进一步促进了其在医学检测、食品安全检测等领域的发展。
3 纳米簇的ECL的原理及特点
纳米簇的电化学发光是电化学反应和化学发光反应的结合,主要涉及两个反应过程:电化学过程和化学发光过程。在电化学反应过程中,在外加电压作用下生成发生化学发光反应的自由基离子;在化学发光反应过程中,自由基离子之间或自由基离子与反应体系中其他组分之间发生化学反应产生激发态分子,当这些激发态分子向基态能级跃迁时伴随光子产生。
ECL 技术是融合化学发光和电化学的技术,不需要使用任何外部光。作为一种新的分析方法,主要有以下几个特点:(1)灵敏度高,线性范围宽;(2)反应可控性强;(3)分析速度较快,实验装置简单;(4)试剂用量少,耗费低;(5)获得信息的途径较多;(6)多种技术联用,可以实现对复杂样品的同时分离与检测。
4 在生命分析中的应用
4.1 电化学免疫分析应用
电化学免疫分析是基于免疫学基础,结合电化学技术发展起来的一种有效分析技术。该技术与单纯的免疫反应相比,其最大特点是将抗体 (或抗原) 作为分子识别元件,构建到电极表面,从而将免疫反应的特异性与电化学的高灵敏性相结合,进而实现对目标物的特异性与超灵敏检测。

图1 三重放大ECL免疫生物传感器检测假狂犬病病毒抗体示意图[5]
Zhang等[16]基于贵金属纳米簇的夹心免疫反应原理,将铂纳米粒子标记抗体引入电极表面,进而实现响应信号的放大和检测限的极大提高。Shao等[5]基于三重放大电化学传感器对于检测低丰度生物标志物的优越性,以“Stretch-Stowage-Growth”策略构建了三重放大 ECL 免疫生物传感器来超灵敏检测假狂犬病病毒抗体 (图1),对假狂犬病病毒抗体的检测限可达到0.4 pg·mL-1。该技术具有很好的应用前景。
4.2 在癌症等疾病诊断方面的应用研究
癌症也称恶性肿瘤,目前已成为中国乃至全世界最重要的死亡原因,也是非常重要的公共健康问题[28]。对癌症的早期有效诊断措施是对患者血清中的特殊肿瘤标志物进行特异性、高灵敏检测,从而实现对肿瘤(癌)的预警及早期诊断、治疗。常见肿瘤(癌)及肿瘤标志物如表1所示。
如何有效、灵敏地对癌症等疾病进行早期诊断检测与治疗仍是生命分析研究亟需解决的问题和研究热点。目前,针对肿瘤标志物的免疫分析方法主要有酶联免疫法(ELISA)[29-30]、化学发光免疫法[31-32]、荧光免疫分析法[33-34]等,其中将高特异性的免疫分析方法与高灵敏的电化学方法相结合而构建的电化学免疫传感器一直是研究热点[35-37]。

表1 常见肿瘤(癌症)及其标志物
Bruno等[38]构建了体外DNA寡核苷酸适配体ECL传感器检测炭疽杆菌。Xiang等[8]设计了一种可在同一位点同时检测多种目标物的基因传感器(图2),能同时分别检测来自鼠伤寒沙门氏杆菌病原体(gyrB基因)和直肠肿瘤(K-ras基因)的基因生物标记物。Huang等[39]运用钯纳米簇,设计了一种双电位比率型 ECL策略用于免疫分析,并以癌胚抗原为模型,研究了该设计的可行性。结果表明:该设计对生物标记蛋白具有很好的选择性和检测,最低检测限可达0.62 pg·mL-1。
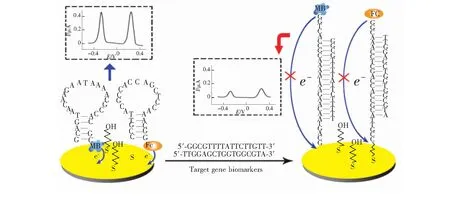
图2 同时检测鼠伤寒沙门氏杆菌病原体(gyr基因)和直肠肿瘤(K-ras基因)的基因生物标记物电化学免疫传感器[8]
Fig.2 Simultaneous detection of Salmonella typhimurium pathogen(gyrB gene) and rectal tumor(K-ras gene) gene biomarker electrochemical immunosensor[8]
Cao等[40]基于纳米合金颗粒(Au-Pt)构建了检测 CEA 的夹心免疫结构,其原理如图3。由于 Au 和 Pt 之间的高效协同作用,Au-Pt 合金纳米粒子除具有较大的比表面积、良好的生物相容性和优良的导电能力外,还可进一步催化底液中的H2O2溶液,进而利用Au-Pt纳米粒子及HRP对过氧化氢的协同催化作用实现双重信号放大。该传感器用于测定CEA的浓度范围为0.01~200 ng/mL。
Yang等[41]构建了一种新型的电流型免疫传感器,对肿瘤标志物 CEA 的检测限为12 pg·mL-1。

图3 用于CEA检测的Au-Pt 双金属电化学传感器[40]
另外,Zhou等[17]用氮掺杂石墨烯设计了一种猝灭型ECL免疫传感器,以肿瘤标志物甲胎蛋白(Alpha-fetal protein,AFP)为模型探究了该传感器的分析性能,当浓度范围在0.01~100 ng·mL-1时具有很好的线性,最低检测限可达到3.3 pg·mL-1。
最近文献报道,Zhang等[42]设计了一种比率型ECL免疫传感器,能够超灵敏、特异性检测肿瘤标志物甲胎蛋白(AFP)并对其具有很宽的线性检测范围(1 fg·mL-1~20 ng·mL-1),最低检测限可以达到1 fg·mL-1。Zhang等[43]基于鲁米诺-金纳米粒子构建了双信号生物传感器用于检测端粒酶,该方法不仅能够检测100~9 000个HL 细胞中端粒酶的含量,还可以用于研究肿瘤细胞的凋亡。
4.3 对生物分子的检测
Gu等[44]将碳量子点(CDs)制作成 “off-on” 型荧光探针检测Au(Ⅲ)与谷胱甘肽含量,该方法可以用于细胞内不同状态下谷胱甘肽含量的测定。多巴胺是下丘脑和脑垂体腺中的一种重要神经递质,与人们的情绪息息相关,Liu等[25]首次基于他们合成的 Ag NCs 构建的电化学传感器对多巴胺进行了检测,检测限可以达到 9.2×10-10mol/L。后来,Li等[27]基于他们合成的Au NC的ECL检测多巴胺,并研究了Au NC的ECL发光机理。Zhang等[45]基于逐步化学反应策略,构建了高灵敏 ECL 传感器检测多巴胺,以 O2作为内源性共反应剂,大大提高了检测信号及检测限,下限可达到 26 pmol/L。
Yuan等[46]构建了石墨烯/多壁碳纳米管/金纳米簇复合型 ECL传感器,用于检测酚类化合物。Wu等[47]将制备的 AuNC@BSA-silica NPs 构建成固态 ECL传感器检测过氧化氢。Chen等[48]基于离子液体的优越性构建了离子液体诱导型 CO2传感器检测CO2,检测限为 80 ×10-6,其反应过程如图4所示。Jia等[49]基于Au-HS/SO3H-PMO构建了一种可灵敏检测葡萄糖的非酶电化学传感器,对葡萄糖的检测限可达到 2.5×10-8mol/L,灵敏度为 6.45×102μA·mmol-1·L·cm-2,该方法为人类血清中葡萄糖含量的有效测定提供了一种可能。
Gui等[50]将 Ru(Ⅱ) 和氨卡青霉素连接在一起作为识别元件构建了一种新型的 ECL 生物传感器用于检测内酰胺酶(图5)。在该过程中,构建的Ru-Amp不仅作为识别元件,同时也作为发光试剂,通过静电吸附和分子内部的π-π键相互作用将其与制备的 Au NPs构建成复合纳米材料。该复合材料会子组装到 CNTs-Nf 修饰的玻碳电极上,基于Amp的自身水解反应,从而明显增强 ECL 信号,可以对内酰胺酶进行高灵敏检测,检测浓度范围为50 pg·mL-1~100 ng·mL-1,最低检测限为 37 pg·mL-1。
Xu等[51]用钌(Ⅱ) 和1,10-菲咯啉-5,6-二酮络合物(Ru-dpq)构建了一种可以高选择性、灵敏检测 GSH 的猝灭型ECL传感器,在0.1 pmol/L~50 μmol/L范围内呈良好线性,检测限可以达 0.087pmol/L。质谱探究发现,在该反应过程中,GSH 使 Ru-dpq 反应后结构发生了改变,生成了一种氧化产物Ru-dcbpy,同时还原型 GSH 变成了氧化性 GSSG。

图4 离子液体诱导型CO2传感器检测CO2[48]
Fig.4 Inducible ionic liquid CO2sensor CO2[48]
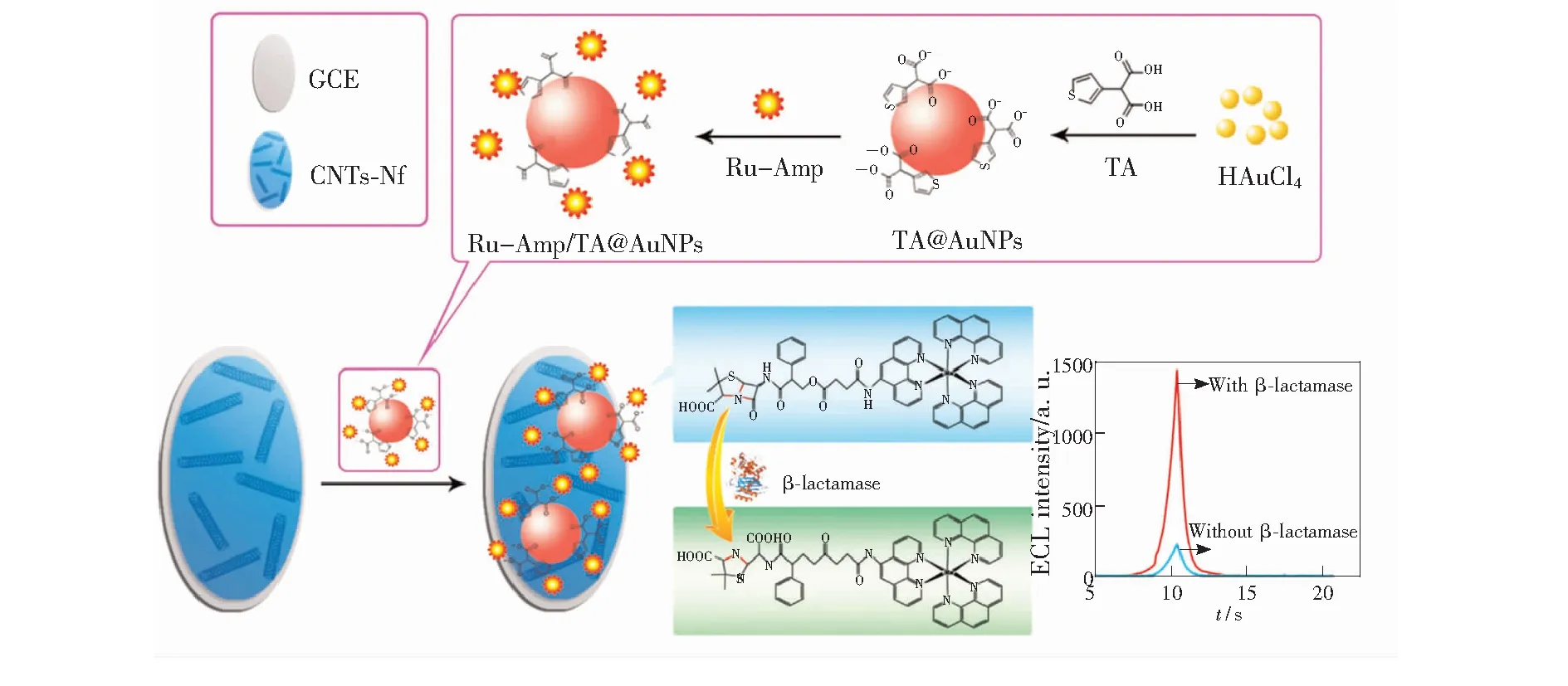
图5 生物传感器构建示意图及目标检测机制[50]
4.4 本课题组近年对生命分析的相关研究
Du等[52]基于三维石墨烯构建的电化学传感器可以实现对对苯二酚(HQ) 和邻苯二酚(CC)的同时检测,HQ和CC的线性检测范围分别为3.10×10-7~1.31×10-5mol/L和2.50×10-7~1.29×10-5mol/L。Bi 等[53]基于2,2,6,6-四甲基哌啶-1-氧基(TEMPO)-氧化纤维素纳米晶体(TOCNCs) 和 L-半胱氨酸修饰到金电极表面构建的电化学生物传感器,能够灵敏地检测和鉴别手性氨基酸,包括苯基丙氨酸(Phe)、亮氨酸(Leu)和缬氨酸(Val),这3种手性氨基酸与人体的代谢疾病相关。利用该电化学传感器对正常人和糖尿病人血清进行检测,结果表现出显著性差异,从而为代谢疾病的筛查、诊断和治疗具有重要的意义。

5 展 望
综上所述,基于贵金属纳米簇的电化学发光传感器为生命分析研究提供了强有力的技术支撑,利用免疫分析及 DNA 杂交技术构建的电化学生物传感器被广泛应用于生物电分析及生命分析领域。在我们的日常生活中,罗氏血糖仪及医院常用的罗氏电化学发光全自动免疫分析仪等是最好的理论研究转化为实际应用的实例。
尽管在医学诊断、免疫分析、食品和水质分析检测、药物分析等方面的研究取得了一些可喜的成果,但对于癌症等疾病的早期诊断与治疗仍是生物学家和分析化学研究者所共同关注的问题和面临的挑战。很多研究报道了基于 NMCs 构建的ECL生物传感器能超灵敏检测癌症等疾病,但这些研究只是局限于实验室的理想条件下对细胞的研究,并没有应用于体内复杂环境下的深层次研究。另外,如何将低毒性的贵金属纳米簇有效地作为药物示踪标记物应用到临床疾病的靶向治疗及药物“负载-释放”过程的可视化具有重要的研究意义。
近些年的研究趋势充分体现了化学与生物的交叉融合、生物学家和化学家的协同合作。基于纳米材料与 ECL 技术的生物电化学传感器及生物电分析的研究为生物学及生命分析的研究提供了更好的技术支撑。技术的发展是为了更好地服务于应用,只有当技术的发展永远走在应用的前面,才能更好地服务于应用。相信随着研究的不断深入和技术的不断进步,肯定会取得更大的成果,更好地为人类健康服务。
[1] MIAO W J. Electrogenerated chemiluminescence and its biorelated applications [J].Chem.Rev., 2008, 108(7):2506-2553.
[2] RICHTER M M. Electrochemiluminescence (ECL) [J].Chem.Rev., 2004, 104(6):3003-3036.
[3] RICHTER M M, BARD A J, KIM W,etal.. Electrogenerated chemiluminescence. 62. Enhanced ECL in bimetallic assemblies with ligands that bridge isolated chromophores [J].Anal.Chem., 1998, 70(2):310-318.
[4] WU L, WANG J S, FENG L Y,etal.. Label-free ultrasensitive detection of human telomerase activity using porphyrin-functionalized graphene and electrochemiluminescence technique [J].Adv.Mater., 2012, 24(18):2447-2452.
[5] SHAO K, WANG J, JIANG X C,etal.. Stretch-stowage-growth strategy to fabricate tunable triply-amplified electrochemiluminescence immunosensor for ultrasensitive detection of pseudorabies virus antibody [J].Anal.Chem., 2014, 86(12):5749-5757.
[6] CHEN L C, ZENG X T, SI P,etal.. Gold nanoparticle-graphite-like C3N4nanosheet nanohybrids used for electrochemiluminescent immunosensor [J].Anal.Chem., 2014, 86(9):4188-4195.

[8] XIANG Y, QIAN X Q, CHEN Y,etal.. A reagentless and disposable electronic genosensor: from multiplexed analysis to molecular logic gates [J].Chem.Commun., 2011, 47(7):2080-2082.
[9] RIVERA V R, GAMEZ F J, KEENER W K,etal.. Rapid detection ofClostridiumbotulinumtoxins A, B, E, and F in clinical samples, selected food matrices, and buffer using paramagnetic bead-based electrochemiluminescence detection [J].Anal.Biochem., 2006, 353(2):248-256.
[10] BERTOLINO C, MACSWEENEY M, TOBIN J,etal.. A monolithic silicon based integrated signal generation and detection system for monitoring DNA hybridisation [J].Biosens.Bioelectron., 2005, 21(4):565-573.
[11] SHIRAISHI Y, TOSHIMA N. Colloidal silver catalysts for oxidation of ethylene [J].J.Mol.Catal.AChem., 1999, 141(1-3):187-192.
[12] GUO C L, IRUDAYARAJ J. Fluorescent Ag clusters via a protein-directed approach as a Hg(Ⅱ) ion sensor [J].Anal.Chem., 2011, 83(8):2883-2889.
[13] 刘茹, 王亚玲, 崔岩岩, 等. 贵金属团簇探针用于细胞成像及体外检测 [J]. 生物化学与生物物理进展, 2013, 40(10):977-989. LIU R, WANG Y L, CUI Y Y,etal.. Recent development of noble metal clusters for bioimaging andinvitrodetection [J].Prog.Biochem.Biophys., 2013, 40(10):977-989. (in Chinese)
[14] NIE G M, LI C X, ZHANG L,etal.. Fabrication of a simple and sensitive QDs-based electrochemiluminescence immunosensor using a nanostructured composite material for the detection of tumor markers alpha-fetoprotein [J].J.Mater.Chem. B, 2014, 2(47):8321-8328.
[15] LIU D Q, WANG L, MA S H,etal.. A novel electrochemiluminescent immunosensor based on CdS-coated ZnO nanorod arrays for HepG2 cell detection [J].Nanoscale, 2015, 7(8):3627-3633.
[16] ZHANG J, TING B P, KHAN M,etal.. Pt nanoparticle label-mediated deposition of Pt catalyst for ultrasensitive electrochemical immunosensors [J].Biosens.Bioelectron., 2010, 26(2):418-423.
[17] ZHOU J, HAN T Q, MA H M,etal.. A novel electrochemiluminescent immunosensor based on the quenching effect of aminated graphene on nitrogen-doped carbon quantum dots [J].Anal.Chim.Acta, 2015, 889:82-89.
[18] CUI Y Y, WANG Y L, LIU R,etal.. Serial silver clusters biomineralized by one peptide [J].ACSNano, 2011, 5(11):8684-8689.
[19] ZHENG J, PETTY J T, DICKSON R M. High quantum yield blue emission from water-soluble Au8nanodots [J].J.Am.Chem.Soc., 2003, 125(26):7780-7781.
[20] GRÖHN F, BAUER B J, AKPALU Y A,etal.. Dendrimer templates for the formation of gold nanoclusters [J].Macromolecules, 2000, 33(16):6042-6050.
[21] LIU T, SU Y Y, SONG H J,etal.. Microwave-assisted green synthesis of ultrasmall fluorescent water-soluble silver nanoclusters and its application in chiral recognition of amino acids [J].Analyst, 2013, 138(21):6558-6564.
[22] SHANG L, YANG L X, STOCKMAR F,etal.. Microwave-assisted rapid synthesis of luminescent gold nanoclusters for sensing Hg2+in living cells using fluorescence imaging [J].Nanoscale, 2012, 4(14):4155-4160.
[23] 王珂. 合金纳米簇对鲁米诺电化学发光的增敏及应用 [D]. 苏州: 苏州大学, 2013. WANG K.EnhancementofElectrochemiluminescenceofLuminolbyAlloyNanoclusterandTheApplicationforSensitiveAssayofEstrogen[D]. Suzhou: Soochow University, 2013. (in Chinese)
[24] QI H L, LI M, DONG M M,etal.. Electrogenerated chemiluminescence peptide-based biosensor for the determination of prostate-specific antigen based on target-induced cleavage of peptide [J].Anal.Chem., 2014, 86(3):1372-1379.
[25] LIU T, ZHANG L C, SONG H J,etal.. Sonochemical synthesis of Ag nanoclusters: electrogenerated chemiluminescence determination of dopamine [J].Luminescence, 2013, 28(4):530-535.
[26] FANG Y M, SONG J, LI J,etal.. Electrogenerated chemiluminescence from Au nanoclusters [J].Chem.Commun., 2011, 47(8):2369-2371.
[27] LI L L, LIU H Y, SHEN Y Y,etal.. Electrogenerated chemiluminescence of Au nanoclusters for the detection of dopamine [J].Anal.Chem., 2011, 83(3):661-665.
[28] CHEN W Q, ZHENG R S, BAADE P D,etal.. Cancer statistics in China, 2015 [J].CACancerJ.Clin., 2016, 66(2):115-132.
[29] WAN Y, QI P, ZHANG D,etal.. Manganese oxide nanowire-mediated enzyme-linked immunosorbent assay [J].Biosens.Bioelectron., 2012, 33(1):69-74.
[30] JIA C P, ZHONG X Q, HUA B,etal.. Nano-ELISA for highly sensitive protein detection [J].Biosens.Bioelectron., 2009, 24(9):2836-2841.
[31] ZHANG A M, XIANG H K, ZHANG X,etal.. A novel sandwich electrochemiluminescence immunosensor for ultrasensitive detection of carbohydrate antigen 19-9 based on immobilizing luminol on Ag@BSA core/shell microspheres [J].Biosens.Bioelectron., 2016, 75:206-212.
[32] XU S J, LIU Y, WANG T H,etal.. Positive potential operation of a cathodic electrogenerated chemiluminescence immunosensor based on luminol and graphene for cancer biomarker detection [J].Anal.Chem., 2011, 83(10):3817-3823.
[33] XIE Q F, WENG X H, LU L J,etal.. A sensitive fluorescent sensor for quantification of alpha-fetoprotein based on immunosorbent assay and click chemistry [J].Biosens.Bioelectron., 2016, 77:46-50.
[34] HUA W H, LIU Y S, YANG H B,etal.. ZnO nanorods-enhanced fluorescence for sensitive microarray detection of cancers in serum without additional reporter-amplification [J].Biosens.Bioelectron., 2011, 26(8):3683-3687.
[35] BAHADIR E B, SEZGINTÜRK M K. Applications of electrochemical immunosensors for early clinical diagnostics [J].Talanta, 2015, 132:162-174.
[36] CHIKKAVEERAIAH B V, BHIRDE A A, MORGAN N Y,etal.. Electrochemical immunosensors for detection of cancer protein biomarkers [J].ACSNano, 2012, 6(8):6546-6561.
[37] LIM S A, AHMED M U. Electrochemical immunosensors and their recent nanomaterial-based signal amplification strategies: a review [J].RSCAdv., 2016, 6(30):24995-25014.
[38] BRUNO J G, KIEL J L.Invitroselection of DNA aptamers to anthrax spores with electrochemiluminescence detection [J].Biosens.Bioelectron., 1999, 14(5):457-464.
[39] HUANG Y, LEI J P, CHENG Y,etal.. Ratiometric electrochemiluminescent strategy regulated by electrocatalysis of palladium nanocluster for immunosensing [J].Biosens.Bioelectron., 2016, 77:733-739.
[40] CAO X, WANG N, JIA S,etal.. Bimetallic AuPt nanochains: synthesis and their application in electrochemical immunosensor for the detection of carcinoembryonic antigen [J].Biosens.Bioelectron., 2013, 39(1):226-230.
[41] YANG H C, YUAN R, CHAI Y Q,etal.. Electrochemical immunosensor for detecting carcinoembryonic antigen using hollow Pt nanospheres-labeled multiple enzyme-linked antibodies as labels for signal amplification [J].Biochem.Eng.J., 2011, 56(3):116-124.
[42] ZHANG Q R, DAI H, WANG T,etal.. Ratiometric electrochemiluminescent immunoassay for tumor marker regulated by mesocrystals and biomimetic catalyst [J].Electrochim.Acta, 2016, 196:565-571.
[43] ZHANG H R, WU M S, XU J J,etal.. Signal-on dual-potential electrochemiluminescence based on luminol-gold bifunctional nanoparticles for telomerase detection [J].Anal.Chem., 2014, 86(8):3834-3840.
[44] GU J J, HU D H, WANG W N,etal.. Carbon dot cluster as an efficient “off-on” fluorescent probe to detect Au(Ⅲ) and glutathione [J].Biosens.Bioelectron., 2015, 68:27-33.
[45] ZHANG L, CHENG Y, LEI J P,etal.. Stepwise chemical reaction strategy for highly sensitive electrochemiluminescent detection of dopamine [J].Anal.Chem., 2013, 85(16):8001-8007.
[46] YUAN D H, CHEN S H, YUAN R,etal.. An electrogenerated chemiluminescence sensor prepared with a graphene/multiwall carbon nanotube/gold nanocluster hybrid for the determination of phenolic compounds [J].Analyst, 2013, 138(20):6001-6006.
[47] WU Y F, HUANG J H, ZHOU T Y,etal.. A novel solid-state electrochemiluminescence sensor for the determination of hydrogen peroxide based on an Au nanocluster-silica nanoparticle nanocomposite [J].Analyst, 2013, 138(19):5563-5565.
[48] CHEN L C, HUANG D J, REN S Y,etal.. Carbon dioxide gas sensor based on ionic liquid-induced electrochemiluminescence [J].Anal.Chem., 2011, 83(17):6862-6867.
[49] JIA F F, ZHONG H, LI X R,etal.. Research on novel nonenzymatic ECL sensor using Au-HS/SO3H-PMO (Et) nanocomposites for glucose detection [J].J.Electroanal.Chem., 2015, 758:93-99.
[50] GUI G F, ZHUO Y, CHAI Y Q,etal.. A novel ECL biosensor for β-lactamase detection: using RU(Ⅱ) linked-ampicillin complex as the recognition element [J].Biosens.Bioelectron., 2015, 70:221-225.
[51] XU Y X, ZHANG L, LIU Y,etal.. Sensitive and selective determination of GSH based on the ECL quenching of Ru(Ⅱ) 1,10-phenanthroline-5,6-dione complex [J].Biosens.Bioelectron., 2016, 77:182-187.
[52] DU J, MA L L, SHAN D L,etal.. An electrochemical sensor based on the three-dimensional functionalized graphene for simultaneous determination of hydroquinone and catechol [J].J.Electroanal.Chem., 2014, 722-723:38-45.
[53] BI Q, DONG S Q, SUN Y M,etal.. An electrochemical sensor based on cellulose nanocrystal for the enantioselective discrimination of chiral amino acids [J].Anal.Biochem., 2016, 508:50-57.
[54] DONG M J, NAN Z H, LIU P P,etal.. Two-phase synthesis of hydrophobic ionic liquid-capped gold nanoparticles and their application for sensing cholesterol [J].Electrochim.Acta, 2014, 132:465-471.
[55] GUO Z P, LIU X H, LIU Y L,etal.. Constructing a novel 8-hydroxy-2′-deoxyguanosine electrochemical sensor and application in evaluating the oxidative damages of DNA and guanine [J].Biosens.Bioelectron., 2016, 86:671-676.
[56] LIU Y L, LIU X H, LIU Y D,etal.. Construction of a highly sensitive non-enzymatic sensor for superoxide anion radical detection from living cells [J].Biosens.Bioelectron., 2017, 90:39-45.
[57] CHEN J, ZHANG L P, GUO H X,etal.. Activity prediction of hepatitis C virus NS5B polymerase inhibitors of pyridazinone derivatives [J].Chemom.Intell.Lab.Syst., 2014, 134:100-109.

安晓刚(1989-),男,甘肃静宁人, 硕士,2017年于西北师范大学获得硕士学位,主要从事生物分析化学、电化学生物传感器等方面的研究。

E-mail: axg225@163.com杜捷 (1971-)男,甘肃成县人,博士,教授,2011年于西北师范大学获得博士学位,主要从事遗传学、生物分析化学、生物传感器及纳米分析技术的研究。
E-mail: dujie@nwnu.edu.cn
Application in Life Analysis of Electrochemiluminescent Sensor Based on Noble Metal Nanocluster
AN Xiao-gang1, DU Jie1,2*, LU Xiao-quan2
(1.CollegeofLifeScience,NorthwestNormalUniversity,Lanzhou730070,China;2.KeyLaboratoryofBioelectrochemistry&EnvironmentalAnalysisofGansuProvince,Lanzhou730070,China)
In order to study the synthesis mechanism of noble metal nanoclusters and the application of noble metal nanoclusters-electrochemical sensors, some methods of the synthesis and the properties of noble metal nanoclusters are described and compared. The principle and characteristics of electrogenerated chemiluminescence (ECL) are briefly described, the progress of application of noble metal nanoclusters-electrochemical sensor in life analysis and the related research of our research group are mainly introduced. The development and application are prospected, which may provide a reference for the research of noble metal nanoclusters-electrochemiluminescent sensor in life analysis.
noble metal clusters (MNCs); electrogenerated chemiluminescence (ECL); electrochemical biosensor; life analysis
1000-7032(2017)05-0675-10
2016-12-12;
2017-02-12
国家自然科学基金(21165015,21565020)资助项目 Supported by National Natural Science Foundation of China (21165015,21565020)
O657.1
A
10.3788/fgxb20173805.0675
*CorrespondingAuthor,E-mail:dujie@nwnu.edu.cn
——庆祝中国共产党成立一百周年贵金属纪念币展

