ISSR分子标记内生真菌接种大花红景天的遗传特征分析
崔晋龙,任晓琳,2,王梦亮*
(1.山西大学 应用化学研究所,山西 太原 030006;2.山西大学 生物技术研究所,山西 太原 030006)
ISSR分子标记内生真菌接种大花红景天的遗传特征分析
崔晋龙1,任晓琳1,2,王梦亮1*
(1.山西大学 应用化学研究所,山西 太原 030006;2.山西大学 生物技术研究所,山西 太原 030006)
为了探索活性内生真菌ZPRa-R-1对宿主DNA遗传性状是否存在影响,采用ISSR分子标记法对二者互作15 d的大花红景天DNA多态性进行分析研究。结果表明,采用12条ISSR引物对ZPRa-R-1接种的红景天进行扩增,可扩增出94条条带,其中多态性条带为82条,其百分比为87.23%。每条引物平均扩增7.83条带,扩增片段长度在100~8 000 bp之间;菌苗互作15 d与对照组的Nei’s遗传距离和遗传一致度分别为0.123 3~1.285 2和0.276 6~0.884 0;真菌接种的大花红景天、无菌组培苗和真菌ZPRs-R-11之间的基因流Nm=0.138 8,小于1;聚类分析得到三个遗传性状分支,第Ⅰ大类包括对照组无菌大花红景天及真菌与组培苗共培养1~10 d的样品;第Ⅱ大类为真菌与组培苗共培养11~15 d的样品;第Ⅲ大类为对照组ZPRa-R-1真菌;在接种的15 d内,共生时间越长,二者之间的遗传相似系数越大,表明活性内生真菌ZPRa-R-1能够引起宿主红景天遗传性状改变。
内生真菌;ISSR;大花红景天;遗传性状
内生菌是一类生活史的全部或部分阶段生长于植物组织内部,而不引起植物明显病状的微生物[1]。近年来,人们发现内生真菌是重要的天然产物资源[2],也是影响植物发育、代谢的重要因素[3]。内生菌与宿主植物之间存在着信号调控、基因交换等现象[4]。诸多研究表明,内生真菌与宿主植物的共生,引起宿主植物生理功能和表型的变化,是真菌与宿主之间发生了DNA水平的相互作用[9],进而导致宿主植物生理功能的变化,能够对宿主植物的种子萌发、生长发育、生物与非生物胁迫、化合物积累等起重要作用[5],成为植物品质改良与控制、病害防治、药用植物道地性评价等不可忽视的重要因素[5]。
植物表型及生理功能取决于其基因序列的排列和组成,DNA分子水平的微小变化都可能导致植物生理和代谢功能的变化,不同的DNA分子序列组成表现出DNA分子片段的多态性,因此,对DNA分子水平多态性的检测是进行基因组研究的基础。ISSR(inter-simple sequence repeat)分子标记是在SSR标记的基础上建立起来的用于检测DNA水平遗传性状的分析技术[6],引物一般为17~24 bp,具有稳定性高、重复率好、试验成本低、多态性好等优点[7],广泛应用于植物遗传多样性分析、种群亲缘关系、生物指纹图谱、品种检测等工作中[8]。
在前期研究工作中,课题组获得了一株具有生物活性的红景天内生真菌ZPRa-R-1,与大花红景天健康地共生,能够诱导激活大花红景天信号分子网络,导致主要活性成分红景天苷合成途径中关键酶活性的增强,进而促进红景天苷和酪醇等活性产物的积累[9]。为了进一步检测ZPRa-R-1接种宿主互作关系中DNA水平的变化,本研究采用ISSR分子标记技术对ZPRa-R-1接种大花红景天的一个试验周期(15 d)中DNA分子多态性的变化进行研究,旨在探索内生真菌ZPRa-R-1对宿主DNA遗传性状的影响,为研究内生真菌ZPRa-R-1的生物功能、大花红景天药材形成的生物影响因素及其品质监控等提供参考依据。
1 材料与方法
1.1 实验材料
1.1.1 供试菌株
菌株ZPRa-R-1于2012年6月分离自我国长白山地区的长白红景天(Rhodiolaangusta)根部,鉴定为瓶头霉属(Phialocephala)真菌[10],GenBank编号为No. KJ542299。保藏于山西大学应用化学研究所。
1.1.2 大花红景天组培苗:本课题组于2012年9月采集于西藏的野生大花红景天(R.crenulata)并建立的快繁组培苗[11],本实验所用组培苗为第24世代转接苗,稳定生长一周后供接种用。
1.1.3 试剂:实验中所用的EasyTaq PCR SuperMix,100 bp DNA Ladder等试剂由北京全式金生物技术公司提供。其它重要生化试剂由山西奥赛生物公司提供,ISSR引物由上海生工生物工程股份有限公司合成。
1.2 方法
1.2.1 ZPRa-R-1接种大花红景天
将低温储藏的ZPRa-R-1菌株活化并接种于PDA培养基 [1 L配方:去皮土豆200 g,煮熟取汁,加葡萄糖20 g,琼脂粉18 g,定容至1 L, pH自然。] 平板,在25℃条件下暗培养,待菌落长至2/3平板直径时,在菌落边缘处均匀打取0.5 cm的菌饼,将3块菌饼均匀放置于组培苗与MS培养基[11]接触部位,光14 h/暗10 h交替;对应温度为28℃和22℃;湿度70%~75% RH;光照强度30 μmol/m2/s条件下培养。显微检测真菌侵入红景天时开始计时,培养15 d,每天取样1次,共15批次,记为15个样;以接种以前独立培养生长的ZPRa-R-1、大花红景天组培苗分别作为对照;共计17个样品,各设3次重复。
1.2.2 DNA的提取及检测
植物总DNA的提取采用CTAB法[12],1%的琼脂糖凝胶电泳检测其完整性。
1.2.3 ISSR-PCR反应体系
选取12条引物[13]进行ISSR的PCR扩增标记。PCR反应体系为EasyTaq PCR SuperMix 6 μL(2 mmol/L Mg2+),其它同上。PCR扩增程序为:94℃预变性4 min;94℃变性1 min,退火1 min(退火温度根据各个引物的最适退火温度),72℃延伸1 min,40个循环;72℃延伸7 min,4℃保存。
1.2.4 结果检测及数据分析
采用1.5%凝胶电泳对ISSR扩增标记产物进行检测,电压120 V,点样5 μL,电泳完毕后,以8 000 bp DNA Maker为标准,对每条引物的电泳条带分别进行统计,迁移率相同的条带被认为是同源性的,电泳图谱上清晰且稳定的条带赋值为“1”,无条带或弱带的赋值为“0”,形成0/1矩阵。假设分析对象均符合Hardy-Weinberg平衡,用软件PopGene 32[14]计算多态位点百分率(PPB)、等位基因数(Na)、有效等位基因数(Ne)、基因多样性指数(H)、Shannon多样性指数(I)等。采用 NTSYS-pc2.10e[15]软件对 Nei’s 遗传距离进行UPGMA(unweight pair-group method with arithmetic average)聚类分析。
2 结果与分析
2.1 ZPRa-R-1与组培苗共生15 d的 ISSR多样性分析
根据引物筛选结果筛选出扩增条带清晰、重复性高的ISSR引物12条。12条ISSR引物共扩增出94条条带,多态性条带82条,多态性百分比为87.23%。每条引物平均扩增7.83条带,扩增片段长度为100~8 000 bp,由此可看出菌苗互作后的扩增结果与对照组相比有新的条带出现或原有条带消失,部分引物的扩增结果见图1。
ZPRa-R-1与组培大花红景天互作15 d后的样品及两个对照组的Nei’s遗传距离(D)和遗传一致度(J),结果见表1。数据显示D为0.123 3-1.285 2,J为0.276 6-0.884 0。遗传距离最近的是菌苗互作样品与无菌培养的组培苗(D=0.123 3;J=0.884 0),遗传距离最远的是真菌ZPRa-R-1与无菌组培苗(D=1.285 2;J=0.276 6)。
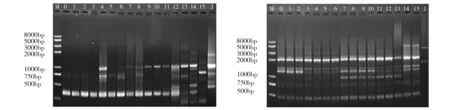
1-15 d refer to R. crenulata inoculated with ZPRa-R-1 in 1~15 days; 0 d is R. crenulata culture seedling which didn’t inoculate with fungus;J refer to endophytic fungi;M is MarkerFig.1 Amplification electrophorogram of ISSR primers I3(A) and I4(B)1~15 d依次为接种ZPRa-R-1为1~15 d的组培苗;0 d为未接菌组培苗;J为内生真菌ZPRa-R-1;M为Marker图1 ISSR引物I3(A)、I4(B)的扩增电泳示意图
种群总基因多样性(Ht)为0.365 3,种群内基因多样性(Hs)为0.079 4,种间分化系数(Gst)为0.782 7,真菌互作的大花红景天、无菌组培苗和真菌ZPRs-R-11之间的基因流Nm=0.138 8,小于1,说明菌苗互作后真菌与宿主植物发生了一定程度的遗传交换,但交换率较低。
2.2 ZPRa-R-1与组培苗共生15 d基于ISSR的聚类分析
17个样品间的聚类结果见图2。由图2可以看出,当遗传相似系数为0.740 0时,17个样品可以聚为三大类:第Ⅰ大类包括对照组无菌大花红景天及ZPRa-R-1与组培苗的互作1~10 d后的红景天组培苗;第Ⅱ大类包括ZPRa-R-1与组培苗的互作11~15 d后的红景天组培苗;第Ⅲ大类只有对照组ZPRa-R-1真菌。这一结果表明,内生真菌ZPRa-R-1接种大花红景天,能够引起植物DNA遗传水平的变化。在所有样品中,大花红景天组培苗和内生真菌 ZPRa-R-1之间具有最远的亲缘关系;接种之后,在第1至第15天,接种苗与真菌ZPRa-R-1的亲缘关系逐步变近;另外出现了接种前4天与无菌苗亲缘关系近,第5至第10天相对独立,第11天至第15天的接种苗与真菌ZPRa-R-1具有更近的亲缘关系。这进一步说明内生真菌能导致共生植物的遗传形状发生变化。

表1 基于ISSR分析ZPRa-R-1与组培苗互作后的遗传一致度(右上)和遗传距离(左下)
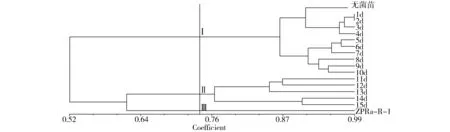
Fig.2 Dendrograms of cluster for Rhodiola crenulata inoculated with ZPRa-R-1 based on ISSR molecular markers图2 ZPRa-R-1与组培苗互作后ISSR聚类图
3 讨论
长期以来,人们评价药用植物品质的影响因素主要集中在植物的基因型和外环境因素如土壤、气候、温度、pH值等,忽略了植物内环境中的生物因子[5]。自Strobel课题组从红豆杉发现一株能产生紫杉醇的内生真菌以来,内生真菌资源开发和内生菌群落微生态功能逐步引起人们的重视,成为植物品质研究中不可忽视的因素[16]。近来研究表明,植物的基因型、生理状态、代谢组成等对其内生真菌及群落具有选择性,也能塑造不同于别的植株的特有内生真菌微生态特征;同时,内生真菌生长状态也能对宿主的遗传、代谢、应对胁迫等方面造成影响,是植物特定生理状态的反映[17]。因此,研究和开发植物内生真菌,对于解决植物的生长发育、代谢物积累、生态演替等具有重要意义,是认识和解决植物生长发育难题的新途径。
植物遗传多样性的检测包括了表型、细胞、染色体和DNA分子等技术,而最为精确和活跃的领域当属DNA分子生态检测[18],比如限制性片段长度多态性(Restriction fragment length polymorphism, RFLP),随机扩增多态性DNA(Random amplified polymorphic DNA, RAPD)、数目可变串联重复多态性(Variable Number of Tandem Repeats, VNTR)等[18]。而ISSR是一种最为新型的分子标记手段之一,是以简单重复序列(Simple Sequence Repeats,SSR)为基础,SSR存在于所有真核生物基因组中,均由1~4个碱基对组成,又称之为微卫星,如(GA)n、(AC)n、(GAA)n的DNA,同一类微卫星DNA可分布在整个基因组不同位置上,由于其重复次数不同或重复程度不相同而形成每个座位的多态性。对它们的检测实现对植物遗传多样性的检测,具有灵敏、快速、准确、高效等优点[19]。
研究表明,采用ISSR技术能够高效、准确的检测红景天DNA的遗传关系[13]。本课题组采用该技术对我国野生大花红景天、库叶红景天、长白红景天等遗传关系进行了研究, 11条ISSR引物共扩增出102条条带,多态性百分比达到100%,因此,是一种灵敏、高效、可靠的DNA分子检测技术[20]。本研究采用ISSR技术首次开展内生真菌ZPRa-R-1接种大花红景天的DNA分子标记分析,所选引物平均扩增出7.83条条带,明确的观察到DNA遗传物质在不同样品中的变化,能很好地检测和分析内生真菌对宿主植物的影响。随着ZPRa-R-1的侵入,大花红景天遗传性状发生规律变化,即随着试验时间的延长,ZPRa-R-1接种的红景天与内生真菌之间的亲缘关系逐步变近,而与非真菌影响的红景天的遗传关系则越来越远;其中,第5天和11天分别发生了较大亲缘关系的跃迁,这标示着两个物种互作过程中存在着遗传物质的互作关系;当然,这对于内生真菌与宿主之间DNA具体的互作和变化,还需要对特定基因进行定位和检测。总之,本研究不仅为下一步的工作提供了基础和方向,也深刻验证了内生真菌ZPRa-R-1作为生物因素可以对大花红景天遗传性状造成影响,为内生真菌ZPRa-R-1的应用和大花红景天品质改良提供依据。
[1] Petrini O,Sieber T N,Toti L,etal.Ecology,Metabolite Production,and Substrate Utilization in Endophytic Fungi[J].NaturalToxins,1993,1(3):185-196.DOI:10.1002/nt.2620010306.
[2] Kaul S,Sharma T,Dhar M K.“Omics” Tools for Better Understanding the Plant-endophyte Interactions[J].Frontierinplantscience,2016,7:955.DOI:10.3389/fpls.2016.00955.DOI:10.3389/fpls.2016.00955.
[3] Wani Z A,Ashraf N,Mohiuddin T,etal.Plant-endophyte Symbiosis,an Ecological Perspecitive[J].AppliedMicrobiologyandBiotechnology,2015,99(7):2955-2965.DOI:10.1007/S00253-015-6487-3.
[4] Agler M T,Ruhe J,Kroll S,etal.Microbial Hub Taxa Link Host and Abiotic Factors to Plant Microbiome Variation[J].PLoSBiology,2016,14(1):e1002352.DOI:10.1371/journal.pbio.1002352.
[5] 崔晋龙,郭顺星,肖培根.内生菌与植物的互作关系及对药用植物的影响[J].药学学报,2017.(accepted).
[6] Samsir S A,Bunawan H,Yen C C,etal.Dataset of SSR Markers for ISSR-Suppression-PCR to Detect Genetic Variation inGarciniaMangostanaL. in Peninsular Malaysia[J].DataBrief,2016,8:1438-1442.DOI:10.1016/j.dib.2016.08.016.eCollection2016.
[7] Shafiei-Astani B. Ong A H,Valdiani A,etal.Molecular Genetic Variation and Structure of Southeast Asian Crocodile (Tomistomaschlegelii):Comparative Potentials of SSRs Versus ISSRs[J].Gene,571(1):107-116.DOI:10.1016/j.gene.2015.06.053.
[8] Anjali N,Ganga K M,Nadiya F,etal.Intraspecific Variations in Cardamom (ElettariacardamomumMaton):Assessment of Genomic Diversity by Flow Cytometry,Cytological Studies and ISSR Analysis[J].Springerplus,2016,5(1):1560-1571.DOI:10.1186/S40064-016-3226-X.[9] 王梦亮,焦晋,邢婕,等.内生真菌ZPRa-R-1对红景天中关键信号分子及主要次生代谢产物的影响[J].植物研究,2016,36(3):416-420.
[10] CUI Jinlong,GUO Tingting,REN Zhenxing,etal.Diversity and Antioxidant Activity of Culturable Endophytic Fungi from Alpine Plants ofRhodiolacrenulata,R.angusta, andR.sachalinensis[J].Plosone,2015,10(3):e0118204.DOI:10.1371/journal. pone.0118204.
[11] 王梦亮,张娜莎,郭婷,等.植物生长物质对大花红景天愈伤组织诱导及苗再生的影响[J].植物生理学报,2014,50(2):192-196.
[12] Huanca M W,Rivera C D,Maita M J.A Simple,Fast,and Inexpensive CTAB-PVP-silica based Method for Genomic DNA Isolation from Single,Small Insect Larvae and Pupae[J].GeneticsandMolecularResearch,2015,14(3):8001-8007.DOI:10.4238/2015.July.17.8.
[13] 雷一东.大花红景天的ISSR遗传多样性与精油化学成分多样性研究[D].上海:复旦大学,2004.
[14] Rohlf F J.NTSYS-pc,Numerical Taxonomy and Multivariate Analysis System[M].Version 2.2. New York:Applied Biostatistics Inc. 2009:1-43.
[15] Yeh F C,Boyle T J B.Population Genetic Analysis of Co-dominant and Dominant Markers and Quantitative Traits[J].BelgianJournalofBotany,1997,129:157-163.DOI:10.1186/S12870-016-0743-2.
[16] Stierle A,Strobel G,Stierle D.Taxol and Taxane Production by Taxomyces Andreanae,An Endophytic Fungus of Pacific yew[J].Science,1993,260:214-216.DOI:10.1126/science.8097061.
[17] Wani Z A,Ashraf N,Mohiuddin T,etal.Plant-endophyte Symbiosis,an Ecological Perspective[J].AppliedMicrobiologyandBiotechnology,2015,99:2955-2965.DOI:10.1007/S00253-015-6487-3.
[18] 张征峰,肖本泽.基于生物信息学与生物技术开发植物分子标记的研究进展[J].分子植物育种,2009,7(1):130-136.
[19] Rodrigues S M,Moura E F,Ramos G K,etal.Genetic Variability Analysis ofByrsonimacrassifoliagermplasm Collected in ParState using ISSR Markers[J].GeneticsandMolecularResearch,2016,15(4).DOI:10.4238/gmr15048887.
[20] 王梦亮,任晓琳,崔晋龙,等.野生红景天的RAPD和ISSR遗传多样性分析[J].中草药,2016,47(3):469-473.
ISSR Analysis ofRhodiolaCrenulataInoculated with Endophytic Fungus ZPRa-R-1
CUI Jinlong1,REN Xiaolin1,2,WANG Mengliang1*
(1.InstituteofAppliedChemistry,ShanxiUniversity,Taiyuan030006,China;2.Instituteofbiotechnology,ShanxiUniversity,Taiyuan030006,China)
The marker method of inter-simple sequence repeat (ISSR) was used to investigate genetic character ofRhodiolacrenulatainoculated with the endophytic fungus ZPRa-R-1 in 15 days. The results showed that a total of 94 bands were amplified by 12 ISSR primers. Among them, 82 bands were belonged to polymorphic bands, and the percentage of polymorphism band was 87.23% inR.crenulatainoculated with ZPRa-R-1. 7.83 bands were the average amplifying number with one primer. The lengths of amplified fragments were between 100~8 000 bp. Nei’s genetic distance and genetic consistency were 0.123~1.285 2 and 0.276 6~0.884 0, respectively. The gene flow was 0.138 8 amongR.crenulatainoculated with ZPRa-R-1,R.crenulataculture seelding and ZPRa-R-1, and the value was less than one which showed that genetic traits ofRhodiolaplant could be affected deeply by this endophytic fungus. The results of clustering analysis indicated thatR.crenulatainoculated with the fungus ZPRa-R-1 was dirided into three genetic branches. The first class includedR.crenulataculture seedling and its culture inoculated with ZPRa-R-1 in 1~10 days. The second class includedR.crenulataculture seedling inoculated with ZPRa-R-1 in 11~15 days. The third class is only included by ZPRa-R-1. The genetic similarity ofR.crenulatainoculated with ZPRa-R-1 would become more and more similar in 15 days test cycle. The results of this research showed that ZPRa-R-1 can affect the genetic traits ofR.crenulata.
endophytic fungi;inter-simple sequence repeat;Rhodiolacrenulata;genetic trait
10.13451/j.cnki.shanxi.univ(nat.sci.).2017.01.025
2016-10-08;
2016-11-29
国家自然科学基金(31270383;31670328);山西省自然科学基金(2014011029-1)
崔晋龙(1976-),男,博士,副教授,主要从事珍稀药用植物活性成分调控药用植物及药用真菌资源开发研究,E-mail:CJL717@ 163.com;
*通信作者:王梦亮(WANG Mengliang),E-mail:mlwang@sxu.edu.cn
O75
A
0253-2395(2017)01-0155-05

