基于1H NMR代谢组学技术探究GRP78蛋白对巨噬细胞极化的干预效应
张立超,李爱平,剌晓琴,李卓玉*
(1.山西大学 生物技术研究所,化学生物学与分子工程教育部重点实验室,太原 030006;2.山西大学 中医药现代研究中心重点实验室,山西 太原 030006)
基于1H NMR代谢组学技术探究GRP78蛋白对巨噬细胞极化的干预效应
张立超1,李爱平2,剌晓琴1,李卓玉1*
(1.山西大学 生物技术研究所,化学生物学与分子工程教育部重点实验室,太原 030006;2.山西大学 中医药现代研究中心重点实验室,山西 太原 030006)
巨噬细胞是肿瘤组织中一类十分重要的免疫细胞,它的M2型极化与肿瘤的恶化密切相关。GRP78蛋白作为肿瘤晚期的生物标志物,可以通过影响肿瘤微环境来促进肿瘤恶化,但GRP78对肿瘤组织中巨噬细胞的分化是否具有干预作用依然未知。本研究利用体外纯化的GRP78蛋白来模拟肿瘤细胞分泌的GRP78,用其处理鼠源巨噬细胞RAW264.7,然后通过1H NMR技术的代谢组学方法发现经GRP78处理后细胞中有18种代谢产物,培养基中有14种代谢产物的含量发生了明显变化。通过进一步的代谢通路分析,发现在GRP78蛋白处理后,RAW264.7细胞的糖酵解代谢明显减弱,而脂肪酸和氨基酸代谢加强,这与M2型巨噬细胞的代谢类型一致,表明经GRP78处理后,RAW264.7巨噬细胞向M2型分化。这一发现表明肿瘤微环境中GRP78的存在是肿瘤相关巨噬细胞以M2型为主的重要原因,这也为靶向GRP78的肿瘤治疗提供了坚实的理论依据。
1H NMR;代谢组学;GRP78;巨噬细胞;分化
EngineeringofNationalMinistryofEducation,ShanxiUniversity,Taiyuan030006,China;2.ModernResearchCenterforTraditionalChineseMedicineandShanxiUniversity,Taiyuan030006,China)
实体肿瘤中巨噬细胞是一类很重要的免疫细胞,在肿瘤组织中其所占比重很大[1]。在肿瘤的发生阶段,肿瘤浸润的巨噬细胞以M1型为主,其主要通过糖酵解为自身提供能量,发挥抑制肿瘤生长的作用[2]。随着肿瘤的发展,在晚期肿瘤组织中,M2型巨噬细胞占据主导地位,通过脂肪酸代谢为自身提供大量能量,从而便于分泌各种细胞因子帮助肿瘤细胞抵抗外界不良环境,并协助肿瘤细胞转移[3]。虽然针对M1和M2型巨噬细胞的功能研究已有较多报道[4-6],但是针对不同类型巨噬细胞在肿瘤不同发展阶段的转变机制一直是该领域的研究热点。
分子量为78kD的葡萄糖调节蛋白(GRP78)属于热休克蛋白HSP70家族中的成员[7],在正常细胞中其主要定位于内质网中,发挥分子伴侣的作用[8]。在肿瘤细胞中,尤其是晚期肿瘤中,GRP78的表达量明显升高,并且其定位和功能发生了多样性变化[9]。有研究表明,晚期肿瘤细胞可以将GRP78分泌到细胞外,从而改变肿瘤微环境,有利于肿瘤的生长和转移[10-12]。晚期肿瘤细胞分泌的GRP78是否会影响肿瘤微环境中巨噬细胞的分化,又是通过怎样的途径产生影响的呢?这些都是亟待回答的问题。
代谢组学技术能够快速鉴定生物体系的代谢物,评估生物体发生的微妙变化,并鉴定与生理病理变化相关的潜在生物标志物[13]。与LC-MS和GC-MS相比,氢核磁共振波谱法(1H NMR)因具有样本制备简单无损,检测无偏向性,方法重现性好等优点而被广泛应用[14]。本研究基于1H NMR技术的代谢组学方法, 利用体外纯化的GRP78蛋白来模拟肿瘤细胞分泌的GRP78,对其处理过的巨噬细胞及其相应的培养基中代谢物进行分析, 从代谢的角度阐明GRP78对巨噬细胞极化的干预效应。
1 材料与方法
1.1 仪器与试剂
Bruker 600-MHz AVANCE III NMR Spectrometer(600.13 MHz质子频率,德国布鲁克公司600兆核磁仪),TGL-16高速台式冷冻离心机。
胎牛血清(FBS,浙江天杭生物科技有限公司,中国);DMEM培养基(Gibco,USA);分析纯甲醇,双蒸水;重水(Norell,Landisville,USA),三甲基硅烷丙酸钠盐(TSP,Cambridge Isotope Laboratories Inc.,MA)。
1.2 细胞培养
鼠源巨噬细胞RAW264.7培养于37℃,体积分数为5%CO2,恒温恒湿的条件下。所用培养基为含有体积分数为10%胎牛血清的DMEM。
1.3 GRP78蛋白表达与纯化
GRP78蛋白表达与纯化的具体步骤见文献[12]。
1.4 核磁备样
RAW264.7细胞培养于75 cm2培养瓶中,当细胞长至~70%时,在实验组(n=3)细胞中加入终浓度为1 μmol·L-1的GRP78蛋白,对照组(n=3)细胞中加入相同体积的磷酸盐缓冲液(PBS),继续培养72 h后,分别收集细胞和培养液。培养液置于50 mL的尖底离心管中,300 g离心15 min,收集上层清液,并于液氮中速冻,-80℃保存。利用细胞刮收集细胞后,300 g离心5 min后,PBS洗涤细胞沉淀2次,离心后将沉淀于液氮中速冻,-80℃保存。
细胞和培养液的提取方法参照已报道方法[15]并加以改进,取2 mL培养液于5 mL EP中进行冻干;通过多次冻融和超声波破碎裂解细胞,即冻融细胞5次后,加入800 μL甲醇水溶液(甲醇/水∶2/1,V/V),于冰上超声破碎15 min(超声3 s,停7 s),4℃ 13 000 g离心20 min,收集上层清液,并向沉淀中添加1 mL甲醇水溶液,重复以上步骤,收集两次上清液于5 mL EP管中冷冻干燥。
向细胞和培养液提取物冻干粉中加入600 μL重水配制的PBS(pH 7.4),其中分别含有体积分数为0.005% 和0.02% TSP,4℃ 13 000 g离心20 min,取上清于5 mm NMR管中进行测试。
1.5 核磁测试条件
所有谱图的测试在25℃于Bruker 600 MHz Avance Ⅲ NMR谱仪上完成。测试序列为Noesygppr1d,弛豫延迟3.0 s,谱宽12 626.3 Hz,扫描次数为64次。采用氘代重水锁场,内标为TSP。
1.6 数据处理
核磁图谱采用MestReNova(version 10.0.1, Mestrelab Research,Santiago de Compostella,Spain)进行处理。所有核磁图谱需手动定标,并进行相位和基线校准,以δ0.01积分段为基准对化学位移的区间进行分段积分。其中细胞图谱中残余水峰δ4.76~5.8和培养液中δ4.72~5.06不进行积分,将积分数据面积归一化后导入excel中,以便于后续分析。
将上述数据矩阵导入SIMCA-P 13.0(Umetrics,Umea,Sweden)软件中进行主成分分析(PCA),再用偏最小二乘法判别分析(PLS-DA)排列实验(permutation)进行模型验证,结合正交偏最小二乘法判别分析(OPLS-DA)S-plot和VIP (>1)寻找差异代谢物。对找到的差异代谢产物相对峰面积进行t检验,以期找出差异显著的代谢物。最后,将差异代谢物数据导入代谢组学分析网站(http:∥www.Metaboanalyst.ca),采用Pathway Analysis功能模块进行通路分析。
2 结果
2.1 核磁图谱指认
通过核磁峰型、化学位移及化学耦合常数等核磁数据分析,结合标准品和文献数据[15-16]对照,共指认了40种化合物,具体信息见表1。图1为典型的细胞和培养基提取物的NMR指纹谱,鉴定的化合物包括氨基酸、有机酸、糖类等。直观分析发现,细胞处理前后,化学成分差异较大,而培养基中成分差异较小。

表1 细胞和培养基中代谢物指认表

续表1 细胞和培养基中代谢物指认表

Fig.1 Typical 1H NMR spectra of extracts of cell and medium.Cell (A), medium (B).图1 典型的细胞和培养基提取物的NMR指纹谱。细胞(A);培养基(B)
2.2 多元统计分析
为阐明细胞和培养基处理前后的化学差异,进一步采用多元统计分析方法对其进行分析。PCA分析是目前常用的分析方法,它通过降低维度的技术把具有某些相关性的技术指标转化为几个具有综合意义的指标的一种无监督的模式识别方法,它能体现数据的最初状态[17]。图2A为RAW264.7细胞经GRP78处理前后的PCA得分散点图(PC1:0.885;PC2:0.04)显示二者可以明显区分。有监督的PLS-DA排列实验(permutation test)用于判别建立模型的有效性,在排列实验中,回归线的斜率越大,随机化的R2、Q2差别越小,即原始模型的预测能力大于任何一次随机排列y变量的预测能力,说明模型可靠,可以继续后面差异成分的寻找,该分析结果(图2B)显示模型稳定,预测率高(R2X=0.949,Q2=0.998)。考虑到干扰因素的复杂性,为进一步消除非GRP78蛋白作用的影响,使组间分离最大化,并寻找两组间差异明显的代谢物,利用OPLS-DA(图2C)方法去除与样品的分类不相关的信息,对不同的样本代谢全谱进行分析,CV-ANOVA分析显示,p=0.0026<0.05进一步说明模型有效可靠,二者差异具有统计学意义。结合S-plot(图2D)和VIP分析,结果见表2。

表2 GRP78处理后细胞中的差异代谢产物的变化趋势(p<0.05)
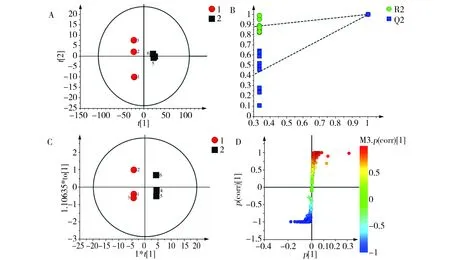
Fig.2 PCA score plot (A), the PLS-DA permutation test (B), the corresponding OPLS-DA score plot (C)and S-plot (D) derived from the 1H NMR spectra from the GRP78 treated cells and the control图2 细胞处理前后的PCA散点图(A),排列实验(B),OPLS-DA散点图(C),S-plot(D)
以相同的方法处理培养基数据矩阵,由PC1(0.748)和PC2(0.166)为坐标轴构建的PCA得分散点图(图3A)可以看出,培养基对照组与处理组样本能够明显分开,说明GRP78处理对培养基的代谢物有影响。PLS-DA(图3B)模型验证显示模型有效可靠。图3C为对照组和处理组培养基的OPLS-DA得分图(R2=0.998,Q2=0.992,p=0.0116<0.05),二者同样具有明显差异。对应的S-plot图(图3D)和VIP值进行分析,结果见表3。
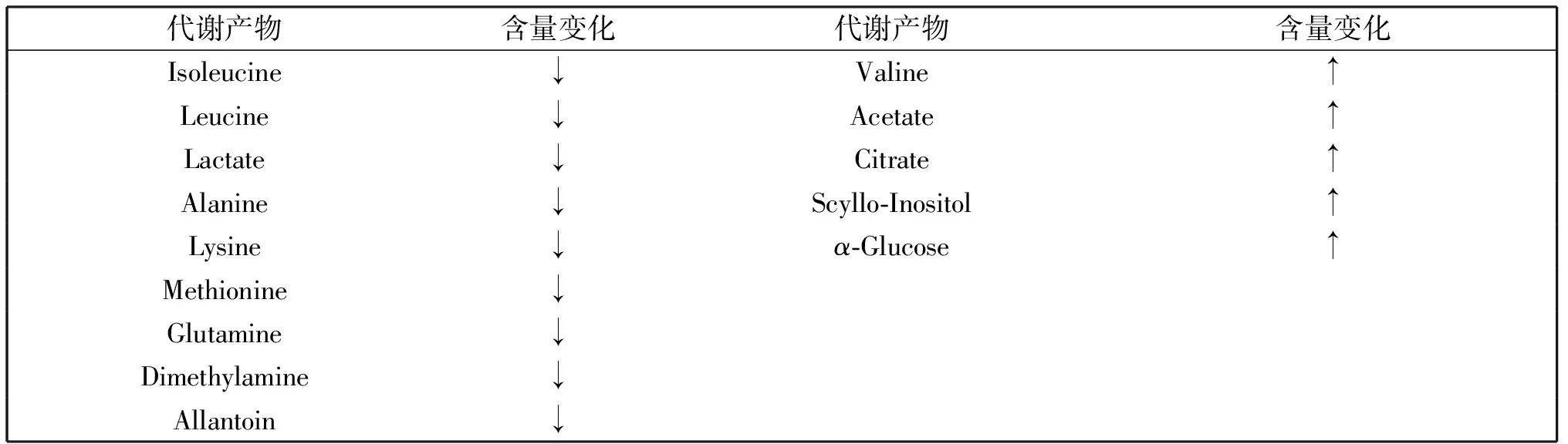
表3 GRP78处理后培养基中的差异代谢产物(p<0.05)

Fig.3 PCA score plot (A), the PLS-DA permutation test (B), the corresponding OPLS-DA score plot (C)and S-plot (D) derived from the 1H NMR spectra from the GRP78 treated medium and the control图3 培养基处理前后的PCA散点图(A),排列实验(B),OPLS-DA散点图(C),S-plot(D)
2.3 代谢通路分析
为探讨以上差异代谢物涉及的代谢途径,采用专业的代谢组学数据分析网站metaboAnalyst 3.0功能模块Pathway Analysis对其进行数据库比对分析,归纳这些代谢物所在的生物网络,并可以自动筛选出影响最大的代谢通径。将细胞中找到的18个具有显著差异的代谢物导入相关模块,结果如图4A所示,横坐标Pathway impact 表示由拓扑分析所得到的代谢通径对本研究的重要性值,纵坐标-log(P)表示代谢通路的富集分析。图中圆点越大,颜色越深,表明该通径影响越大,即该圆点离中心的距离越远。本研究将代谢通径影响值设置为 0.10,当代谢通路影响值高于这个值,即被视为潜在的靶标代谢路径。结果显示细胞处理后代谢物的变化主要涉及缬氨酸、亮氨酸和异亮氨酸代谢,牛磺酸和亚牛磺酸代谢,丙酮酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,糖酵解和糖异生,脂类代谢等。以相同的方法分析与细胞处理前后培养基中差异代谢物密切相关的代谢途径,如图4B所示,这些代谢物主要涉及缬氨酸、亮氨酸和异亮氨酸代谢,牛磺酸和亚牛磺酸代谢,二羧酸代谢以及丙氨酸、天冬氨酸和谷氨酸代谢等。总结以上这些通路分别与葡萄糖代谢、脂肪酸代谢以及氨基酸代谢紧密相关。

1.Valine, leucine and isoleucine biosynthesis, 2.Taurine and hypotaurine metabolism, 3.Pyruvate metabolism,4.Glycine, serine and threonine metabolism, 5.Glycolysis or Gluconeogenesis, 6.Glycerophospholipid metabolism.1’. Valine, leucine and isoleucine biosynthesis, 2’.Glyoxylate and dicarboxylate metabolism, 3’.Alanine, aspartate and glutamate metabolism.Fig.4 Summary diagram of pathway analysis with MetPA Cell(A),medium(B)1.缬氨酸、亮氨酸和异亮氨酸生物合成;2.牛磺酸和亚牛磺酸代谢;3.丙酮酸代谢;4.甘氨酸、丝氨酸和苏氨酸代谢;5.糖酵解和糖异生;6.脂类代谢;1’.缬氨酸、亮氨酸和异亮氨酸生物合成;2’.二羧酸代谢;3’.丙氨酸、天冬氨酸和谷氨酸代谢图4 GRP78处理后细胞和培养基中差异代谢物涉及的代谢通路分析 细胞(A),培养基(B)
3 讨论
巨噬细胞是先天性免疫系统的重要组成部分,拥有很高的“可塑性”,并且不同类型巨噬细胞所拥有的代谢途径完全与其功能相匹配[18]。在机体受到微生物感染和发生炎症的情况下,巨噬细胞的M1表型首先被激活,为了适应感染部位的缺氧环境,M1型巨噬细胞主要通过糖酵解代谢为自身提供能量。当病原体被彻底清除后,巨噬细胞又活化为M2型,其异常活跃的脂肪酸代谢为完成受损组织的修复和血管的再生提供了充足的能量[19]。所以通过代谢组学技术检测经GRP78蛋白处理后巨噬细胞的主要代谢途径,可以比较全面的揭示巨噬细胞的分化类型。
葡萄糖是机体的主要能量来源,通过多步反应,葡萄糖分解为丙酮酸;如果处在缺氧条件下,则丙酮酸经由糖酵解途径转化为乳酸,这一过程是M1型巨噬细胞获取能量的主要途径[20]。本研究发现处理组糖酵解代谢的主要产物——乳酸的含量显著降低,表明经GRP78处理后RAW264.7细胞中糖酵解代谢减弱。这一现象说明经GRP78蛋白处理后,RAW264.7细胞的代谢类型与M1型巨噬细胞相反。另外,在处理组的培养基中有较多的乳酸存在,从另一方面表明经GRP78处理后的RAW264.7细胞对乳酸的偏好性较差,所以将其大量排出细胞。
M2型巨噬细胞在帮助受损组织修复和血管生成的过程中需要消耗大量能量,而脂肪酸的氧化恰好可以满足细胞的这一需求[21]。本研究中经GRP78处理的RAW264.7细胞中发现有大量的脂肪酸代谢中间产物(lipid-CH2),提示这些细胞中脂肪酸代谢旺盛。另外,GRP78处理后细胞和培养基中的支链氨基酸大量减少(如缬氨酸、异亮氨酸),这些氨基酸可能通过转氨作用脱掉α-氨基,进入三羧酸循环。甘氨酸能够转化为胍基乙酸,后者可与甲硫氨酸反应生成肌酸。据报道甘氨酸和肌酸是重要的储能物质[22]。本研究中甘氨酸和甲硫氨酸含量降低说明GRP78处理后细胞中储能物质被消耗,这些现象表明GRP78处理后的巨噬细胞正在进行大量的耗能过程,而这些现象恰好与M2型巨噬细胞的代谢表型相吻合。
4 结论
本研究通过核磁代谢组学技术,发现模拟肿瘤细胞分泌型的GRP78蛋白可以减缓巨噬细胞的糖酵解代谢,促进巨噬细胞中脂肪酸和支链氨基酸的代谢,表明经GRP78处理后巨噬细胞在进行大量的耗能过程。这一系列现象都提示GRP78可以诱导巨噬细胞RAW264.7向M2型分化,而M2型巨噬细胞是肿瘤恶化的重要推动者,这表明GRP78的存在是肿瘤组织中巨噬细胞向M2型分化的重要原因。
[1] CONDEELIS J,POLLARD J W.Macrophages:Obligate Partners for Tumor Cell Migration,Invasion,and Metastasis[J].Cell,2006,124(2):263-6.DOI:10.1016/j.cell.2006.01.007.
[2] HAO N B,LU M H,FAN Y H,etal.Macrophages in Tumor Microenvironments and the Progression of Tumors[J].ClinDevImmunol,2012,2012(948098.DOI:10.1155/2012/948098.
[3] GORDON S,MARTINEZ F O.Alternative Activation of Macrophages:Mechanism and Functions[J].Immunity,2010,32(5):593-604.DOI:10.1016/j.immuni.2010.05.007.
[4] GENIN M,CLEMENT F,FATTACCIOLI A,etal.M1 and M2 Macrophages Derived From THP-1 Cells Differentially Modulate the Response of Cancer Cells to Etoposide[J].BMCCancer,2015,15(577.doi:10.1186/s12885-015-1546-9.
[5] DING L,LIANG G,YAO Z,etal.Metformin Prevents Cancer Metastasis by Inhibiting M2-like Polarization of Tumor Associated Macrophages[J].Oncotarget,2015,6(34):36441-55.DOI:10.18632/oncotarget.5541.
[6] EDIN S,WIKBERG M L,DAHLIN A M,etal.The Distribution of Macrophages with a M1 or M2 Phenotype in Relation to Prognosis and the Molecular Characteristics of Colorectal Cancer[J].PloSone,2012,7(10):e47045.DOI:10.1371/journal.pone.0047045.
[7] LI Z,LI Z.Glucose Regulated Protein 78:a Critical Link Between Tumor Microenvironment and Cancer Hallmarks[J].BiochimicaetBiophysicaActa,2012,1826(1):13-22.DOI:10.1016/j.bbcan.2012.02.001.
[8] PFAFFENBACH K T,LEE A S.The Critical Role of GRP78 in Physiologic and Pathologic Stress[J].CurrOpinCellBiol,2011,23(2):150-6.DOI:10.1016/j.ceb.2010.09.007.
[9] NI M,ZHANG Y,LEE A S.Beyond the Endoplasmic Reticulum:Atypical GRP78 in Cell Viability,Signalling and Therapeutic Targeting[J].BiochemicalJournal,2011,434(2):181-8.doi:10.1042/bj20101569.
[10] PENG Y,LI Z,LI Z.GRP78 Secreted by Tumor Cells Stimulates Differentiation of Bone Marrow Mesenchymal Stem Cells to Cancer-associated Fibroblasts[J].BiochemicalandBiophysicalResearchCommunications,2013,440(4):558-63.DOI:10.1016/j.bbrc.2013.09.108.
[11] KERN J,UNTERGASSER G,ZENZMAIER C,etal.GRP-78 Secreted by Tumor Cells Blocks the Antiangiogenic Activity of Bortezomib[J].Blood,2009,114(18):3960-7.DOI:10.1182/blood-2009-03-209668.
[12] FU R,YANG P,WU H-L,etal.GRP78 Secreted by Colon Cancer Cells Facilitates Cell Proliferation via PI3K/Akt Signaling[J].AsianPacificJournalofCancerPrevention,2014,15(17):7245-9.DOI:10.7314/apjcp.2014.15.17.7245.
[13] BOLLARD M E,STANLEY E G,LINDON J C,etal.NMR-based Metabonomic Approaches for Evaluating Physiological Influences on Biofluid Composition[J].NMRinBiomedicine,2005,18(3):143-62.DOI:10.1002/nbm.935.
[14] LI A P,LI Z Y,SUN H F,etal.Comparison of Two Different Astragali Radix by a (1)H NMR-Based Metabolomic Approach[J].JProteomeRes,2015,14(5):2005-16.DOI:10.1021/pr501167u.
[15] LI H,ZHU W,ZHANG L,etal.The Metabolic Responses to Hepatitis B Virus Infection Shed New Light on Pathogenesis and Targets for Treatment[J].ScientificReports,2015,5(8421.DOI:10.1038/srep08421.
[16] DUARTE I F,MARQUES J,LADEIRINHA A F,etal.Analytical Approaches Toward Successful Human Cell Metabolome Studies by NMR Spectroscopy[J].AnalyticalChemistry,2009,81(12):5023-32.DOI:10.1021/ac900545q.
[17] LI Y,JU L,HOU Z,etal.Screening,Verification,and Optimization of Biomarkers for Early Prediction of Cardiotoxicity Based on Metabolomics [J].JProteomeRes,2015,14(6):2437-45.DOI:10.1021/pr501116c.
[18] BISWAS S K,MANTOVANI A.Orchestration of Metabolism by Macrophages[J].CellMetabolism,2012,15(4):432-7.DOI:10.1016/j.cmet.2011.11.013.
[19] CAIRO G,RECALCATI S,MANTOVANI A,etal.Iron Trafficking and Metabolism in Macrophages:Contribution to the Polarized Phenotype[J].TrendsinImmunology,2011,32(6):241-7.DOI:10.1016/j.it.2011.03.007.
[20] IZQUIERDO E,CUEVAS V D,FERNANDEZ-ARROYO S,etal.Reshaping of Human Macrophage Polarization through Modulation of Glucose Catabolic Pathways[J].JournalofImmunology,2015,195(5):2442-51.DOI:10.4049/jimmunol.1403045.
[21] NOMURA M,LIU J,ROVIRA,II,etal.Fatty Acid Oxidation in Macrophage Polarization[J].NatureImmunology,2016,17(3):216-7.DOI:10.1038/ni.3366.
[22] VAN MILGEN J.Modeling Biochemical Aspects of Energy Metabolism in Mammals[J].JournalofNutrition,2002,132(10):3195-202.
Investigation of the Intervention of GRP78 on Macrophage using1H NMR-based Metabolomics
ZHANG Lichao1,LI Aiping2,LA Xiaoqin1,LI Zhuoyu1*
(1.InstituteofBiotechnology,KeyLaboratoryofChemicalBiologyandMolecular
Macrophage is one of important immunocytes in tumor, and the M2 macrophage is closely related with tumor progression. GRP78, as a biomarker of advanced tumor, can switch tumor microenvironment to facilitate tumor progression, however, whether GRP78 can affect the macrophage polarization is still unknown.The recombinant GRP78 that mimics the tumor cell secreted-GRP78 was applied to incubate with RAW 264.7 cell, then we found 18 metabolites in cell and 14 metabolites in medium,which were different with the control using1H NMR-based metabolomics. Through further analysis of metabolic pathway, we found the glycolysis decreased significantly in RAW264.7 with GRP78 treatment while fatty acid and amino acid metabolism increased, which was in accordance with the metabolic type of M2 macrophage, implying that the RAW264.7 polarized into M2 type after GRP78 treatment. This study suggested that the tumor cell-secreted GRP78 may be primarily responsible for the M2 polarization of tumor-associated macrophages, and it also provides a solid theoretical basis for GRP78-targeted oncotherapy.
1H NMR;metabolomics;GRP78;macrophage;polarization

山西大学学报(自然科学版)40(1):169-174,2017JournalofShanxiUniversity(Nat.Sci.Ed.)
10.13451/j.cnki.shanxi.univ(nat.sci.).2017.01.026
2016-10-06;
2016-11-25
山西省平台项目(2015091015);山西省留学基金(2015-7)
张立超(1988-),男,山西大同人,博士研究生,研究方向:肿瘤分子生物学。
*通信作者:李卓玉(LI Zhuoyu),E-mail:lzy@sxu.edu.cn
Q7
A
0253-2395(2017)01-0160-09

