抗原致敏DC与CIK共培养体外抗小细胞肺癌的研究
杨佳,冯阳春,黄艳春
(新疆医科大学附属肿瘤医院 检验科,新疆 乌鲁木齐 830011)
·论 著·
抗原致敏DC与CIK共培养体外抗小细胞肺癌的研究
杨佳,冯阳春,黄艳春
(新疆医科大学附属肿瘤医院 检验科,新疆 乌鲁木齐 830011)
目的:观察小细胞肺癌NCI- H209细胞株抗原致敏树突细胞(DC)与同源细胞因子诱导杀伤(CIK)细胞共培养后的DC- CIK细胞体外对小细胞肺癌NCI- H209的杀伤活性,为小细胞肺癌的特异性细胞免疫治疗提供实验依据。方法:将健康成人外周血单个核细胞来源的DC经NCI- H209细胞株抗原致敏后与同源CIK细胞共培养,实验分3组:NCI- H209抗原致敏DC与CIK共培养组(A组)、未致敏DC与CIK共培养组(B组)和单纯CIK组(C组)。流式细胞仪检测DC及CIK免疫表型,使用CCK- 8法检测3组效应细胞对NCI- H209细胞的杀伤活性。结果:体外诱导培养出的抗原致敏DC和未致敏DC经流式检测,均高表达CD80、CD86、CD11c。CIK细胞随着培养天数的延长主要效应细胞CD3+CD8+、CD3+CD56+表达持续升高,至第14天流式检测结果示:A组和B组CD3+CD8+表型分别为71.8%和65.2%,C组CD3+CD56+达到31.1%。CCK- 8法检测结果发现,相同效靶比下A组对NCI- H209细胞株的杀伤活性明显高于B、C组,且随着效靶比增加,其杀伤效应亦显著增加。效靶比为5∶1时A组杀伤率为(68.82±2.55)%,B组杀伤率为(56.64±2.06)%,C组杀伤率为(55.98±2.63)%(P=0.007);效靶比为10∶1时A组杀伤率为(74.06±2.64)%,B组杀伤率为(60.11±2.74)%,C组杀伤率为(58.34±1.88)%(P=0.005);效靶比为20∶1时A组杀伤率为(79.17±3.51)%,B组杀伤率为(65.33±2.48)%,C组杀伤率为(60.47±2.85)%,(P=0.001)。结论:用NCI- H209细胞裂解物分离的混合蛋白致敏DC可以提高CIK细胞杀伤NCI- H209细胞效应,为小细胞肺癌的综合治疗提供新的策略。
小细胞肺癌; 树突状细胞- 细胞因子诱导杀伤细胞; 过继性细胞免疫治疗
小细胞肺癌是人类常见的恶性实体瘤之一,多数患者确诊时已发生转移,中位总生存期仅8~11个月,5年生存率不足5%[1- 3]。虽然一线化疗后可得暂时缓解,但大多数患者短期内出现复发,复发后放、化疗效果均不理想。传统的治疗手段并未使患者获得进一步的生存受益,小细胞肺癌的治疗已处于瓶颈,迫切需要新的治疗策略来提高疗效[4- 5]。
近几年来,过继性细胞免疫治疗日益受到关注且发展前景广为业界看好,特别是特异性细胞免疫治疗因其强大的抗肿瘤作用和明显的疗效已成为国际研究的热点,但目前针对小细胞肺癌的特异性细胞免疫治疗尚未见报道。由于绝大多数小细胞肺癌患者因没有手术机会而无法得到大量自身肿瘤组织作为抗原,因此,本研究尝试采用小细胞肺癌株NCI- H209细胞裂解物作为抗原致敏树突细胞(DC),再与同源细胞因子诱导杀伤(CIK)细胞共培养,通过体外实验证实致敏后的DC- CIK细胞对小细胞肺癌的杀伤作用,为小细胞肺癌特异性细胞免疫治疗提供实验室依据。
1 材料与方法
1.1 材料
X- VIVO15无血清培养基购自LONZA公司,重组人细胞因子(rhGM- CSF、rhIL- 4、rhTNF- α、rhIL- 1α)购自Peprotech公司,胎牛血清购自美国Hyclon公司,rhIL-2购自北京四环生物制药有限公司,anti- CD3McAb购自德国miltenyiBiotec公司,IFN- γ购自上海凯茂生物医药有限公司,人外周血淋巴细胞分离液购自天津市灏洋生物制品科技有限公司,鼠抗人CD3- FITC、CD8- PE、CD56- PE、CD80- PE、CD86- FITC、CD- 11c- FITC均购自美国Beckman公司,CCK- 8试剂盒购自日本同仁化学研究所,外周血单个核细胞(PBMC)分离自健康志愿者外周血,NCI- H209细胞株和A549细胞株源自美国ATCC。
1.2 方法
1.2.1 实验分组 将效应细胞分为3组:A组为NCI- H209细胞裂解物分离的混合蛋白致敏的DC与CIK细胞共培养,B组为未经致敏的DC与CIK细胞共培养,C组为单纯CIK。
1.2.2 NCI- H209细胞裂解物分离的混合蛋白抗原的制备 参考刘畅等[6]提取抗原的方法,将小细胞肺癌NCI- H209细胞株在含10%胎牛血清的RPMI- 1640中常规培养传代,消化收集1×107个NCI- H209细胞,生理盐水洗涤2遍,加入1 ml单纯RPMI- 1640放入液氮中,10 min后迅速取出放入37 ℃水浴中,待其完全融化后再次放入液氮中,反复3次。离心除去细胞碎片,微孔滤膜过滤,收集滤液于4 ℃保存备用。
1.2.3 DC的诱导培养 取健康成人外周血30 ml经淋巴细胞分离液密度梯度分离得到PBMC,用X- VIVO15无血清培养基重悬细胞并平均分至2个25 cm2培养瓶中,37 ℃、5%CO2培养箱静置4 h后收集非贴壁细胞(用于CIK细胞培养),贴壁细胞加入含rhGM- CSF 1×106U·L-1、rhIL- 45×105U·L-1的X- VIVO15无血清培养基。隔天半量换液、补充细胞因子,第7天每瓶加入rhTNF- α 100 μg·L-1(2×106U·L-1),倒置相差显微镜及电镜观察细胞的形态。
1.2.4 CIK细胞的培养扩增 收集步骤1的非贴壁细胞,调整密度为(3~5)×106ml-1,悬于含IFN- γ 1 000 U·ml-1的X- VIVO15无血清培养基中,放置37 ℃、5% CO2培养箱中培养。第2天加入细胞因子rhIL- 1α 1 ng·ml-1、anti- CD3McAb 100 ng·ml-1和rhIL- 2 1 000 U·ml-1。根据细胞生长情况适时补充培养基。
1.2.5 小细胞肺癌抗原致敏DC DC诱导培养的第6天加入肿瘤冻融抗原100 μl,混匀,继续于37 ℃、5%CO2培养箱培养,第7天常规加入rhTNF- α 2×106U·L-1,第8天收获成熟的DC。
1.2.6 DC与CIK细胞共培养 培养第8天,收集NCI- H209细胞冻融抗原致敏过的DC、未致敏的DC、CIK,分别计数,按DC∶CIK=1∶50~100比例将DC按实验分组分别与CIK细胞混合共培养,培养液为含rhIL- 2 1 000U·ml-1的X-VIVO15无血清培养基,观察DC与CIK细胞共培养后的增殖情况。
1.2.7 免疫表型的检测 流式细胞仪检测DC(第0、8天)的免疫表型CD80、CD86、及CD11c。检测CIK细胞(第0、14天)的免疫表型CD3、CD4、CD8、CD56。步骤:收获DC及CIK细胞,PBS洗涤重悬,调密度为2×109L-1,取细胞悬液50μl加入Ep管内,加入FITC标记的上述鼠抗人单抗,混匀,4 ℃避光孵育30min,PBS洗涤2次,PBS重悬,流式细胞术检测,分析软件为Cellquse。
1.2.8 杀伤活性的检测 以CCK- 8比色法检测3组不同的效应细胞对靶细胞的杀伤活性,靶细胞分别为NCI-H209细胞(小细胞肺癌细胞)、A549细胞(肺腺癌细胞)。将靶细胞浓度调整至5×105个·ml-1后接种于96孔培养板中,每孔加入靶细胞100μl(5×104个细胞·孔-1),实验孔按效靶比分别为5∶1、10∶1、20 ∶1加入效应细胞,同时设效应细胞对照孔,相同条件设5个复孔,37 ℃、5%CO2条件下混合培养24h,然后向每孔加入10μlCCK- 8溶液,将培养板在培养箱内孵育4h,酶标仪在450nm波长下读取各孔吸光度值。杀伤活性(%)=[1- (实验孔OD值- 效应细胞对照组OD值)/靶细胞对照组OD值]×100%
1.3 统计学处理
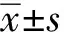
2 结 果
2.1 细胞形态观察
DC:从外周血分离的PBMC在培养瓶中静置4 h 后镜下见贴壁细胞为体积较小的单个圆形细胞,经rhGM- CSF、rhIL- 4诱导后可见部分细胞体积不断增大,且形态不规则。第7天加入rhTNF- α诱导成熟后大部分细胞半悬浮,表面出现树突状突起,呈典型DC形态。致敏DC和未致敏DC经流式细胞术检测,结果显示均高表达CD80、DC86、CD11c。见表1、图1。

表1 第8天两组DC流式细胞术检测结果 %

图1 Ag- DC高表达CD80、CD86、CD11c
CIK细胞:未贴壁PBMC经IFN- γ、anti- CD3 McAb、IL- 1α、rhIL- 2诱导至第3天细胞开始聚集成团,细胞体积增大、形态不规则、胞体透亮,似葡萄串,随着细胞培养天数的延长细胞数量急剧增加,细胞团越来越大,主要效应细胞CD3+CD8+、CD3+CD56+表达持续升高,至第14天3组细胞数量均超过3×109个,台盼蓝染色检测细胞活率都在98%以上。流式细胞术检测结果示:A组和B组CD3+CD8+表型分别为71.8%和65.2%,C组CD3+CD56+达到31.1%。见表2,图2、3。

表2 第14天各组细胞流式细胞术检测结果 %
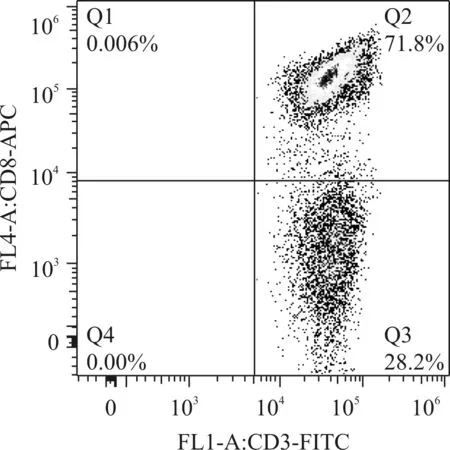
图2 Ag- DC- CIK高表达CD3+CD8+

图3 CIK高表达CD3+CD56+
2.2 对NCI- H209细胞杀伤活力的体外测定
3组效应细胞都在培养至第14天时进行了对NCI- H209细胞杀伤作用的检测,另外作为对照的A组还对A549细胞进行杀伤作用检测。结果显示,各组效应细胞都随着效靶比的增高杀伤力增强,A组效应细胞在不同效靶比时较B组和C组效应细胞都具有较强的杀伤能力,B组效应细胞在效靶比达到20∶1时杀伤作用较CIK细胞明显增强(65.33±2.48vs60.47±2.85,P<0.05),差异具有统计学意义。当抗原致敏DC- CIK效应细胞杀伤A549细胞时,杀伤作用一般,仅效靶比达到20∶1时作用较C组明显增强,与B组表现出相似的杀伤作用。见表3。
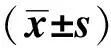
表3 各组细胞杀伤活性比较%
a 与CIKvsNCI- H209组比,P<0.05; b 与DC- CIKvsNCI- H209组比,P<0.05
3 结 论
近年来肿瘤免疫治疗取得显著的进步,其中对DC瘤苗和CIK细胞的研究最为常见。DC作为机体内专职的抗原提呈细胞,在摄取、提呈抗原及激发后续特异性抗肿瘤免疫反应中发挥着不可替代的作用。在DC处理提呈抗原过程中,其表面分子CD80、CD86、HLA- DR的表达水平又起到重要的制约作用,直接关系到DC免疫激发的功能状态。其中CD80、CD86作为DC激活T淋巴细胞过程中的重要共刺激分子作用尤为重要,其表达水平标志着DC免疫激活能力的高低[7- 8]。
CIK细胞主要通过NKG2D受体途径发挥溶解细胞效应,清除肿瘤患者残存的肿瘤细胞或肿瘤微病灶,可有效防止复发,是治疗晚期恶性肿瘤又一重要选择[9- 12]。DC负载自体肿瘤抗原后可诱导产生特异性CIK细胞,发挥特异性抗肿瘤免疫效应,目前在治疗肾癌、卵巢癌、肺腺癌等临床试验中均取得了较好的疗效[13-15]。
负载特异性抗原的DC疫苗结合过继细胞治疗在科研和临床的应用具有巨大的潜力和良好的效果,但是小细胞肺癌没有区别于正常组织的肿瘤特异性蛋白作为肿瘤抗原,并且绝大多数小细胞肺癌患者因没有手术机会而无法得到大量的自身肿瘤组织来制备全细胞肿瘤抗原。因此,本实验采用小细胞肺癌株NCI- H209的细胞裂解物分离出的混合蛋白用来致敏DC,同时将抗原致敏的DC与同源的CIK细胞共培养,在体外的细胞毒性实验中验证致敏DC- CIK细胞对NCI- H209的特异性应答和杀伤NCI- H209能力。应用流式细胞仪测定免疫细胞表型的结果可以看出,随着培养时间的增长具有杀伤活性的CD3+CD8+、CD3+CD56+免疫细胞明显增加,且A组和B组的CD3+CD8+细胞占比较高,而C组CD3+CD56+免疫细胞占比较高,这可能与DC释放IL- 2、IFN- γ、IL- 12等多种细胞因子促进了CD3+CD8+细胞的增殖有关。体外杀伤试验结果在5∶1~20∶1的效靶比范围内A、B、C3组效应细胞对NCI-H209均有杀伤作用,这种杀伤作用随效靶比的增高而增强,而且A组杀伤率高于B、C组,证实用NCI-H209细胞裂解物分离的混合蛋白致敏DC可以提高CIK细胞的杀瘤效应。
本研究初步探索了一种更为有效的治疗小细胞肺癌的体细胞免疫治疗方法,所获得的抗原致敏DC-CIK细胞具有较强的抗肿瘤特异性和杀伤作用,为小细胞肺癌的综合治疗提供了新的策略。
[1]KRISTJANSENPE,HANSENHH.Managementofsmallcelllungcancer:asummaryoftheThirdInternationalAssociationfortheStudyofLungCancerWorkshoponSmallCellLungCancer[J].NatlCancerInst,1990,82(4):263- 266.
[2]MOSSAC,JACOBSONGM,WALKERLE,etal.SCG3transcriptinperipheralbloodisaprognosticbiomarkerforREST-deficientsmallcelllungcancer[J].ClinCancerRes,2009,15(1):274- 283.
[3]PEDERSENN,MORTENSENS,SORENSENSB,etal.Transcriptionalgeneexpressionprofilingofsmallcelllungcancercells[J].CancerRes,2003,63(8):1943- 1953.
[4]CLARKR,IHDEDC.Small-celllungcancer:treatmentprogressandprospects[J].Oncology(WillistonPark),1998,12(5):647- 658.
[5]HURWITZJL,MCCOYF,SCULLINP,etal.Newadvancesinthesecond-linetreatmentofsmallcelllungcancer[J].Oncologis,2009,14(10):986- 994.
[6] 刘畅,王士勇,焦雪,等.抗原致敏的DC-CIK对前列腺癌细胞DU145杀伤的作用[J].解剖科学进展,2012,3:222- 226.
[7]HOWARDCJ,HOPEJC,STEPHENSSA,etal.Co-stimulationandmod-ulationoftheensuingimmuneresponse[J].VetImmunolImmunopathol,2002,87(3- 4):123- 130.
[8]ASHIKAGAT,HOYAM,ITAGAKIH,etal.EvaluationofCD86expressionandMHCclassⅡmoleculeinternalizationinTHP- 1humanmonocytecellsaspredictiveendpointsforcontactsensitizers[J].ToxicolInVitro,2002,16(6):711- 716.
[9] YUANYING Y,LIZHI N,FENG M,et al.Therapeutic outcomes of combining cryotherapy,chemotherapy and DC- CIK immunotherapy in the treatment of metastatic non- small cell lung cancer[J].Cryobiology,2013,67(2):235- 240.
[10] RAJBHANDARY S,ZHAO M F,ZHAO N,et al.Multiple cytotoxic factors involved in IL- 21 enhanced antitumor function of CIK cells signaled through STAT- 3 and STAT5b pathways[J].Asian Pac J Cancer Prev,2013,14(10):5825- 5831.
[11] YANG B,WANG J,CAI L L,et al.Treatment of multiple solitary plasmacytomas with cytokine- induced killer cells[J].Cytotherapy,2014,16(2):278- 284.
[12] 李曼,孙载阳,陈宝安.细胞因子诱导的杀伤细胞的研究进展[J].现代医学,2004,32(2):132- 135.
[13] ZHAN H L,GAO X,PU X Y,et al.A randomized controlled trial of postoperative tumor lysate- pulsed dendritic cells and cytokine- induced killer cells immunotherapy in patients with localized and locally advanced renal cell carcinoma[J].Chin Med J(Engl),2012,125(21):3771- 3777.
[14] KANDALAFT L E,CHIANG C L,TANYI J,et al.A Phase Ⅰ vaccine trial using dendritic cells pulsed with autologous oxidized lysate for recurrent ovarian cancer[J].J Transl Med,2013,11:149.
[15] 杨佳,顾国民,王秀丽,等.自体肿瘤抗原致敏DC- CIK联合化疗治疗晚期肺腺癌的疗效[J].中国肿瘤生物治疗杂志,2016(1):83- 88.
(本文编辑:周兰波)
Study on the co- culture of DC and CIKinvitroagainst small cell lung cancer
YANG Jia,FENG Yang- chun,HUANG Yan- chun
(DepartmentofClinicalLaboratory,theAffiliatedTumorHospitalofXinjiangMedicalUniversity,Urumqi830011,China)
Objective: To observe the dendritic cells(DC)- homologous cytokine induced killer(CIK) cellsinvitrokilling activity of small cell lung cancer NCI- H209 after the co- culture of the sensitized DC by the small cell lung cancer NCI- H209 cells antigen and CIK cells, provide the experimental basis for the treatment of small cell lung cancer of specific cellular immunity. Methods: The DC cells from healthy adult human peripheral blood mononuclear cells were sensitized by NCI- H209 cell line and co- cultured with CIK cells, the effector cells were divided into three groups: the sensitized DC by NCI- H209 antigen and CIK cells co- culture group(group A), the unsensitized DC and CIK cells co- culture group(group B), simple CIK group(group C). DC and CIK cells were detected by flow cytometry, and the cytotoxicity of three groups of effector cells to NCI- H209 cells was detected by CCK- 8 assay. Results:Invitroculture of antigen- sensitized DC and unsensitized DC were detected by flow cytometry, high expressions of CD80, CD86, CD11c were found. CIK cells with prolongation of culture days, CD3+CD8+, CD3+CD56+expressions of the main effector cells remained elevated, on the 14th day flow detection showed that CD3+CD8+phenotypes in the group A and group B were 71.8% and 65.2%, CD3+CD56+in the group C was 31.1%. By CCK- 8 method, the results showed that group A was significantly higher than that of the group B and group C, and the killing effect of the group A was also significantly increased with the increase of the target ratio. When the effect target ratio was 5∶1,thekillingratewas(68.82±2.55)%inthegroupA, (56.64±2.06)%inthegroupB, (55.98±2.63)%inthegroupC(P=0.007); when the effect target ratio was 10∶1,thekillingratewas(74.06±2.64)%inthegroupA, (60.11±2.74)%inthegroupB, (58.34±1.88)%inthegroupC(P=0.005); when the effect target ratio was 20∶1,thekillingrateinthegroupAwas(79.17±3.51) %, (65.33±2.48)%inthegroupB, (60.47±2.85)%inthegroupC(P=0.001). Conclusion: The sensitized DC by NCI- H209 can improve the killing effect of CIK cells, and provide a new strategy for the comprehensive treatment of small cell lung cancer.
small cell lung caner; dendritic cells- cytokine induced killer cells; adoptive cellular immunotherapy
2016- 09- 19
2016- 12- 09
新疆医科大学科研创新基金资助项目(No. XYDCX201485)
杨佳(1982-),女,新疆乌鲁木齐人,主治医师,医学硕士。E- mail:16558290@qq.com
黄艳春 E- mail:huangyanchun0619@sohu.com
杨佳,冯阳春,黄艳春.抗原致敏DC与CIK共培养体外抗小细胞肺癌的研究[J].东南大学学报:医学版,2017,36(2):225- 229.
R- 33; R734.2
A
1671- 6264(2017)02- 0225- 05
10.3969/j.issn.1671- 6264.2017.02.019

