离子液体合成锂离子电池纳米二氧化钛负极材料*
李炳辉,龚显年,苏 静,龙云飞,文衍宣
(广西大学化学化工学院,广西南宁530004)
电池材料
离子液体合成锂离子电池纳米二氧化钛负极材料*
李炳辉,龚显年,苏 静,龙云飞,文衍宣
(广西大学化学化工学院,广西南宁530004)
在尿素-氯化胆碱离子液体体系中制备锂离子电池纳米二氧化钛负极材料。采用X射线衍射XRD、扫描电镜SEM、比表面BET分析、恒流充放电技术和交流阻抗EIS测试技术对样品结构、形貌和电化学性能进行表征,结果表明所制备的材料具有良好的电化学性能:80℃时合成的样品颗粒最小,具有最大的表面积(52.1 m2/g),是孔径为11.6 nm的锐钛矿型二氧化钛,该材料在0.5C倍率下首次放电比容量为213.8 mA·h/g,50次循环后容量保持率为89%。
尿素-氯化胆碱;TiO2;锂离子电池;负极
随着高能便携电源和动力电池的需求激增,对锂离子电池性能的要求也不断提高。负极材料是锂离子电池的重要组成部分,其性能好坏直接影响锂离子电池的使用寿命[1]。目前商业化的负极材料主要是碳基材料,但其自身也还存在一定缺陷,如生成SEI膜降低循环寿命、当电池过充时碳电极表面可能会形成锂枝晶造成短路[2]。TiO2作为锂离子电池负极材料,在嵌锂和脱锂过程中体积膨胀小(3%),放电平台在1.7 V左右,而且具有原料丰富、绿色环保的优点[3]。
但是,由于TiO2的电子导电率和Li+扩散系数较低,导致其倍率性能差,并未得到广泛应用。纳米化是提高TiO2电化学性能的有效方法之一[4]。S.W. Oh等[5]用水热法制备了粒径为 22 nm的 TiO2,在0.4mA/cm2电流密度下循环100次容量为170mA·h/g。S.Casino等[6]使用不同表面活性剂通过溶胶-凝胶法合成多孔纳米TiO2,采用C16TAB制备的样品倍率性能最好,在0.2、1、5、10C倍率下的容量分别为145、122、84、67 mA·h/g。Y.J.Li等[7]用溶剂热法合成了多孔TiO2纳米片,在1C(1C=168 mA·h/g)倍率下首次放电比容量为210 mA·h/g,50次循环后容量保持在151 mA·h/g。X.M.Yang等[8]用[bmin][BF4]离子液体为溶剂,在180℃水热反应 24 h合成了由晶面(100)和 (001)包围的TiO2立方块,高度暴露的(100)和(001)晶面有利于Li+的扩散,在0.5C电流密度下循环100次容量保持在200 mA·h/g左右,在0.2、0.5、1、2C倍率下容量分别为246、201、144、96 mA·h/g,表现出良好的循环和倍率性能。
然而,目前纳米TiO2的制备方法大多需要用到有毒的有机溶剂,能耗大且反应难控制,不利于大量生产。2003年,A.P.Abbott等[9]首先将尿素(熔点133℃)和氯化胆碱(熔点302℃)按一定的物质的量比混合形成了一种熔点只有12℃的功能化离子液体。它制备方法简单,原料成本低,适合工业生产;且对水不敏感,易于保存,无毒,绿色环保。更重要的是该离子液体拥有大量氢键,反应时能吸附在晶核面,阻止颗粒之间团聚;较大的黏度能阻碍物质的扩散,阻止晶体进一步生长,有效减小颗粒粒度[10]。基于上述优点,尿素-氯化胆碱在催化、有机合成、溶解、分离和电化学等很多领域中有着广阔的应用前景[11]。Q.Q.Xiong等[12]用尿素-氯化胆碱离子液体一步法合成纺锤状纳米Fe2O3,在200 mA/g电流密度下充放电循环50次后容量为921.7 mA·h/g。但是关于用尿素-氯化胆碱合成TiO2作为锂离子负极材料的文献还没有报道。
本文采用尿素-氯化胆碱离子液体水解钛酸四丁酯制备了纳米TiO2负极材料。讨论了反应温度对纳米TiO2制备的影响,并利用XRD、SEM、BET、CV等测试手段表征纳米TiO2晶体结构、形貌和电化学性能。
1 实验部分
1.1 尿素-氯化胆碱离子液体的制备
尿素-氯化胆碱离子液体的制备参照文献[9]方法,将氯化胆碱和尿素(物质的量比为1∶2)混合加热到80℃,搅拌为无色透明液体后再保持1 h。标记为UC,装好放在干燥器中备用。
1.2 纳米TiO2的制备
分别取15 mL UC、15 mL H2O、5 mL冰乙酸于三口烧瓶中混合搅拌30 min成为均匀溶液,将10 mL钛酸四丁酯(TBOT)缓慢滴加到烧瓶中,升温到一定温度(70、80、90、100℃)反应4 h得到白色产物,然后产物用去离子水过滤洗涤几遍后冷冻干燥得到TiO2前驱体,最后把前驱体放入马弗炉中500℃焙烧3 h得到纳米TiO2产品。
1.3 纳米TiO2的物性表征
采用X′Pert PRO型X射线衍射仪对样品进行物相分析,测试条件:Cu Kα辐射,40 kV,100 mA,扫描范围(2θ)为10~80°;采用S-4800型场发射高分辨率扫描电子显微镜对样品形貌和颗粒分布进行观察;采用V-Sorb X800比表面测试仪对材料进行比表面及孔径分析。
1.4 纳米TiO2的电化学性能测试
将活性物质纳米TiO2粉末、super P和PVDF按质量比为8∶1∶1在溶剂NMP中混合均匀,然后均匀涂布在集流体铜箔上,120℃真空干燥12 h,最后裁剪为直径14 mm的负极片。以纳米TiO2为正极,Celgard 2400聚丙烯为隔膜,1.0 mol/L LiPF6/[EC+ DMC+EMC(体积比为1∶1∶1)]溶液为电解液,金属锂为负极,在氩气气氛的手套箱中装配成R2032型扣式电池。采用CT-3008型电池测试仪进行充放电测试,测试电流为0.5C(1C=335 mA·h/g),电压范围为1~3 V,测试温度为25℃。采用Interface 1000电化学工作站进行交流阻抗测试(频率为10-2~105Hz)。
2 结果与讨论
图1是不同温度下 (a、b、c、d分别代表70、80、90、100℃)合成纳米TiO2的XRD图。从图1可以看出,在衍射角2θ为25.31、37.79、48.04、53.88、55.07、62.69、75.05°处有明显的衍射峰,其衍射峰的位置与标准卡片PDF78-2486号锐钛矿TiO2的位置一致,没有杂质峰。说明合成的样品为纯相锐钛矿型TiO2。
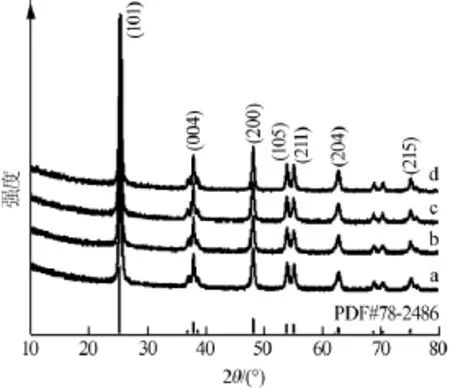
图1 不同温度下合成纳米TiO2的XRD图
图2是不同温度下合成纳米TiO2的SEM图。

图2 不同温度合成纳米TiO2的SEM图
从图2看到,合成材料的颗粒粒径在纳米尺寸范围内,且颗粒之间留有大量相互连通的孔道,反应温度为70℃(图2a)时,颗粒生长不完整,交联在一起;随着反应温度的升高,颗粒粒径先减小后增大,当温度达到100℃(图2d)时,颗粒之间出现了明显的团聚现象。反应温度为80℃(图2b)时,颗粒生长完整,分散均匀,颗粒大小为20~30 nm。所合成的纳米TiO2较小的粒径有助于锂离子的扩散,增大反应活性;颗粒之间存在大量的孔道和间隙,增大了材料的表面积,这有利于材料与电解液充分接触,从而提高样品的电化学性能[6]。
图3为80℃下合成材料的氮气吸/脱附等温曲线及其孔径分布图。从图3可以看出,氮吸附曲线为Ⅳ型而且有明显的回滞环,说明材料中存在大量的孔道结构。采用BJH方程计算得到80℃条件下合成的材料孔径为11.6 nm,对应的表面积为52.1 m2/g。结合SEM图可知,80℃合成的材料比表面积大且颗粒小,有利于电极与电解液的接触和缩短Li+的扩散距离;随着温度升高,颗粒增大并出现团聚,导致表面积减小,不利于电解液渗透和电子传递,电池容量降低[13]。
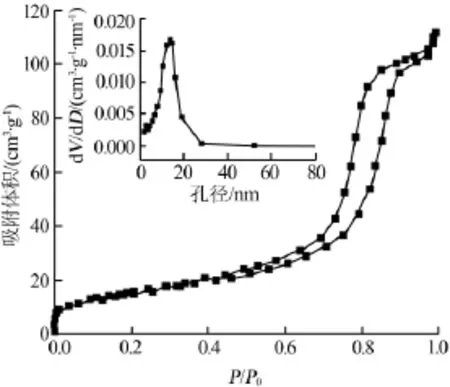
图3 80℃下合成纳米TiO2的氮气吸/脱附等温曲线及其孔径分布
图4是不同温度下合成的TiO2样品在0.5C下的循环性能图。70、80、90、100℃条件下所合成材料的可逆放电比容量分别为 82.3、193.2、187.9、176.3 mA·h/g。循环50圈后放电比容量为81.2、171.9、155.6、101.4 mA·h/g,容量保持率分别为98.7%、89.0%、82.8%、57.5%。与X.X.Fu等[14]合成的层状 TiO2首次容量为 307.3 mA·h/g,1C(1C= 168 mA·h/g)循环50次后保持170 mA·h/g相比性能差不多。比Y.Li等[15]制备的TiO2纳米片0.1C循环90次时的比容量171.9 mA·h/g好。较P.G.Zhang等[16]合成空心多孔TiO2在0.6C(1C=168 mA·h/g)倍率下循环150次的比容量167.4 mA·h/g高。与上述近两年文献报道的纳米TiO2负极材料性能相比较,说明用尿素-氯化胆碱合成纳米TiO2负极材料的方法是可行的,所合成材料具有较高的容量和良好的循环稳定性。
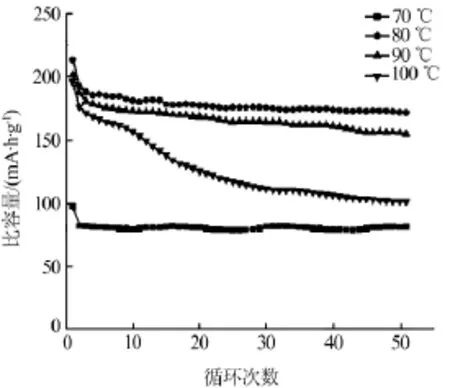
图4 不同温度合成纳米TiO2的循环性能
图5是80℃下合成材料的电化学性能图。随着电流增大,材料放电比容量下降,电压平台缩短。表明电流增大造成电极极化增加。从倍率性能图得知,电流密度在0.5、1、2、5、10C倍率下的放电比容量分别为187.8、168.9、144.3、112.9、89.3mA·h/g,当电流恢复至0.5C时,放电比容量为180.2 mA·h/g,说明所制备的材料具有较好的可逆性和倍率性能。
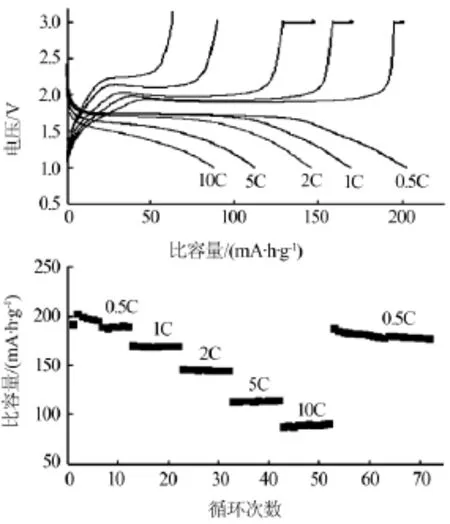
图5 80℃下合成纳米TiO2的电化学性能
图6是不同温度下合成纳米TiO2样品的EIS图。样品的交流阻抗曲线都是由高频区的半圆和低频区的斜线组成。Re代表接触电阻,Rct和CPE1代表电荷转移阻抗和双电层电容,低频区直线ZW代表warburg阻抗,CPE2代表微分电容。从图6看出,随着温度升高,样品的电荷转移阻抗先减小后增大,合成温度在80℃时材料的电荷转移阻抗最小,Rct为67.5 Ω,扩散系数为1.05×10-13cm2/s。上述结果表明,正是由于80℃下制备的纳米多孔颗粒最小且比表面最大,Li+在TiO2中扩散遇到的阻力小,有利于Li+的嵌入和脱出。这与图4循环性能结果一致。
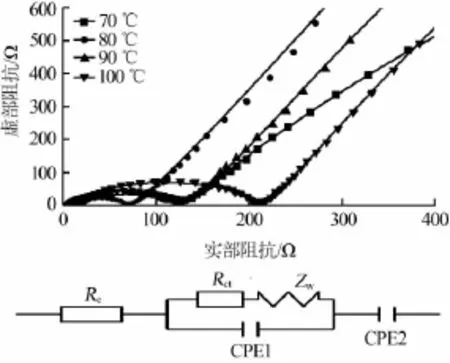
图6 不同温度下合成样品的交流阻抗和等效电路图
3 总结
首次采用尿素-氯化胆碱离子液体水解钛酸四丁酯制备了锐钛矿型纳米TiO2负极材料。在80℃条件下合成的样品颗粒最小,且颗粒之间留有大量相互连通的孔道,比表面积为52.1 m2/g,介孔孔径为11.6 nm。电化学性能测试表明,所制备的纳米TiO2负极在0.5C倍率下首次放电比容量为213.8 mA·h/g,50次循环后容量保持率为89%,5C倍率的容量也达到112.9 mA·h/g,具有较高的比容量,较好的循环性能和倍率性能。纳米TiO2负极材料的这种纳米/微米复合结构可提供更大的反应活性面积,以及更短的离子、分子迁移扩散通道,有利于Li+的嵌入和脱出。
[1] Goriparti S,Miele E,De Angelis F,et al.Review on recent progress of nanostructured anode materials for Li-ion batteries[J].Journal of Power Sources,2014,257:421-443.
[2] 汪倩雯,杜显锋,陈夕子,等.锂离子电池TiO2纳米管负极材料[J].物理化学学报,2015,31(8):1437-1451.
[3] 张玉玺,张晓丽,郑洪河.锂离子电池负极材料TiO2的研究进展[J].电池,2009,39(2):106-109.
[4] Su X,Wu Q L,Zhan X,et al.Advanced titania nanostructures and composites for lithium ion battery[J].Journal of Materials Science,2012,47:2519-2534.
[5] Oh S W,Park S H,Sun Y K.Hydrothermal synthesis of nano-sized anatase TiO2powders for lithium secondary anode materials[J]. Journal of Power Sources,2006,161(2):1314-1318.
[6] Casino S,Di Lupo F,Francia C,et al.Surfactant-assisted sol gel preparation of high-surface area mesoporous TiO2nanocrystalline Liion battery anodes[J].Journal of Alloys and Compounds,2014,594:114-121.
[7] Li Y J,Yan X,Yan W F,et al.Hierarchical tubular structure constructed by mesoporous TiO2nanosheets:Controlled synthesis and applications in photocatalysis and lithium ion batteries[J].Chemical Engineering Journal,2013,232:356-363.
[8] Yang X M,Yang Y C,Hou H S,et al.Size-tunable single-crystalline anatase TiO2cubes as anode materials for lithium ion batteries[J]. The Journal of Physical Chemistry,2015,119(8):1-23.
[9] Abbott A P,Capper G,Davies D L,et al.Novel solvent properties of cholinechloride/ureamixtures[J].ChemicalCommunications,2003,9(1):70-71.
[10] 叶萌,王又容,程四清.新型离子液体中纳米α-Fe2O3的合成及研究[J].武汉工业学院学报,2010,29(3):24-28.
[11] Smith E L,Abbott A P,Ryder K S.Deep eutectic solvents(DESs)and their applications[J].Chemical Reviews,2014,114(21):11060-11082.
[12] Xiong Q Q,Tu J P,Ge X,et al.One-step synthesis of hematite nanospindles from choline chloride/urea deep eutectic solvent with highly powerful storage versus lithium[J].Journal of Power Sources,2015,274:1-7.
[13] Rai A K,Anh L T,Gim J,et al.Simple synthesis and particle size effects of TiO2nanoparticle anodes for rechargeable lithium ion batteries[J].Electrochimica Acta,2013,90:112-118.
[14] Fu X X,Wang B B,Ren Z M,et al.Controllable synthesis of TiO2hierarchical nanostructures and their applications in lithium ion batteries[J].RSC Advances,2014,4:42772-42778.
[15] Li Y,Han X B,Liang J C,et al.Preparation of TiO2nanoflakes and their influence on lithium ion battery storage performance[J].Chemical Research in Chinese Universities,2015,31(3):332-336.
[16] Zhang P G,Zhang C Y,Xie A J,et al.Novel template-free synthesis of hollow@porous TiO2superior anode materials for lithium ion battery[J].JournalofMaterialsScience,2016,51(7):3448-3453.
Synthesis of nano-sized TiO2lithium ion battery anode material by ionic liquid
Li Binghui,Gong Xiannian,Su Jing,Long Yunfei,Wen Yanxuan
(School of Chemistry and Chemical Engineering,Guangxi University,Nanning 530004,China)
Nano-sized TiO2anode material had been prepared by using urea-choline chloride ionic liquid.The structure,morphology,and electrochemical performance of the prepared samples had been characterized by X-ray diffraction(XRD),scanning electron microscopy(SEM),Brunauer-Emmett-Teller(BET)analysis,electrochemical impedance spectra(EIS),and galvanostatic charge/discharge testing.Results showed that the anatase TiO2that prepared at 80℃had a minimum particle size,maximum surface area of 52.1 m2/g,and pore size of 11.6 nm.The prepared TiO2delivered an initial discharge capacity of about 213.8 mA·h/g and its capacity retention was about 89%after 50 cycles at 0.5C.
urea-choline chloride;TiO2;lithium ion battery;anode
TQ134.11
A
1006-4990(2017)01-0066-04
2016-07-29
李炳辉(1989— ),男,硕士,研究方向为锂离子电池材料。
文衍宣
国家自然科学基金(51564002)。
联系方式:wenyanxuan@vip.163.com

