不同熏蒸剂杀灭无土栽培基质中尖孢镰刀菌的效果评价
余宏军 吕雅悠 李 强 艾 爽 李兵娟 蒋卫杰
(中国农业科学院蔬菜花卉研究所,北京100081)
不同熏蒸剂杀灭无土栽培基质中尖孢镰刀菌的效果评价
余宏军 吕雅悠 李 强 艾 爽 李兵娟 蒋卫杰*
(中国农业科学院蔬菜花卉研究所,北京100081)
通过人工接种尖孢镰刀菌于无土栽培基质,采用稀释涂抹平板法测定基质中尖孢镰刀菌的数量变化,研究威百亩、棉隆、氰氨化钙、甲醛、1,3-二氯丙烯、二甲基二硫和甲基碘7种熏蒸剂不同浓度处理及作用时间对无土栽培基质中尖孢镰刀菌的作用效果。结果表明:7种熏蒸剂均可以显著降低基质中尖孢镰刀菌的数量。其中,120 mg·L-142%威百亩和300 mg·L-198%棉隆熏蒸5 d对尖孢镰刀菌的灭杀率达100.00%;40%甲醛稀释50倍、800 mg·L-1氰氨化钙、400 mg·L-1二甲基二硫、150 mg·L-11,3-二氯丙烯和300 mg·L-1甲基碘熏蒸8 d对尖孢镰刀菌的灭杀率分别达99.07%、98.71%、96.57%、94.86%和85.00%。由此得出,威百亩和棉隆对无土栽培基质中尖孢镰刀菌的灭杀效果最显著,且熏蒸时间短,其次为甲醛与氰氨化钙。
熏蒸剂;无土栽培基质;尖孢镰刀菌;灭杀率
尖孢镰刀菌(Fusarium oxysporum)是一种世界性分布的典型的土传病原真菌(史怀 等,2006;朱育菁 等,2007),能导致100多种植物发生枯萎病(申卫收 等,2008;肖荣凤 等,2008),中国各栽培区均有发生且呈蔓延趋势(安星辰 等,2014)。目前,世界范围内已报道的被尖孢镰刀菌严重为害的经济作物有棉花、甘蔗、香蕉、番茄、黄瓜、节瓜、冬瓜、西瓜、南瓜、西葫芦、甜瓜、丝瓜、越瓜、苦瓜、瓠瓜、哈密瓜、四季豆、豇豆等(林抗美 等,2006;台莲梅 等,2006)。
无土栽培基质经过长时间使用后病菌会增多,使后茬蔬菜产生病害,因此基质在重复使用前必须进行消毒处理,解决无土栽培基质连作障碍等问题。据统计,世界上90%的无土栽培是采用无土基质栽培形式,我国约有80%采用基质栽培,且比例逐渐上升,所以基质消毒技术的研究具有很大应用空间和前景(陈伟武 等,2013)。化学熏蒸消毒是目前主要使用且最为经济高效的措施(杨晓楠 等,2011),其中溴甲烷熏蒸效果最佳(卜东欣 等,2014),但根据相关国际公约,发达国家于2005年、发展中国家于2015年全面禁止使用溴甲烷(Banks,2002;Qiao et al.,2011)。目前关于溴甲烷替代技术已经登记注册的药品有1,3-二氯丙烯(Wang et al.,2006;Qiao et al.,2010)、氯化苦(Covarelli et al.,2010)、甲基碘(Backer et al.,1998)、氰氨化钙(Shi et al.,2009)、威百亩和棉隆(Giannakou & Karpouzas,2003)及其混配使用,但其在基质消毒方面并没有明确的研究。
为此,本试验选择了威百亩、棉隆、氰氨化钙、甲醛、1,3-二氯丙烯、二甲基二硫和甲基碘7种熏蒸剂进行试验,比较以上药剂对基质中尖孢镰刀菌的作用效果,以期为不同熏蒸剂在蔬菜无土栽培上防治土传病害及大面积推广应用提供理论依据。
1 材料与方法
人工接种尖孢镰刀菌及熏蒸剂处理试验于2016年7月在中国农业科学院蔬菜花卉研究所玻璃温室中进行,基质中尖孢镰刀菌数量的检测在实验室内进行。
1.1 试验材料
1.1.1 供试材料 供试菌株为西瓜枯萎病病原菌尖孢镰刀菌菌株(本所201实验室4 ℃冰箱保存)。供试基质为有机栽培基质,由山东商道生物科技有限公司提供。供试药剂为42%威百亩水剂(辽宁沈阳丰收农药公司);92% 1,3-二氯丙烯(1,3-D)原药(上海阿拉丁生化科技股份有限公司);98%棉隆微粒剂(南通施壮化工有限公司);98%二甲基二硫(DMDS)原药(北京翰隆达科技发展有限公司);99.5%甲基碘原药(萨恩化学技术有限公司);氰氨化钙(石灰氮,氮≥19.5%)颗粒剂(上海百舜生物科技有限公司);40%甲醛溶液(北京博艾远上生物科技有限公司)。
1.1.2 供试培养基 马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL;马铃薯葡萄糖(PD)培养基:马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL;尖孢镰刀菌选择性培养基:马铃薯200 g,CuSO4·5H2O 0.5 g,MgSO4·7H2O 0.6 g,KH2PO40.1 g, 敌 克松结晶粉(75%)3 g,硫酸链霉素0.75 g,95%酒精10 mL,琼脂20 g,蒸馏水1 000 mL,pH值5.8。
1.2 试验方法
1.2.1 尖孢镰刀菌孢子悬浮液的配制 尖孢镰刀菌在PDA培养基上培养6~7 d后,取菌饼放入PD液体培养基中置于摇床内培养,培养条件为28 ℃、200 r·min-1,培养5~6 d,收集孢子悬浮液。
1.2.2 基质接种 尖孢镰刀菌孢子悬浮液与无土栽培基质按1∶3(V∶m)的比例混合均匀,配制成的试验基质带菌浓度为1.63×106cfu·g-1。
1.2.3 熏蒸剂处理 将带菌基质分装至1 L花盆中,快速加入药剂后用0.04 mm低密度聚乙烯薄膜密封,熏蒸温室内最高温度为37 ℃,基质含水量65%~75%。分别采集熏蒸5、8、11 d的基质土样各10 g。威百亩试验剂量(有效成分)分别设为30、60、90、120、150、180 mg·L-1;棉隆微粒剂试验剂量分别设为37.5、75、150、225、300、375 mg·L-1;甲醛试验剂量分别设为稀释25、50、100、150、200、250倍;氰氨化钙试验剂量分别设为300、400、500、600、700、800 mg·L-1;二甲基二硫试验剂量分别设为25、50、100、200、400、600 mg·L-1;1,3-二氯丙烯试验剂量分别设为5、25、50、100、150、200 mg·L-1;甲基碘试验剂量分别设为100、150、200、250、300、350 mg·L-1。随机区组排列,3次重复,并设空白对照(CK)。
1.2.4 尖孢镰刀菌数量测定 采用稀释涂抹平板法测定尖孢镰刀菌的数量。将采集的10 g基质土样倒入装有90 mL无菌水的三角瓶,充分振荡,用梯度稀释法配制成一系列稀释液。将0.1 mL稀释液均匀涂布在尖孢镰刀菌选择性培养基上,在20 ℃恒温箱中培养3 d后调查菌落数量。
尖孢镰刀菌灭杀率=(对照尖孢镰刀菌数量-处理尖孢镰刀菌数量)/对照尖孢镰刀菌数量×100%
1.2.5 数据处理 采用Excel 2003软件进行试验结果的统计,利用SPSS 17.0软件进行方差分析和多重比较。
2 结果与分析
2.1 42%威百亩对尖孢镰刀菌的灭杀效果
从表1可以看出,与空白对照相比,各浓度威百亩熏蒸剂处理均显著降低基质中尖孢镰刀菌的数量,且其灭杀率均达99.00%以上。不同浓度间相比,熏蒸5 d后,120、150、180 mg·L-1处理的基质中尖孢镰刀菌数量显著低于其他处理,且对尖孢镰刀菌的灭杀率达到100.00%;熏蒸8 d后,除威百亩30 mg·L-1处理外,其他浓度处理间基质中尖孢镰刀菌的数量无显著差异。
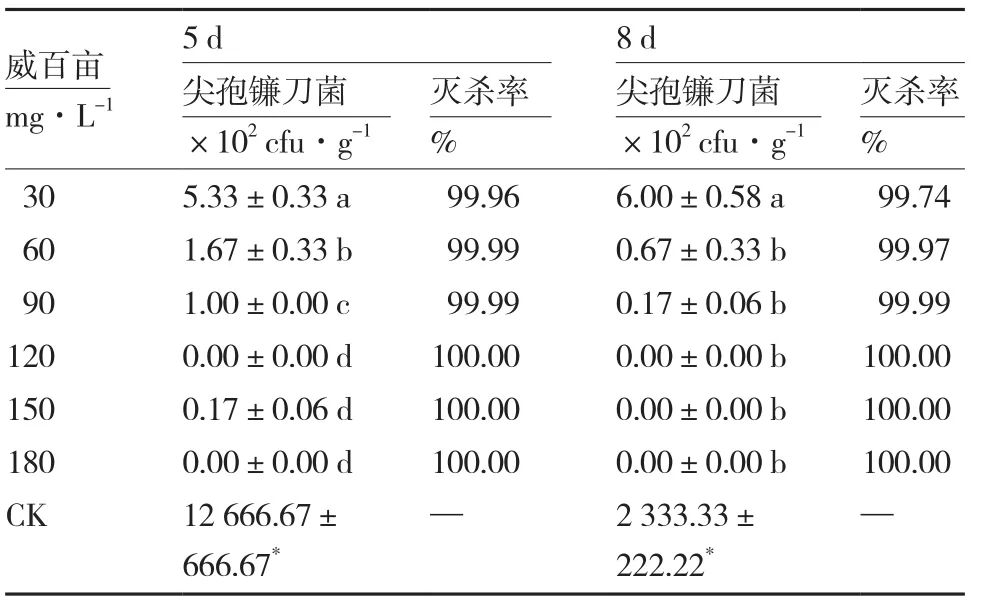
表1 42%威百亩对尖孢镰刀菌的灭杀效果
2.2 98%棉隆对尖孢镰刀菌的灭杀效果
从表2可以看出,与对照相比,6个浓度处理的棉隆熏蒸剂均显著降低无土栽培基质中尖孢镰刀菌的数量,其灭杀率均达99.00%以上。不同浓度间相比,熏蒸5 d后,150 mg·L-1以上高浓度处理的基质中尖孢镰刀菌数量显著低于低浓度处理,但高浓度处理间无显著差异。300 mg·L-1和375 mg·L-1处理对基质中尖孢镰刀菌的灭杀率均可达100.00%。
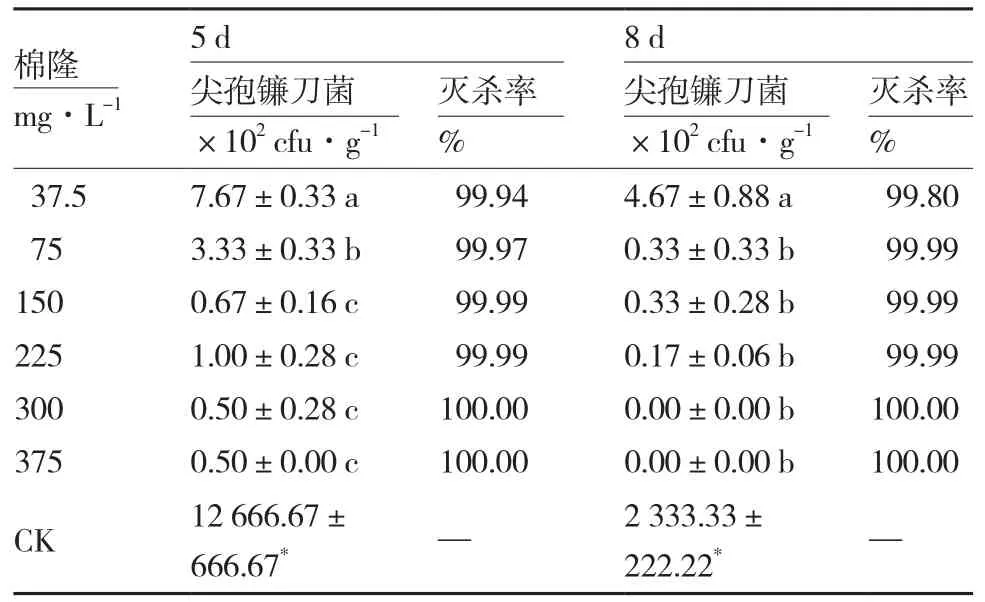
表2 98%棉隆对尖孢镰刀菌的灭杀效果
2.3 40%甲醛对尖孢镰刀菌的灭杀效果
从表3可以看出,与对照相比,各浓度甲醛熏蒸剂处理均显著降低无土栽培基质中尖孢镰刀菌的数量,灭杀率达80.00%以上。不同浓度间相比,熏蒸5 d后,甲醛稀释25倍处理的基质中尖孢镰刀菌数量最低;熏蒸8 d和11 d后,甲醛稀释25倍和50倍处理的基质中尖孢镰刀菌数量显著低于其他4个处理浓度,且灭杀率均达98.00%以上,熏蒸8 d对尖孢镰刀菌的灭杀率分别达99.06%和99.07%。
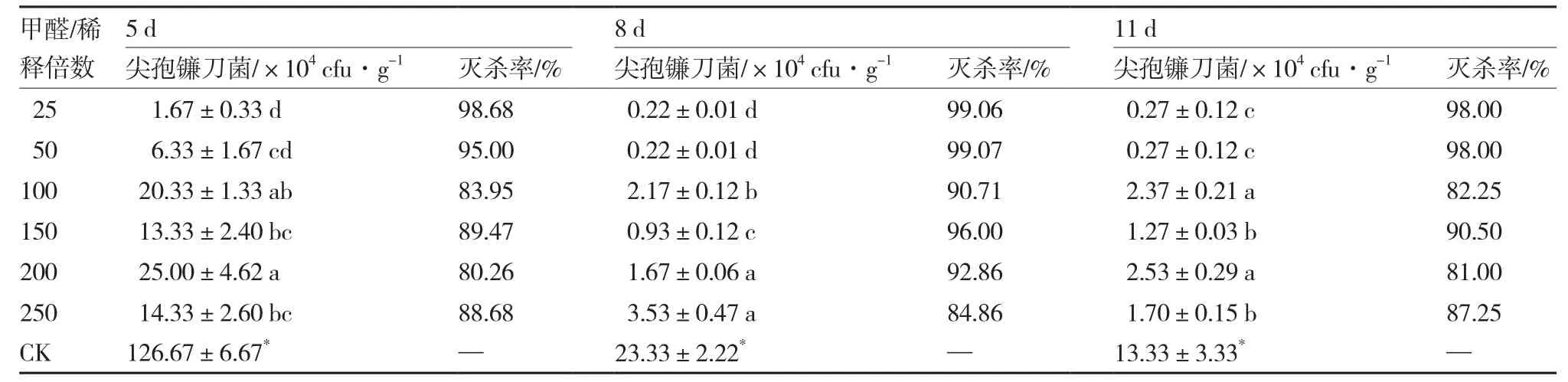
表3 40%甲醛对尖孢镰刀菌的灭杀效果
2.4 氰氨化钙对尖孢镰刀菌的灭杀效果
从表4可以看出,与对照相比,各浓度氰氨化钙处理均可以显著降低无土栽培基质中尖孢镰刀菌的数量。不同浓度间相比,熏蒸5 d后,800 mg·L-1处理基质中尖孢镰刀菌的数量显著低于其他5个浓度处理,灭杀率达94.74%;熏蒸8 d和11 d后,700 mg·L-1和800 mg·L-1处理基质中尖孢镰刀菌的数量显著低于低浓度(300、400、500 mg·L-1)处理,对尖孢镰刀菌的灭杀率分别达97.43%、98.71%和93.50%、95.75%。
2.5 二甲基二硫对尖孢镰刀菌的灭杀效果
从表5可以看出,与对照相比,各浓度二甲基二硫熏蒸剂处理均显著降低无土栽培基质中尖孢镰刀菌的数量。不同浓度间相比,熏蒸5 d后,600 mg·L-1处理基质中尖孢镰刀菌的数量最低,灭杀率达79.47%;熏蒸8 d后,200、400、600 mg·L-1处理的基质中尖孢镰刀菌数量显著低于25 mg·L-1和50 mg·L-1处理,但3个处理间尖孢镰刀菌数量并无显著差异,其灭杀率分别达96.14%、96.57%和96.29%;熏蒸11 d后,25 mg·L-1处理的基质中尖孢镰刀菌数量最高,而其他5个处理间无显著差异。
2.6 1,3-二氯丙烯对尖孢镰刀菌的灭杀效果
从表6可以看出,与对照相比,各浓度1,3-二氯丙烯处理均可以显著降低无土栽培基质中尖孢镰刀菌的数量。不同浓度间相比,熏蒸5 d后,低浓度(5 mg·L-1)处理基质中尖孢镰刀菌的数量最高,灭杀率仅为31.58%;熏蒸8 d后,150 mg·L-1处理对尖孢镰刀菌的灭杀效果最好,灭杀率达94.86%;熏蒸11 d后,6个浓度处理间尖孢镰刀菌数量无显著差异。
2.7 甲基碘对尖孢镰刀菌的灭杀效果
从表7可以看出,与对照相比,各浓度甲基碘处理均可以显著降低无土栽培基质中尖孢镰刀菌的数量。不同浓度间相比,熏蒸8 d后,300 mg·L-1处理对尖孢镰刀菌的灭杀效果最好,灭杀率达85.00%。
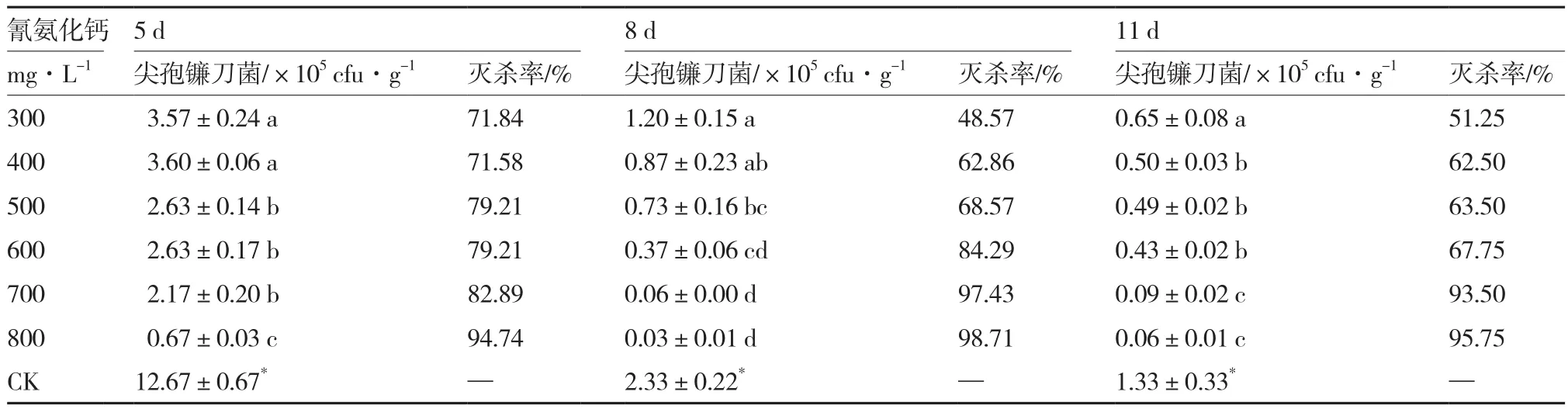
表4 氰氨化钙对尖孢镰刀菌的灭杀效果
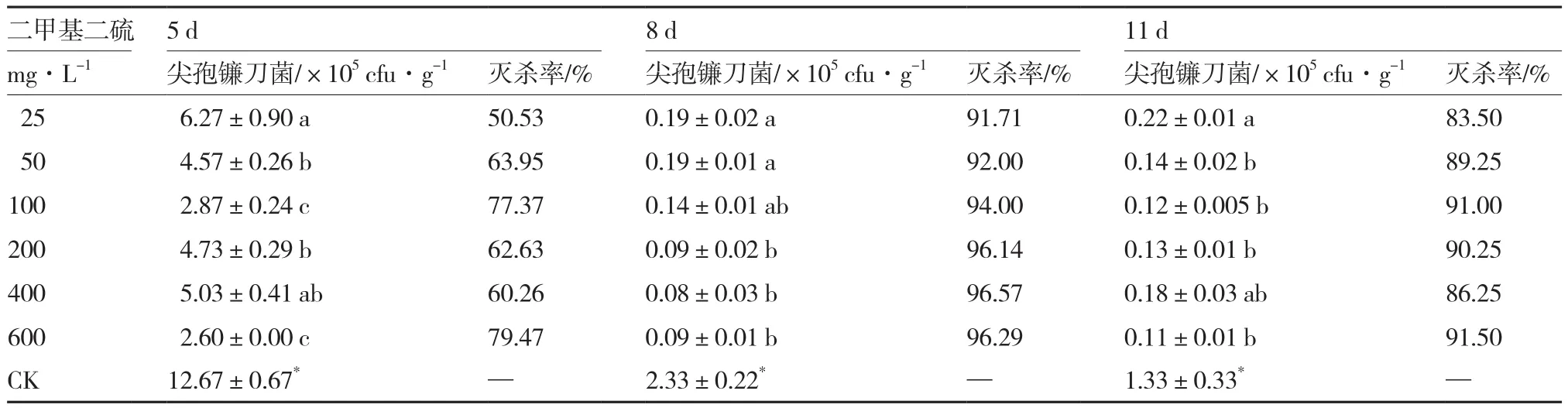
表5 二甲基二硫对尖孢镰刀菌的灭杀效果
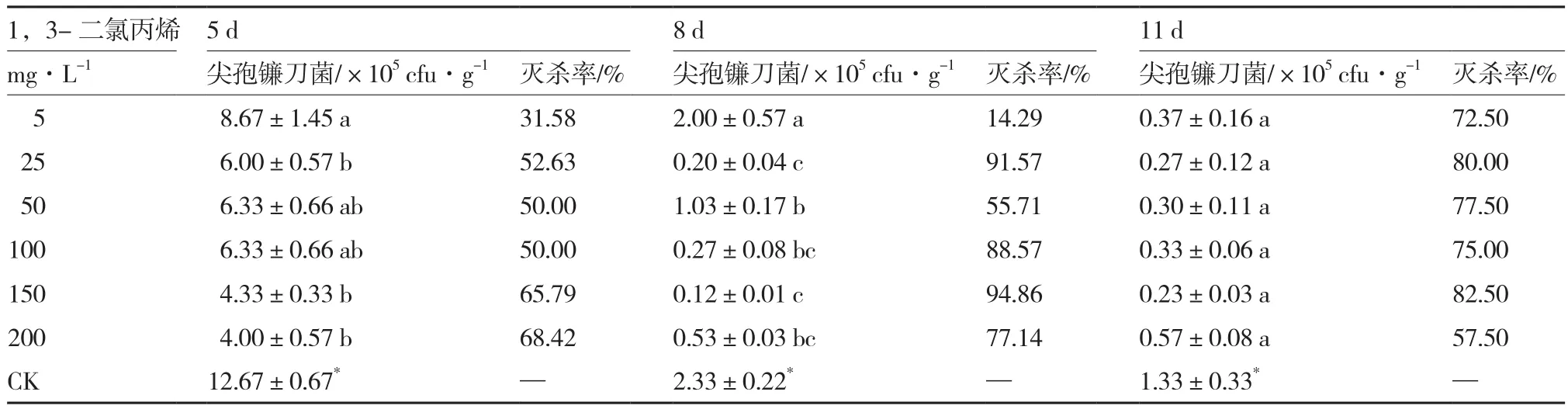
表6 1,3-二氯丙烯对尖孢镰刀菌的灭杀效果
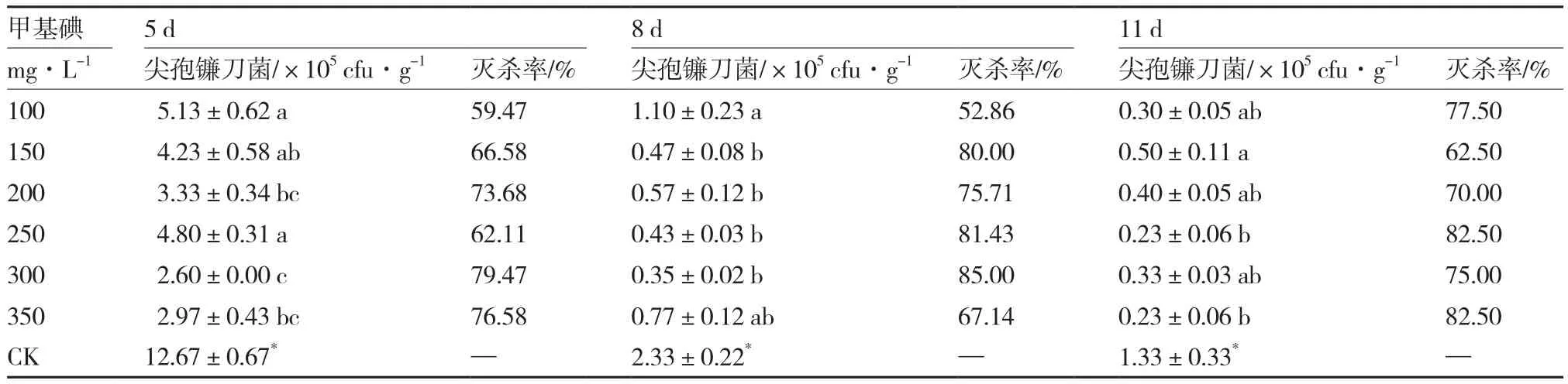
表7 甲基碘对尖孢镰刀菌的灭杀效果
3 结论与讨论
有关化学熏蒸剂防治保护地蔬菜镰刀菌属病原菌(Fusarium spp.)的效果及其方法的相关研究较多,但无土栽培方面的研究较少且没有明确的说法,本试验研究了不同用量及熏蒸时间的7种熏蒸剂(威百亩、棉隆、氰氨化钙、甲醛、二甲基二硫、1,3-二氯丙烯及甲基碘)对无土栽培基质中尖孢镰刀菌数量的影响。
本试验结果表明,与空白对照相比,7种熏蒸剂不同浓度、不同熏蒸时间处理均可以显著降低无土栽培基质中尖孢镰刀菌的数量。前人研究表明,氰氨化钙可有效防治镰刀菌属(Fusarium spp.)引起的黄瓜、甜瓜、草莓、香蕉等枯萎病(Bletsos,2005;Choi et al.,2007;贲海燕 等,2013);Pinkerton等(2000)发现威百亩能显著减少疫霉病菌(Phytophthora cinnamomi)和黄萎病菌(Verticillium dahliae)的发生;Mao等(2012)研究发现棉隆和1,3-二氯丙烯能够大幅度降低黄瓜连作土壤中Fusarium spp.和Phytophthora spp. 2种主要有害真菌,这些报道与本试验结果基本相符。本试验还发现,120 mg·L-1的42%威百亩和300 mg·L-1的98%棉隆在熏蒸处理5 d后,对基质中尖孢镰刀菌的作用效果已经很显著,灭杀率均达100.00%,且熏蒸8 d后灭杀效果并无减弱;而其他5种熏蒸剂则在熏蒸8 d后对尖孢镰刀菌的灭杀效果最好,其中,350 mg·L-1甲基碘在熏蒸 11 d后基质中尖孢镰刀菌的数量比8 d有所下降,但其灭杀率却低于300 mg·L-1熏蒸8 d,初步推断是因为高浓度的甲基碘需要长时间的熏蒸才能发挥作用,且其易挥发,但需进一步研究证实其原因。
综合来看,适宜浓度的7种熏蒸剂对无土栽培基质中尖孢镰刀菌的灭杀效果为:威百亩>棉隆>甲醛>氰氨化钙>二甲基二硫>1,3-二氯丙烯>甲基碘;各熏蒸剂的成本价为甲醛<威百亩<棉隆<氰氨化钙<1,3-二氯丙烯<二甲基二硫<甲基碘,因此使用时可选择120 mg·L-142%威百亩或300 mg·L-198%棉隆熏蒸5 d,40%甲醛稀释50倍或800 mg·L-1氰氨化钙熏蒸8 d。本试验只对尖孢镰刀菌的灭杀效果进行了研究,而熏蒸剂使用后对蔬菜生长生理及产量有无影响还有待于进一步研究。
安星辰,宋卫堂,何华名,齐太山.2014.微/纳米气泡臭氧水对尖孢镰刀菌的灭杀效果研究.沈阳农业大学学报,45(6):679-684.
贲海燕,崔国庆,石延霞,谢学文,李宝聚.2013.氰氨化钙土壤改良作用及其防治蔬菜土传病害效果.生态学杂志,32(12):3318-3324.
卜东欣,张超,李伟,王金信.2014.威百亩对西葫芦常见土传病原菌的毒力及田间防效.植物保护学报,41(5):562-568.
陈伟武,方文熙,郑文鑫,吕泉渠.2013.作物栽培基质消毒技术及其应用前景.福建农机,(3):42-45.
林抗美,车建美,刘波,朱育菁,肖荣凤,蓝江林.2006.不同寄主尖孢镰刀菌培养滤液对黄瓜胚根萌发的影响.中国农学通报,22(1):246-248.
申卫收,林先贵,张华勇,尹睿,段增强,施卫明.2008.不同栽培条件下蔬菜塑料大棚土壤尖孢镰刀菌数量的变化.土壤学报,45(1):137-141.
史怀,朱育菁,李芳,刘波.2006.淡紫拟青霉NH-PL-03菌株的多糖及其对尖孢镰刀菌的抑制作用.中国植保导刊,26(9):5-8.
台莲梅,郑雯,靳学慧,辛惠普,闫凤云.2006.不同杀菌剂对尖孢镰刀菌的室内毒力测定.黑龙江八一农垦大学学报,18(5):10-12.
肖荣凤,朱育菁,蓝江林,林抗美,刘波.2008.黄瓜尖孢镰刀菌的营养特性.植物保护科学,24(5):299-303.
杨晓楠,高德良,韩君,刘峰.2011.棉隆及氯化苦对几种生姜土传病原物的毒力.农药学学报,13(3):331-334.
朱育菁,车建美,肖荣凤,苏明星,黄晓芸,蓝江林.2007.尖孢镰刀菌(Fusarium oxysporum Schl.)的生长特性.中国农学通报,23(8):373-376.
Backer J O,Ohr H D,Grech N M,Milton Jr E M,Sims J J.1998.Evaluation of methyl iodide as a soil fumigant in container and small field plot studies.Pesticide Science,52:58-62.
Banks J.2002.2002 report of the methyl bromide technical options committee.Nairobi:United Nations Environment Programme(UNEP):43-60.
Bletsos F A.2005.Use of grafting and calcium cyanamide as alternatives to methyl bromide soil fumigation and their effects on growth,yield,quality and Fusarium wilt control in melon.Journal of Phytopathology,153:155-161.
Choi H W,Chung I M,Mi H S,Yu S K,Sim J B,Kim J W,Ki D K,Chun S C.2007.The effect of spent mushroom sawdust compost mixes,calcium cyanamide and solarization on basal stem rot of the cactus Hylocereus trigonus caused by Fusarium oxysporum.Crop Protection,26:162-168.
Covarelli L,Pannacci E,Beccari G,Errico F P,Tosi L.2010.Two-year investigations on the integrated control of weeds and root parasites in Virginia bright tobacco(Nicotiana tabacum L.)in central Italy.Crop Protection,29:783-788.
Giannakou I O,Karpouzas D G.2003.Evaluation of chemical and integrated strategies as alternatives to methyl bromide for the control of root-knot nematodes in Greece.Pest Management Science,59:883-892.
Mao L G,Wang Q X,Yan D D,Cao A C.2012.Evaluation of the combination of 1,3-dichloropropene and dazomet as an efficient alternative to methyl bromide for cucumber production in China.Pest Management Science,68(4):602-609.
Pinkerton J N,Ivors K L,Miller M L,Moore L W.2000.Effect of soil solarization and cover crops on populations of selected soil borne plant pathogens in western Oregon.Plant Disease,84(9):952-960.
Qiao K,Jiang L L,Wang H Y,Wang L K.2010.Evaluation of 1,3-dichloropropene as a methyl bromide alternative in tomato crops in China.Journal of Agricultural and Food Chemistry,58:11395-11399.
Qiao K,Zhang H,Wang H Y,Ji X X,Wang K Y.2011.Efficacy of aluminium phosphide as a soil fumigant against nematode and weed in tomato crop.Scientia Horticulturae,130:570-574.
Shi K,Wang L,Zhou Y H,Yu Y L,Yu J Q.2009.Effects of calcium cyanamide on soil microbial communities and Fusarium oxysporum f.sp.cucumberinum.Chemosphere,75:872-877.
Wang D X,Patrick J C,Gao X W.2006.Optimizing indoor phosphine fumigation of paddy rice bag-stacks under sheeting for control of resistant insects.Journal of Stored Products Research,42:207-217.
Evaluation on Effect of Different Fumigants on Fusarium oxysporum in Soilless Culture Substrates
YU Hong-jun,LYU Ya-you,LI Qiang,AI Shuang,LI Bing-juan,JIANG Wei-jie*
(Institute of Vegetables and Flowers,Chinese Academy of Agricultural Sciences,Beijing 100081,China)
In order to study the effects of 7 kinds of fumigant,such as metham sodium,dazomet,calcium cyanamide,methanal,1,3-dichloropropylene,dimethyl disulfide and methyl iodide on Fusarium oxysporum in soilless culture substrates after treatment at different times and with different concentrations,the experiments determined the quantity changes of Fusarium oxysporum with dilution plate method through indoor culture experiments. The results showed that all 7 kinds of fumigant could significantly reduce the number of Fusarium oxysporum. After 5 days fumigation with 120 mg·L-142% metham sodium and 300 mg·L-198% dazomet,the killing rate could reach up to 100.00%;after 8 days fumigation with 50 times diluted 40% methanal,800 mg·L-1calcium cyanamide,400 mg·L-1dimethyl disulfide,150 mg·L-11,3-dichloropropylene and 300 mg·L-1methyl iodide,the killing rate could reach 99.07%,98.71%,96.57%,94.86% and 85.00%,respectively. Thus,all 7 kinds of fumigant had some effects on Fusarium oxysporum,and metham sodium and dazomet had the most significant effect on controlling Fusarium oxysporum at soilless culture substrates,and yet with very short fumigation time. The next effective were methanal and calcium cyanamide.
Fumigant;Soilless culture substrates;Fusarium oxysporum;Killing rate
余宏军,男,研究员,专业方向:栽培生理与无土栽培,E-mail:yuhongjun@caas.cn
*通讯作者(Corresponding author):蒋卫杰,男,研究员,博士生导师,专业方向:温室作物无土栽培和逆境生理,E-mail:jiangweijie@caas.cn
2016-11-11;接受日期:2017-02-15
公益性行业(农业)科研专项(201203001,201203095),国家大宗蔬菜产业技术体系项目(CARS-25-C-09),农业部园艺作物生物学与种质创制重点实验室项目,设施蔬菜协同创新中心项目
——硫酰氟熏蒸应用技术

