荧光编码微球的制备研究进展
李 艳 罗 成* 吴道澄
1(宜春学院医学院,江西 宜春 336000)2(西安交通大学生命科学与技术学院教育部生物医学信息工程重点实验室,西安 710049)
荧光编码微球的制备研究进展
李 艳1罗 成1*吴道澄2
1(宜春学院医学院,江西 宜春 336000)2(西安交通大学生命科学与技术学院教育部生物医学信息工程重点实验室,西安 710049)
悬浮芯片技术是近年来兴起的高通量生物检测技术,在生命科学研究及临床诊断等领域具有广泛应用。作为悬浮芯片技术的检测载体,荧光编码微球的研究已取得一系列进展。首先对悬浮芯片技术的检测原理及应用进行简单介绍,重点对荧光编码微球的制备方法进行总结,包括有机溶剂溶胀法、层-层自组装法、包埋法、微流控技术、膜乳化法等,最后对荧光编码微球未来的发展趋势进行探讨。
悬浮芯片;微球;荧光编码;量子点
引言
悬浮芯片技术又称为悬浮阵列和液相芯片,是在传统平面生物芯片技术基础上发展起来的高通量生物检测技术。与平面生物芯片技术相比,悬浮芯片具有多功能性、高敏感性、高通量、高灵活性等优势[1-3],被广泛应用于生命科学研究及临床诊断等诸多领域。作为最常用的悬浮芯片检测载体,荧光编码微球的研究近年来取得了大量进展,涌现了多种多样的制备方法。下面先对悬浮芯片的检测原理及应用进行简单介绍,再重点对荧光编码微球的制备方法、荧光编码与其他功能的复合、荧光编码微球的发展趋势等进行系统阐述。
1 悬浮芯片技术
1.1 检测原理
悬浮芯片技术的检测原理如图1所示,其中编码微球作为免疫检测的载体,所带有的编码信息同时用作表面结合探针分子的标记。悬浮芯片技术的分析过程为:目标分子先与编码微球表面负载的探针分子结合,再进一步与带有荧光标记的报告分子结合,形成夹心式结构的复合体,微球带有的编码信息用于区分目标分子的种类,而报告分子的信号强弱则反映目标分子的含量。

图1 悬浮芯片技术检测原理Fig.1 Schematic illustration of suspension array analysis
1.2 技术应用
悬浮芯片技术在基因表达谱分析、基因突变及多态性分析、病原微生物检测、疾病的早期诊断等方面具有广泛的应用[4-5]。朱鹏等利用多重PCR、多重等位基因特异性引物延伸反应以及悬浮芯片技术,确定了东方型鼠疫菌中18个单核苷酸多态性(SNP)位点的碱基状态,并依据这18个SNP将36株东方型鼠疫菌分为7个基因型[6]。Sun等利用多重PCR结合悬浮芯片分析技术,同时鉴定6种食源性致病菌(大肠杆菌O157:H7,志贺氏杆菌,沙门氏菌,副溶血性弧菌,金黄色葡萄球菌,单增李斯特菌),检测灵敏度比传统的PCR法高1~5个数量级,多重检测的检测限为1~10 CFU/mL[7]。Nolen等利用悬浮芯片技术,测定了包括83例非小细胞肺癌(NSCLC)、74例良性肺部肿瘤和77例正常人群尿液样本中的242种生物标志物,并确定了一组针对NSCLC的肿瘤标志物(IGFBP-1,sIL-1Ra,CEACAM-1),这对区分NSCLC和正常对照组具有很高的特异性[8]。Tong等利用悬浮芯片技术和酶联免疫吸附试验,检测胃癌的10种血清标志物,通过3种诊断算法筛选了5种标志物,该组标志物的含量显著高于其他细胞因子和标志物,有望提高胃癌的检测准确性[9]。由于悬浮芯片技术具有高通量、多功能性等优势,所以在临床检验诊断、环境监测、农业监测等方面具有广阔的应用前景。
2 荧光编码微球
2.1 微球编码方式
微球的编码方式主要包括光谱编码(荧光编码、拉曼编码、光子晶体反射编码)、图形编码、荧光寿命编码、衍射及全息编码等[3,10-11]。相对于其他编码方式,荧光编码具有编码及解码过程简单、编码容量大、可大批量制备等优势。荧光编码微球利用荧光发射波长和强度进行编码,理论上编码容量C=Nm-1,N是荧光的强度梯度,m是发射波长的数量,1对应所有荧光强度为零的编码。以3种发射波长、每个发射波长分为10个浓度梯度为例,编码容量可以达到C=103-1=999。荧光编码微球可以通过流式细胞仪或者微流控系统进行检测,分析速度达到几千甚至几万赫兹,因而特别适用于高通量样本分析。
2.2 荧光编码元件
荧光编码微球的编码元件主要分为有机荧光染料、量子点和上转换纳米颗粒3类[12]。有机荧光染料价格低廉、种类较多,适用于多种编码方法和多种材质的微球,不同批次间荧光均一性好;缺点在于荧光稳定性差,激发光谱不重叠的染料需要多个激发光源进行激发,因而增加了分析仪器的成本。量子点的发射光谱窄,荧光稳定性好,发射波长可以通过量子点的尺寸和组分进行调节,其较宽的激发光谱可以实现多种量子点的单一波长激发,缺点在于组成量子点的重金属元素具有一定的毒性。部分有机染料或量子点制备的荧光编码微球需要较短的激发波长,所以导致较强的背景干扰(瑞丽散射和自发荧光)。上转换纳米颗粒利用近红外光激发,可以有效避免生物分子背景荧光的干扰,同时利用上转换纳米颗粒编码,可以避免不同发射波长间的共振能量转移现象,缺点是具有不同发射波长的上转换纳米颗粒种类较少。
3 荧光编码微球制备方法
3.1 有机溶剂溶胀法
有机溶剂溶胀法的基本原理为:聚合物微球在有机溶剂中溶胀,染料或量子点等渗透入微球内部;移除有机溶剂后,微球聚合物网络发生收缩,并将染料或量子点等包裹在微球内部;调整染料或量子点的种类和浓度,可以实现不同的荧光编码。利用该方法制备的代表性荧光编码微球是Luminex公司的MicroPlex®微球,是利用红色和近红外染料对聚苯乙烯微球进行编码,两种染料分别设定10个浓度梯度,得到了100种荧光编码微球,并开发了与MicroPlex®编码微球配套的xMAP(multi-analyte profiling)多重样本分析平台。新一代的MagPlex®微球在此基础上增加了第三种荧光染料(5个浓度梯度),得到了500种编码微球。基于类似的原理,Han等利用疏水性ZnS-CdSe量子点制备荧光编码微球,微球的荧光强度与微球内部量子点的数量成线性关系[13]。在单色荧光编码的基础上,按照量子点尺寸从大到小的顺序,依次负载不同发射波长的量子点,可以实现微球的多色荧光编码。选用与量子点相同激发波长(350 nm)的染料标记DNA目标分子,可以实现编码微球和目标分子的单一激发光源的激发。Zhang等利用类似的方法,将上转换纳米颗粒包裹在聚苯乙烯微球内部,调整不同发射波长上转换纳米颗粒的比例,可以获得不同的荧光编码微球[14]。上转换荧光编码与报告分子染料标记没有光学交叉,因此标记染料的可选择范围很宽(见图2)。
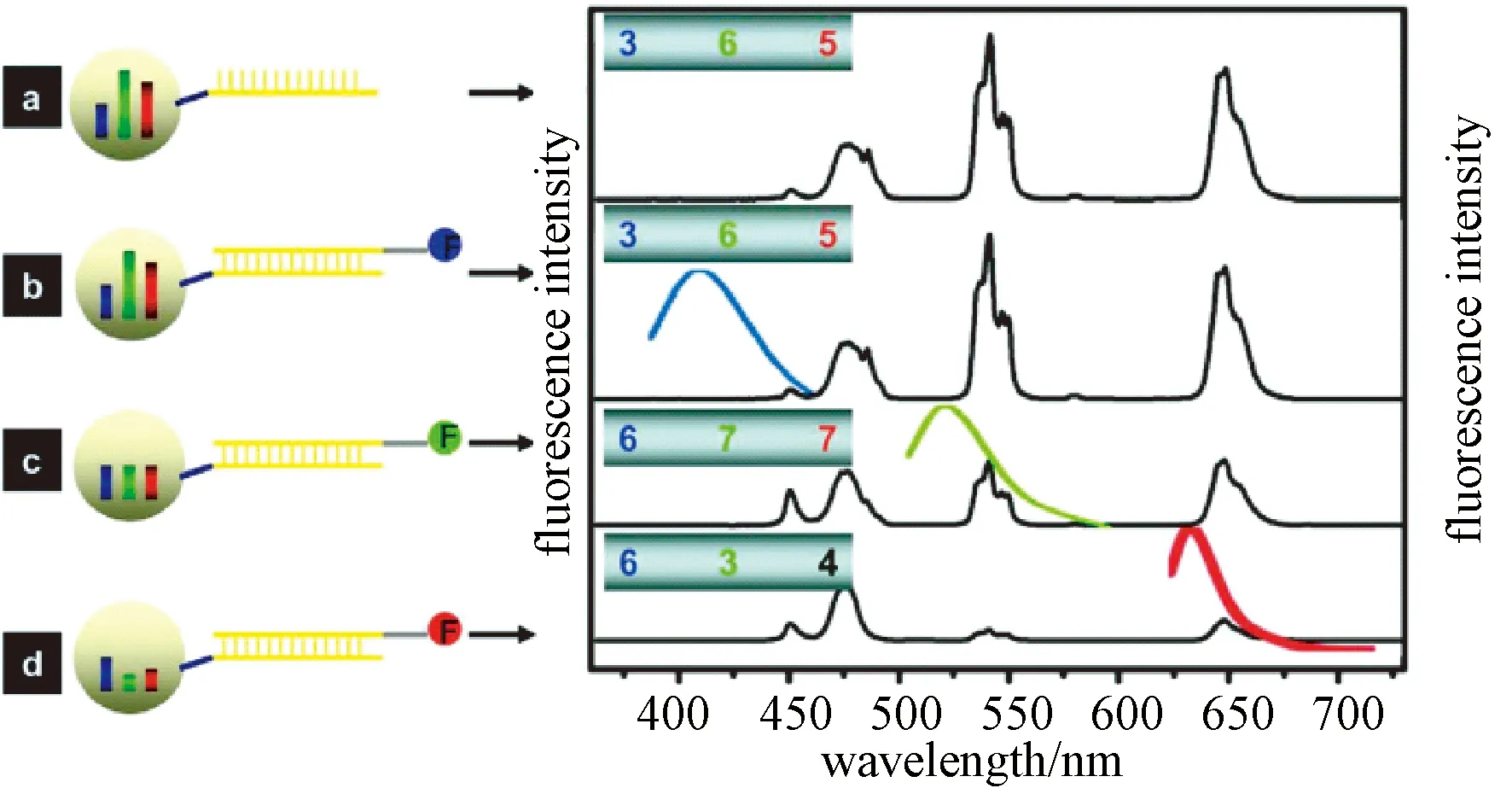
图2 不同上转换纳米颗粒编码微球用于目标分子检测[14]Fig.2 Microspheres encoded with different upconversion nanoparticles for detection of targeted molecules[14]
为了增加荧光编码微球的荧光均一性和稳定性,许多学者对有机溶剂溶胀法进行了改进。Wang等利用有机溶剂溶胀-溶剂蒸发法,制备荧光编码微球[15]。量子点和微球的氯仿溶液在密封条件下搅拌2 h溶胀微球,之后将溶液在空气氛下搅拌2 h,随着氯仿的挥发,溶液中量子点的浓度逐渐升高,促使量子点渗入微球内部。该方法可以增加量子点在微球内的包裹效率和分布均一性。Song等利用渐次溶剂蒸发方式,制备荧光编码微球[16]。微球分散在异丙醇中,与量子点的氯仿溶液混合后,在真空干燥箱中干燥12 h。由于量子点在氯仿中的分散性比在异丙醇中好,干燥过程中氯仿较异丙醇挥发速度快,从而驱动量子点从溶液扩散到微球内部,溶剂完全挥发后得到负载量子点的荧光编码微球。调整微球制备过程中制孔剂的含量,可以实现量子点在微球内部的均匀分布。
为了避免环境干扰导致量子点从微球中泄露以及量子点荧光变化,Song等利用自愈合法制备荧光编码微球[17]。整个反应分为溶胀、升温、脱溶胀和降温三部分: 多孔聚苯乙烯微球分散在十六烷中,与量子点的氯仿溶液混合后于50℃搅拌1~2 h溶胀微球;在氩气氛下逐渐升温至180℃,升温阶段聚合物分子链自发运动,微球继续溶胀,同时氯仿蒸发导致微球内外量子点浓度出现差异,量子点更容易渗透进微球内部。氯仿被除去后,聚合物分子链的热运动和相互作用导致微球孔隙收缩;随之迅速降温,微球脱溶胀,聚合物分子链再次被固定,从而将量子点牢固限定在微球内部。与传统有机溶剂溶胀法制备的荧光编码微球相比,自愈合法制备的荧光编码微球具有较高的量子点负载量,量子点在微球基质内分布均匀,同时避免了量子点的泄露,提高了荧光编码微球在不同pH条件下的化学稳定性和长期储藏稳定性。
3.2 疏水作用结合
Gao等利用介孔二氧化硅微球和三正辛基氧膦(TOPO)修饰量子点之间的强疏水作用,制备荧光编码微球[18],编码过程通过搅拌量子点和微球的混合溶液实现,对于32 nm孔径的微球,编码过程只需10 min即可完成。由于介孔微球具有较大的孔径和比表面积,量子点可以渗透进介孔微球内部,所以该方法制备的荧光编码微球比有机溶剂溶胀法制备的荧光编码微球亮度要高50~100倍。量子点表面的TOPO与介孔模板分子疏水碳链有多重疏水作用,将量子点牢牢固定在介孔通道内,防止了量子点的解离或泄露。后来,该课题组利用类似的原理,制备了聚苯乙烯荧光编码微球[19],微球与量子点的结合快速且定量,上清中几乎无残余量子点存在。多孔微球的荧光亮度和均匀度分别是无孔微球的1 000倍和5倍。微球分散在水或极性有机溶剂中无量子点泄露,7种单色编码和4种双色编码微球混合后,可以通过流式细胞仪进行区分。Hu等利用该方法制备量子点掺杂的介孔二氧化硅微球,编码微球表面结合聚乙烯醇后包裹二氧化硅壳层[20]。二氧化硅包裹后的荧光编码微球具有非常高的稳定性,避免了溶剂(氯仿)诱导的量子点泄露和化学诱导的荧光猝灭。
3.3 层-层自组装法
利用聚电解质和相反电性量子点间的静电吸附作用,可以实现聚电解质和量子点在微球表面的交替结合。调整聚电解质和量子点结合的层数,可以控制微球表面负载的量子点数量[21]。Sukhanova等利用层-层自组装法,将3种不同发射光谱的量子点分别组装在三聚氰胺-甲醛树脂微球表面,利用量子点与报告分子荧光之间的共振能量转移作用,成功实现了3种目标分子的检测[22]。Allen等先利用季胺化的苯乙烯-氯甲基苯乙烯共聚物,将疏水性量子点从氯仿转移到水相,并使量子点带有正电性,之后将量子点通过层-层自组装法组装在二氧化硅微球表面,制备荧光编码微球[23]。Schnackel等将异硫氰酸荧光素标记的聚烯丙基胺盐酸盐(FITC-PAH)和相反电性的聚苯乙烯磺酸钠(PSS)交替组装在二氧化硅微球表面[24],微球的荧光强度可以通过FITC-PAH荧光层的层数以及未做荧光标记的PAH和FITC-PAH之间的比例进行调整。
3.4 表面交联法
为了实现微球表面的固相引物合成,Nanthakumar等利用高度交联、非溶胀的聚苯乙烯微球,通过在微球表面共价交联BODIPY染料分子,实现荧光编码寡核苷酸合成载体的制备[25]。微球表面交联的染料数量由染料的浓度决定,利用浓度逐级稀释(10倍)的染料溶液,得到4种强度的荧光编码。Kozak等在有机硅微球表面共价交联荧光染料Atto-Tech 550和620[26],通过改变两种染料的浓度获得了41种荧光编码微球,并通过表面引发的可逆加成-断裂链转移反应,在微球表面生成了一层蛋白质抵抗聚合物层,减少了97%的非特异性蛋白质吸附。
3.5 包埋法
3.5.1 有机染料编码
Zhang等利用单分散聚苯乙烯微球进行种子聚合[27],罗丹明6G(R6G)染料在聚合过程中被包裹在壳层内。调整染料的浓度可以准确控制微球的荧光强度,制备了12种不同荧光强度的荧光编码微球。Liu等首先制备了烯丙基化的罗丹明B、荧光素和尼罗红,然后将染料与苯乙烯单体等混合,通过分散聚合制备了3种荧光编码微球,染料分子共聚在微球内部[28]。该课题组还利用吸附法制备了2种荧光编码微球,微球分散良好,具有较高的荧光强度和稳定性。
Wu等通过有机溶胶-凝胶法,制备荧光编码三聚氰胺-甲醛树脂微球(见图3)[29]。染料分子首先与树枝状的三聚氰胺-甲醛预聚物分子结合,在预聚物进一步反应生成微球的同时,将染料分子包裹在微球内部。该方法对多种染料都有很高的包裹率,微球具有较高的热和机械稳定性,保存过程中几乎无染料分子泄露。利用2种(每种染料5个浓度梯度)和3种染料(每种染料3个浓度梯度),分别制备了25种和27种荧光编码微球。利用染料间的荧光共振能量转移作用,可以实现多种激发波长染料的单一波长激发。
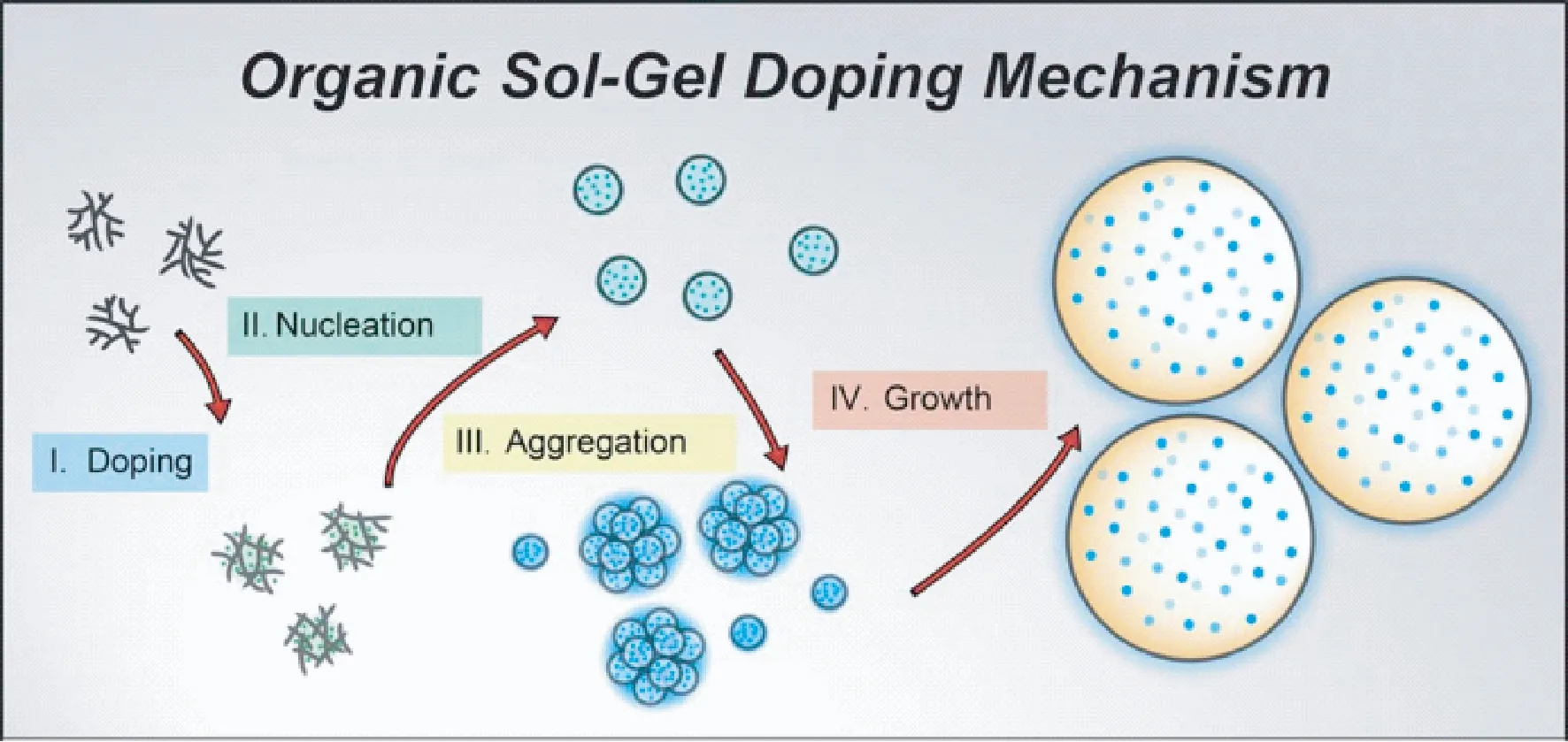
图3 有机溶胶-凝胶法制备荧光编码微球[29]Fig.3 Schematic illustration of encoding microspheres prepared by the organic Sol-Gel doping mechanism[29]
3.5.2 量子点编码
Vaidya等在悬浮聚合过程中,将量子点包裹在聚苯乙烯微球内部,调整量子点的颜色和数量,实现荧光编码微球的制备[30]。激光共聚焦显微镜分析证明,量子点在微球内部呈多个团聚体分布,微球的发射光谱与非聚集态量子点相比没有发生位移。由于团聚体内量子点间距离较近,不同发射波长量子点间发生共振能量转移,改变了不同发射波长的相对荧光强度,不过这种能量转移作用没有改变编码光谱的唯一性。利用一种染料作为内参比的比色式编码,可以消除微球粒径对编码的影响。Yang等利用可聚合的表面活性剂作为乳化剂和相转移剂,通过改进的细乳液聚合,将3-巯基丙酸修饰的CdTe量子点均匀包裹在聚苯乙烯微球内部[31]。聚苯乙烯具有致密结构和疏水特性,使得微球的荧光几乎不受pH的影响。可聚合的表面活性剂与聚合物骨架之间的共价键,使量子点被牢固固定在微球内部,因此微球具有优异的抗溶剂特性。
Chan等以单分散二氧化硅微球为核,表面包裹掺杂量子点的二氧化硅壳层,实现荧光编码微球的制备[32]。利用5-氨基-正戊醇(AP)和3-氨丙基三甲氧基硅烷(APTMS),通过链交换作用取代量子点表面结合的TOPO,AP的羟基基团增加了量子点在乙醇中的分散性,APTMS则与二氧化硅基质反应生成硅氧键,将量子点牢固地固定在微球基质内。编码微球的单分散性取决于内部的二氧化硅微球,因此不受编码过程的影响。Graf等将聚乙烯吡咯烷酮修饰的量子点吸附到氨基功能化的二氧化硅微球表面,在微球表面包裹二氧化硅壳层,将量子点固定在微球内部[33]。
3.6 刺激响应性水凝胶
Kuang等利用N-异丙基丙烯酰胺和4-乙烯基吡啶共聚物(PNIPVP)水凝胶的pH响应性,在酸性条件下将溶胀的凝胶微球与水溶性量子点孵育,微球经离心分离后分散在pH=7的水溶液中,凝胶网络收缩将量子点包裹在微球内部(见图4);量子点在微球内均匀分布,将不同种类量子点按照不同比例包裹在凝胶微球内,可以获得不同荧光编码的凝胶微球[34]。该课题组还利用温度响应性水凝胶微球制备量子点荧光编码微球,特别是凝胶结构的温度响应性使内部量子点之间的距离可以通过温度进行调整,进而控制量子点之间共振能量的转移,实现温度响应性的荧光发射[35]。
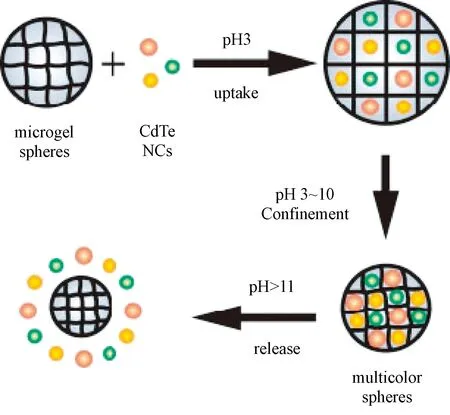
图4 pH响应性水凝胶负载量子点制备荧光编码微球及pH响应性量子点释放[34]Fig.4 Schematic illustration of the loading of quntum dots in spheres and their controlled release by pH[34]
3.7 膜乳化法
近红外光与生物分子的作用较弱,因而背景干扰较小。然而,通常报道的近红外量子点都具有较宽的发射光谱,因此当使用两种或以上发射波长编码时会出现光谱重叠现象。Wang等利用单波长编码策略,解决光谱重叠的问题(见图5)[36]。3种近红外量子点的发射光谱均涵盖流式细胞仪的FL4和FL5检测通道,但是在两个通道的强度比例不同,因而可以通过流式细胞仪进行区分。疏水性CdSeTe/CdS/ZnS量子点与聚合物分子溶解在甲苯中作为分散相,含有十二烷基磺酸钠的水溶液作为连续相,分散相在氮气压力下通过Shirasu介孔膜生成水包油的液滴,甲苯从液滴中蒸发后聚合物固化生成微球,将量子点包裹在微球内部,得到高亮度的荧光编码微球。量子点在整个微球内部均匀分布,微球具有较好的荧光稳定性和pH稳定性。3种量子点分别设置4个浓度梯度,制备得到了12种不同的荧光编码微球。
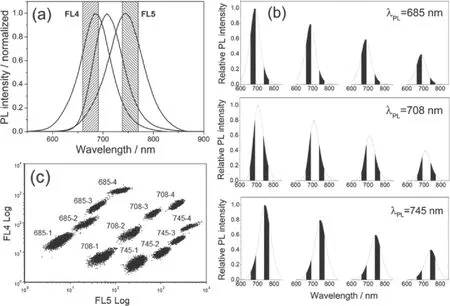
图5 单波长编码制备荧光编码微球[36]。(a)不同量子点编码微球在FL4、FL5检测通道内的分布比例不同;(b)3种量子点浓度梯度编码微球;(c)编码微球的流式细胞仪分析Fig.5 Microspheres encoded by “single wavelength” method.[36] (a) The relationship between the photoluminescence peak wavelength of microspheres and FL4, FL5 fluorescent detection channels of Beckman Coulter FC 500 flow cytometer;(b) Schematic of the relationship of the different barcodes corresponding to FL4 and FL5 fluorescence detection channels of flow cytometer;(c) Fluorescence barcodes matrices of encoding microspheres on flow cytometric FL5-FL4 plot diagram
3.8 微流控技术
微流控技术为纳米材料的制备开辟了新的途径[37],在荧光编码微球领域得到了广泛的应用。Gerver等[38]利用全自动的微流控器件,制备了镧系纳米荧光材料编码的亲水性聚合物微球。镧系纳米荧光材料、聚乙二醇双丙烯酸酯和光引发剂等溶解在甲醇中作为分散相,在流体通道内生成液滴,再经紫外线照射引发液滴内聚合反应,就得到荧光编码微球。镧系纳米荧光材料由于Laporte限制的f-f能级阶跃具有窄的发射峰,通用的主体基质使多种镧系金属可以通过同一波长进行激发,并且荧光稳定性好,无荧光重吸收现象。固定YVO4:Eu的浓度作为内参比,改变YVO4:Dy和YVO4:Sm的浓度,制备了24种不同的编码微球,同种编码微球之间编码差别小于3%,不同编码之间可以相互区分,误差率小于1‰。
Fournier-Bidoz等利用浓度调节的流动聚焦微流控技术,制备量子点编码荧光微球,含有量子点和苯乙烯-马来酸酐共聚物的氯仿溶液在流体通道内生成液滴,氯仿扩散入水溶液后,聚合物固化生成荧光编码微球。通过调整量子点的种类和浓度,制备了105种不同的荧光编码微球。聚合物分子中的马来酸酐遇水后水解生成两个羧基,赋予微球表面负电荷,使微球稳定分散并方便后续生物探针的共价交联。利用过滤器和阀门的组合,可以将反应产物中的水移除,使反应可以持续进行[39]。
Ji等利用微流控技术,制备量子点编码的海藻酸钙微球,含有量子点、海藻酸钠的液滴与连续流动相中的钙离子作用,生成包裹量子点的海藻酸钙凝胶微球。利用金字塔状的微流体网络,可以实现量子点逐级浓度梯度的自动化,无需预先制备不同浓度和比率的量子点溶液,不同编码的微球可以同时生成[40]。
Chen等利用毛细管微流控技术,制备水凝胶壳层保护的核-壳式荧光编码微球,水凝胶壳层的保护避免了量子点的泄露,增加了荧光稳定性。利用多个内部分散相毛细管,制备含有多个内部液滴的油/水/油双乳液为模板,不同种类量子点分散在不同的内部液滴中,液滴经紫外诱导聚合转变为聚合物微球,制备得到结构不对称的多核心荧光编码微球。由于不同种类量子点相互之间没有干扰,每种量子点的光谱可以被分别记录,无需对不同颜色量子点的荧光进行区分和反褶积计算[41]。
荧光编码微球的制备方法各自有其优势和不足,如表1所示。

表1 荧光编码微球制备方法对比Tab.1 Comparison of different preparation methods for fluorescence-encoded microspheres
4 与其他功能复合
4.1 荧光编码-反射光谱编码
利用荧光强度进行编码的方式对微球粒径的均一性和编码过程的可控性具有非常高的要求,同时要求编码微球具有较高的荧光稳定性。光子晶体反射编码利用载体结构产生的独特反射光谱进行编码,编码稳定性好[42-44],不足之处在于反射峰的位置通常需要位于紫外-可见光区域,因此限制了编码的容量。为了增加编码容量,Li等通过层-层自组装法,将CdTe量子点组装在光子晶体编码的二氧化硅胶体晶体微球(SCCBs)表面(见图6),实现荧光和光子晶体反射光谱的复合编码[45-46]。由于两种光谱的产生原理完全不同,因此两种光谱编码相互之间没有干扰。编码只依赖荧光发射峰和光子晶体反射峰的位置,不依赖荧光强度,因此编码具有较高的稳定性。

图6 荧光编码-反射光谱复合编码[45]Fig.6 Schematic illustration of encoding microspheres with combination of fluorescence and reflectance spectrum[45]
4.2 荧光编码-荧光寿命编码
同样,为了克服荧光强度编码的缺陷,Chen等利用晶格畸变和掺杂,制备近红外荧光发射(700~910 nm)和长荧光寿命(约1 μs)的CdTe/CdS:Cu量子点,并利用量子点的多色发射和荧光寿命制备二维编码微球[47]。
4.3 荧光编码-前向散射编码
Wang等利用膜乳化法制备包裹CdSe/CdS/ZnS量子点的荧光编码微球,微球的粒径可以通过Shirasu介孔膜的孔径进行调节,不同粒径的微球可以通过流式细胞仪的前向散射信号进行区分,实现荧光编码和前向散射编码的复合[48]。
4.4 磁性-荧光编码微球
在悬浮芯片分析中,荧光编码微球需要经过多次的分离和清洗操作,如果在荧光编码的基础上引入磁性功能,制备磁性-荧光编码双功能微球,通过外加磁场可以大大简化微球的分离操作,降低分析过程的人力成本和时间成本。目前已有多篇磁性-荧光编码微球的报道,如Li等利用有机溶剂溶胀和高温溶胀法,依次将四氧化三铁纳米颗粒和量子点包裹在微球内部,制备磁性-荧光编码微球[49];Sathe等将疏水性量子点和四氧化三铁纳米颗粒通过疏水作用,组装在介孔二氧化硅内部孔道内[50];Wilson等[51-52]通过层-层自组装法,将量子点组装在商品化Dynal磁性微球表面,制备不同荧光编码的磁性-荧光编码微球;Insin等在二氧化硅微球表面同时包裹γ-Fe2O3纳米颗粒和CdSe/CdZnS量子点,制备磁性-荧光编码微球[53];Li等在荧光编码微球制备基础上,通过在磁性微球表面包裹染料掺杂的三聚氰胺-甲醛树脂壳层,得到核-壳式磁性-荧光编码微球,在高温煅烧除去荧光壳层的磁性微球表面重新包裹荧光壳层,实现磁性-荧光编码微球的再生利用[54];Wang等将含有量子点、磁性纳米颗粒和聚苯乙烯-顺丁烯二酸酐的甲苯溶液作为分散相,利用膜乳化法制备磁性-荧光编码微球[55];Zhao等利用毛细管微流控生成的油/水/油双乳液液滴,制备量子点编码颗粒,并通过流速和相组分的调节,制备内部含有独立荧光编码核和磁性核或者含有一个不对称结构Janus核的磁性-荧光编码微球[56];Gao等将制备量子点荧光编码微球的浓度调节流动聚焦技术扩展到磁性-荧光编码微球的制备,并利用简单的芯片设计,通过外加磁场实现检测过程的自动化[57]。
5 总结与展望
悬浮芯片技术因具有多功能性、高灵活性等优势,在生物医学和分析领域得到广泛的应用。作为悬浮芯片的分析载体,荧光编码微球的制备研究取得了一系列进展,涌现了多种多样的制备方法,包括有机溶剂溶胀法、层-层自组装法、包埋法、微流控技术、膜乳化法等,并有多个商业化产品和配套检测仪器可供用户选择。随着纳米技术的进一步发展,未来有望出现更多新型制备方法,进一步优化荧光编码微球的制备和使用。
目前,限制荧光编码容量的主要因素在于不同荧光发射光谱之间重叠,减少了可供选择的编码波长数量,同时增加了编码和解码的复杂性。为了提高编码容量,一方面可以通过研发新型窄发射光谱的染料或荧光纳米颗粒,增加编码波长的可选择数量,另一方面可以将荧光编码与其他编码方式复合,如之前提到的荧光编码与反射光谱编码、荧光编码与荧光寿命编码的复合等。需要注意的是,多种编码方式复合在提高编码容量的同时,可能会增加分析仪器的复杂性和检测的耗时,因此不能单纯地将多种编码方式进行杂合。
未来生物分析技术的发展趋势是集成化、自动化和高通量化,荧光编码微球有望与微流控技术结合,将样品混合、分离纯化和检测分析功能高度集成到一个微流控芯片上完成,实现检测过程的自动化和通量化,降低分析检测设备的复杂性和分析成本,有效促进即时检测技术的进展和应用。
综上所述,随着纳米技术的不断发展、新型荧光材料合成和纳米材料加工技术的不断进步,将有望克服目前荧光编码微球面临的局限,提高荧光编码微球的编码容量和微球质量,简化悬浮芯片分析设备复杂性,进一步扩展悬浮芯片技术在临床诊断、药物筛选、环境监测等领域的应用。
[1] Nolan JP, Sklar LA. Suspension array technology: evolution of the flat-array paradigm[J]. Trends Biotechnol, 2002, 20 (1): 9-12.
[2] Nolan JP, Mandy F. Multiplexed and microparticle-based analyses: Quantitative tools for the large-scale analysis of biological systems[J]. Cytom Part A, 2006, 69A (5): 318-325.
[3] Wilson R, Cossins AR, Spiller DG. Encoded microcarriers for high-throughput multiplexed detection[J]. Angew Chem Int Edit, 2006, 45 (37): 6104-6117.
[4] 张鑫, 赵鹏翔, 吕宝北, 等. 悬浮芯片系统的结构组成及应用进展[J]. 北京工业大学学报, 2015, 41(12): 1810-1816.
[5] 程涛, 王慧煜, 梅琳, 等. 悬浮芯片技术应用进展[J]. 生物技术通报, 2011(9): 48-51.
[6] 朱鹏, 张青雯, 祁芝珍, 等. 基于Luminex悬浮芯片的鼠疫耶尔森菌SNP分型方法研究[J]. 军事医学, 2012, 36(7): 502-507.
[7] Sun Zhiyong, Peng Yuan, Zhang Manci, et al. Simultaneous and highly sensitive detection of six different foodborne pathogens by high-throughput suspension array technology [J]. Food Control, 2014, 40: 300-309.
[8] Nolen BM, Lomakin A, Marrangoni A, et al. Urinary protein biomarkers in the early detection of lung cancer [J]. Cancer Prev Res, 2015, 8 (2):111-119.
[9] Tong Weihua, Ye Fei, He Liang, et al. Serum biomarker panels for diagnosis of gastric cancer [J]. Onco Targets Ther, 2016, 9: 2455-2463.
[10] Birtwell SW,Morgan H. Microparticle encoding technologies for high-throughput multiplexed suspension assays[J]. Integr Biol, 2009, 1 (5-6): 345-362.
[11] Braeckmans K, De Smedt SC, Leblans M, et al. Encoding microcarriers: present and future technologies[J]. Nat Rev Drug Discov, 2002, 1 (6): 447-456.
[12] Leng Yuankui, Sun Kang, Chen Xiaoyuan, et al. Suspension arrays based on nanoparticle-encoded microspheres for high-throughput multiplexed detection[J]. Chem Soc Rev, 2015, 44 (15): 5552-5595.
[13] Han Mingyong, Gao Xiaohu, Su JZ, et al. Quantum-dot-tagged microbeads for multiplexed optical coding of biomolecules[J]. Nat Biotech, 2001, 19 (7): 631-635.
[14] Zhang Fan, Shi Qihui, Zhang Yichi, et al. Fluorescence upconversion microbarcodes for multiplexed biological detection: nucleic acid encoding[J]. Adv Mater, 2011, 23 (33): 3775-3779.
[15] Wang Gang, Zhang Pengfei, Dou Hongjing, et al. Efficient incorporation of quantum dots into porous microspheres through a solvent-evaporation approach[J]. Langmuir, 2012, 28 (14): 6141-6150.
[16] Song Tao, Zhang Qi, Lu Chaoliang, et al. Structural design and preparation of high-performance QD-encoded polymer beads for suspension arrays[J]. J Mater Chem, 2011, 21 (7): 2169-2177.
[17] Song Tao, Liu Junqing, Li Wenbin, et al. Self-healing encapsulation strategy for preparing highly stable, functionalized quantum-dot barcodes[J]. ACS Appl Mater Interfaces, 2014, 6 (4): 2745-2752.
[18] Gao Xiaohu, Nie Shuming. Doping mesoporous materials with multicolor quantum dots[J]. J Phys Chem, 2003, 107 (42): 11575-11578.
[19] Gao Xiaohu, Nie Shuming. Quantum dot-encoded mesoporous beads with high brightness and uniformity: rapid readout using flow cytometry[J]. Anal Chem, 2004, 76 (8): 2406-2410.
[20] Hu Shanghsiu, Gao Xiaohu. Stable encapsulation of quantum dot barcodes with silica shells[J]. Adv Funct Mater, 2010, 20 (21): 3721-3726.
[21] Wang Dayang, Rogach AL, Caruso F. Semiconductor quantum dot-labeled microsphere bioconjugates prepared by stepwise self-assembly[J]. Nano Lett, 2002, 2 (8): 857-861.
[22] Sukhanova A, Susha AS, Bek A, et al. Nanocrystal-encoded fluorescent microbeads for proteomics: antibody profiling and diagnostics of autoimmune diseases[J]. Nano Lett, 2007, 7 (8): 2322-2327.
[23] Allen CN, Lequeux N, Chassenieux C, et al. Optical analysis of beads encoded with quantum dots coated with a cationic polymer[J]. Adv Mater, 2007, 19 (24): 4420-4425.
[24] Schnackel A, Hiller S, Reibetanz U, et al. Fluorescent bead arrays by means of layer-by-layer polyelectrolyte adsorption[J]. Soft Matter, 2007, 3 (2): 200-206.
[25] Nanthakumar A, Pon RT, Mazumder A, et al. Solid-phase oligonucleotide synthesis and flow cytometric analysis with microspheres encoded with covalently attached fluorophores[J]. Bioconjugate Chem, 2000, 11 (2): 282-288.
[26] Kozak D, Kithva P, Bax J, et al. Development of encoded particle-polymer arrays for the accelerated screening of antifouling layers[J]. Chem Commun, 2011, 47 (34): 9687-9689.
[27] Zhang Zhiling, Long Yao, Pan Jianbo, et al. Preparation of fluorescence-encoded microspheres in a core-shell structure for suspension arrays[J]. J Mater Chem, 2010, 20 (6): 1179-1185.
[28] Liu Qinghao, Liu Jia, Guo Jinchun, et al. Preparation of polystyrene fluorescent microspheres based on some fluorescent labels[J]. J Mater Chem, 2009, 19 (14): 2018-2025.
[29] Wu Youshen, Li Yan, Xu Jianhua, et al. Incorporating fluorescent dyes into monodisperse melamine-formaldehyde resin microspheres via an organic sol-gel process: a pre-polymer doping strategy[J]. J Mater Chem B, 2014, 2 (35): 5837-5846.
[30] Vaidya SV, Gilchrist ML, Maldarelli C, et al. Spectral bar coding of polystyrene microbeads using multicolored quantum dots[J]. Anal Chem, 2007, 79 (22): 8520-8530.
[31] Yang Yunhua, Wen Zhongkai, Dong Yuping, et al. Incorporating CdTe nanocrystals into polystyrene microspheres: towards robust fluorescent beads[J]. Small, 2006, 2 (7): 898-901.
[32] Chan Y, Zimmer JP, Stroh M, et al. Incorporation of luminescent nanocrystals into monodisperse core-shell silica microspheres[J]. Adv Mater, 2004, 16 (23-24): 2092-2097.
[33] Graf C, Dembski S, Hofmann A, et al. A general method for the controlled embedding of nanoparticles in silica colloids[J]. Langmuir, 2006, 22 (13): 5604-5610.
[34] Kuang Min, Wang Dayang, Bao Haobo, et al. Fabrication of multicolor-encoded microspheres by tagging semiconductor nanocrystals to hydrogel spheres[J]. Adv Mater, 2005, 17 (3): 267-270.
[35] Gong Yanjun, Gao Mingyuan, Wang Dayang, et al. Incorporating fluorescent CdTe nanocrystals into a hydrogel via hydrogen bonding: toward fluorescent microspheres with temperature-responsive properties[J]. Chem Mater, 2005, 17 (10): 2648-2653.
[36] Wang Xiebing, Wang Gang, Li Wanwan, et al. NIR-emitting quantum dot-encoded microbeads through membrane emulsification for multiplexed immunoassays[J]. Small, 2013, 9 (19): 3327-3335.
[37] Sun Xiaoting, Liu Mei, Xu Zhangrun. Microfluidic fabrication of multifunctional particles and their analytical applications[J]. Talanta, 2014, 121: 163-177.
[38] Gerver RE, Gomez-Sjoberg R, Baxter BC, et al. Programmable microfluidic synthesis of spectrally encoded microspheres[J]. Lab Chip, 2012, 12 (22): 4716-4723.
[39] Fournier-Bidoz S, Jennings TL, Klostranec JM, et al. Facile and rapid one-step mass preparation of quantum-dot barcodes[J]. Angew Chem Int Edit, 2008, 47 (30): 5577-5581.
[40] Ji Xinghu, Zhang Nangang, Cheng Wei, et al. Integrated parallel microfluidic device for simultaneous preparation of multiplex optical-encoded microbeads with distinct quantum dot barcodes[J]. J Mater Chem, 2011, 21 (35): 13380-13387.
[41] Chen Yang, Dong Pengfei, Xu Jianhong, et al. Microfluidic generation of multicolor quantum-dot-encoded core-shell microparticles with precise coding and enhanced stability[J]. Langmuir, 2014, 30 (28): 8538-8542.
[42] Cunin F, Schmedake TA, Link JR, et al. Biomolecular screening with encoded porous-silicon photonic crystals[J]. Nat Mater, 2002, 1 (1): 39-41.
[43] Zhao Yuanjin, Zhao Xiangwei, Hu Jing, et al. Encoded porous beads for label-free multiplex detection of tumor markers[J]. Adv Mater, 2009, 21 (5): 569-572.
[44] Ye Baofen, Ding Haibo, Cheng Yao, et al. Photonic crystal microcapsules for label-free multiplex detection[J]. Adv Mater, 2014, 26 (20): 3270-3274.
[45] Li Juan, Zhao Xiangwei, Zhao Yuanjin, et al. Quantum-dot-coated encoded silica colloidal crystals beads for multiplex coding[J]. Chem Commun, 2009, 17 (17): 2329-2331.
[46] Li Juan, Zhao Xiangwei, Zhao YuanJin, et al. Colloidal crystal beads coated with multicolor CdTe quantum dots: microcarriers for optical encoding and fluorescence enhancement[J]. J Mater Chem, 2009, 19 (36): 6492-6497.
[47] Chen Chi, Zhang Pengfei, Gao Guanhui, et al. Near-infrared-emitting two-dimensional codes based on lattice-strained core/(doped) shell quantum dots with long fluorescence lifetime[J]. Adv Mater, 2014, 26 (36): 6313-6317.
[48] Wang Gang, Leng Yuankui, Dou Hongjing, et al. Highly efficient preparation of multiscaled quantum dot barcodes for multiplexed hepatitis b detection[J]. ACS Nano, 2013, 7 (1): 471-481.
[49] Li Yunhong, Song Tao, Liu Junqing, et al. An efficient method for preparing high-performance multifunctional polymer beads simultaneously incorporated with magnetic nanoparticles and quantum dots[J]. J Mater Chem, 2011, 21 (33): 12520-12528.
[50] Sathe TR, Agrawal A, Nie Shuming. Mesoporous silica beads embedded with semiconductor quantum dots and iron oxide nanocrystals: dual-function microcarriers for optical encoding and magnetic separation[J]. Anal Chem, 2006, 78 (16): 5627-5632.
[51] Wilson R, Spiller DG, Prior IA, et al. Magnetic microspheres encoded with photoluminescent quantum dots for multiplexed detection[J]. J Mater Chem, 2007, 17 (41): 4400-4406.
[52] Wilson R, Spiller DG, Prior IA, et al. A simple method for preparing spectrally encoded magnetic beads for multiplexed detection[J]. ACS Nano, 2007, 1 (5): 487-493.
[53] Insin N, Tracy JB, Lee H, et al. Incorporation of iron oxide nanoparticles and quantum dots into silica microspheres[J]. ACS Nano, 2008, 2 (2): 197-202.
[54] Li Yan, Wu Youshen, Luo Cheng, et al. Rewritable magnetic fluorescence-encoded microspheres: preparation, characterization, and recycling[J]. J Mater Chem C, 2015, 3 (31): 8262-8271.
[55] Wang Gang, Leng Yuankui, Guo Heze, et al. Efficient preparation of magnetic quantum dot barcodes[J]. J Mater Chem B, 2014, 2 (47): 8310-8313.
[56] Zhao Yuanjin, Shum Hocheung, Chen Haosheng, et al. Microfluidic generation of multifunctional quantum dot barcode particles[J]. J Am Chem Soc, 2011, 133 (23): 8790-8793.
[57] Gao Yali, Lam AWY, Chan WCW. Automating quantum dot barcode assays using microfluidics and magnetism for the development of a point-of-care device[J]. ACS Appl Mater Interfaces, 2013, 5 (8): 2853-2860.
Progress in the Preparation of Fluorescence-Encoded Microspheres
Li Yan1Luo Cheng1*Wu Daocheng2
1(SchoolofMedicine,YichunUniversity,Yichun336000,Jiangxi,China)2(KeyLaboratoryofBiomedicalInformationEngineeringofEducationMinistry,SchoolofLifeScienceandTechnology,Xi’anJiaotongUniversity,Xi’an710049,China)
Suspension array is a promising platform for multiplex analyses with broad applications in science research and clinical diagnosis. As one of the key components for the suspension array, fluorescence-encoded microspheres have received much attention and a lot of achievements have been made. In this review, the analysis pattern and applications of suspension array were introduced, and recent advances in the fluorescence-encoded microspheres were summarized according to the classification of preparation methods including swelling method, layer-by-layer (LBL) self-assembly, embedding in microspheres, microfluidic techniques and membrane emulsification. Current challenges and future directions of fluorescence-encoded microspheres were also outlined.
suspension array; microspheres; fluorescence-encoding; quantum dots
10.3969/j.issn.0258-8021. 2017. 02.013
2016-07-20, 录用日期:2016-09-24
国家自然科学基金(81471771);江西省自然科学基金(20161BAB215196)
R318
A
0258-8021(2017) 02-0219-09
*通信作者(Corresponding author), E-mail: luocheng999@163.com

