全自动免疫组化仪在标准化染色质量控制中的应用
彭大云 赖续文 张 伟* 陈晓东 赖日权 闫广宁
全自动免疫组化仪在标准化染色质量控制中的应用
彭大云①赖续文①张 伟①*陈晓东①赖日权①闫广宁①
目的:探讨全自动免疫组化仪在标准化染色质量控制中的应用。方法:选择广谱细胞角蛋白(CKpan)、雌激素受体(ER)、突触素(Syn)、上皮生长因子受体(EGFR)及C-erbB-2蛋白(HER2)等34种抗体(一抗),使用统一的第二抗体(二抗),分别采用手工操作和全自动免疫组化仪两种方法对340张病理切片进行染色,统计比较两种方法的染色优良率,同时回顾性分析室间质量控制染色评价结果。结果:两种方法染色质量结果比较:①手工操作的170张病理切片中染色质量优等101张(占59.4%),良49张(占28.8%),差20张(占11.8%),优良率为88.2%;②全自动免疫组化仪染色的170张病理切片中染色质量优等140张(占82.3%),良28张(占16.5%),差2张(占1.2%),优良率为98.8%;两种方法优良率比较差异显著有统计学意义(x2=15.746,P<0.05);室间质量控制平均判读符合率为97.9%,染色符合率为96.0%,整体符合率为93.9%。结论:全自动免疫组化仪染色标准化程度高,染色均匀,定位准确,背景干净,无边缘效应,重复性好,能保证染色结果的准确与稳定,为临床病理诊断、判断预后和指导用药提供科学、准确及可靠的依据。
临床病理诊断;免疫组织化学;全自动免疫组化仪;手工操作染色;质量控制
彭大云,男,(1976- ),本科学历,主管技师。广州军区广州总医院病理科,从事临床常规病理、免疫组织化学及分子病理学技术工作。
随着精准医学靶向治疗的兴起,免疫组织化学染色正逐渐走出单一辅助常规病理诊断的角色,发展为科学研究、判断患者预后以及协助临床用药的重要辅助手段[1-2]。然而,在临床实际工作中,因环境、方法及个人操作差异等诸多因素影响到染色结果的准确与稳定。全自动免疫组化仪的应用对染色标准化起到了一定的推动,有效解决了人为造成的染色结果假象问题[3-4]。为此,本研究对手工操作和全自动免疫组化仪两种方法的染色质量结果进行比较,并回顾性分析2012-2015年参加卫生计生委病理质量控制中心组织的室间质量控制评价反馈结果。
1 资料与方法
1.1 一般资料
回顾性收集2016年1-9月广州军区广州总医院病理科乳腺癌、肺癌、肝癌、淋巴瘤以及间质瘤等常见手术切除标本,检测项目涉及34种抗体(一抗),均同时切2张片,共计340张片,用于手工操作及自动染色仪器染色,各染色170张片;外院室间质控切片由病理质量控制中心统一提供,所有切片厚度均≤3 μm,经恒温箱58 ℃烤片≥2 h。
1.2 仪器与试剂
(1) Dako Autostainer Link48型全自动免疫组化仪、PTlink脱蜡修复一体机,二抗及DAB显色系统均为丹麦Dako公司配套产品。CIMO DNP-9052BS-III恒温箱(上海新苗医疗器械制造有限公司)。
(2)一抗试剂:雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、波形蛋白(Vimentin)、CD3、CD20及CD79购于丹麦Dako公司;突触素(synaptophysin,Syn)、嗜铬素A (chromogranin A,CgA)、细胞角蛋白19(cytokeratin 19,CK19)、上皮生长因子受体(epidermal growth factor receptor,EGFR)、神经元特异性烯醇化酶(neuron specific endolase,NSE)、CD117以及Dog-1购于英国NovocastraTM公司;广谱细胞角蛋白(cytokeratin pan ,CKpan)、内皮细胞标记(CD34)、癌胚抗原(CEA)、甲状腺转录因子(TTF-1)、胶质纤维酸性蛋白(glial fibrillary acid protein,GFAP)、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)、前列腺特异性抗原(prostate specific antigen,PSA)、肝细胞(hepatocyte,HepPar-1)、C-erbB-2蛋白(HER2)以及Ki67等购于美国OriGene公司,均为即用性工作液。
1.3 染色及评估方法
(1)采用EnVision两步法。质量控制中心所寄切片均由仪器染色;本研究中的340张切片由5名染色技术人员分批采用两种方法染色同时完成,每张切片均按需设定阴性和阳性对照,染色完成后判读结果。
(2)由2名经验丰富的病理医师按标准判读,统一意见给出最终染色质量结果;室间质量控制染色判读结果登记表和染色切片一同寄回病理质量控制中心,由质量控制中心组织资深病理学专家以双盲方式集中阅片判读评分,统计反馈结果。
1.4 评估指标
(1)切片染色质量结果按优、良、差3个等级统计,其标准为:①优,定位准确,背景干净,着色均匀,无边缘效应及非特异性染色;②良,定位较准确,着色较均匀,有少量边缘效应及非特异性染色;③差,定位不准确,着色不均,非特异性染色严重。染色优良率计算为公式1:
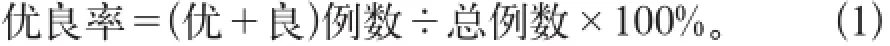
(2)室间病理质量控制评测中心反馈指标及标准:判读符合率主要反映该科室评分标准与专家评分标准的一致性。判读符合率计算为公式2:

(3)染色符合率主要反映该科室染色水平。染色符合率计算为公式3:

(4)整体符合率主要反映该科室实际检测水平,包括技术人员染色水平和病理医生评分水平。整体符合率计算为公式4:

以上3项,即公式(2)、公式(3)及公式(4)指标均≥90%为室间质量控制评测合格。
1.5 统计学方法
应用SPSS 13.0统计软件进行数据分析,计数资料两两比较采用x2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 两种方法染色质量评估结果比较
CKpan、CEA、HER2、ER、CD20、CD117以及Dog-1等34种一抗分别采用手工和全自动免疫组化仪两种方法染色,按标准进行判读评估,染色质量结果按优、良、差3个等次进行统计,各种一抗每组具体染色质量评估结果统计见表1。
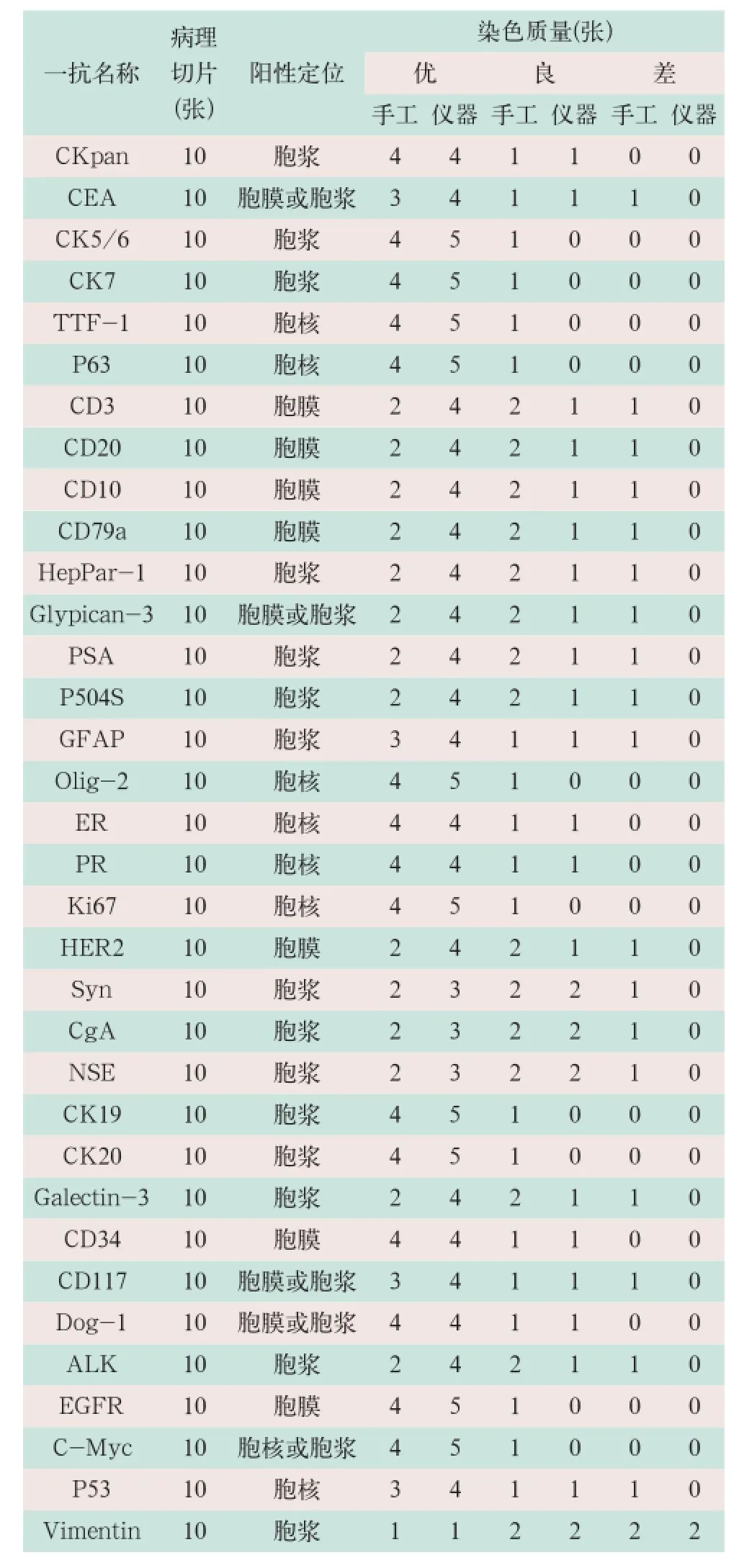
表1 34种一抗采用手工及仪器两种染色方法的染色质量评估结果
2.2 两种方法染色质量结果比较
手工操作和全自动免疫组化仪两种方法染色质量结果比较:①手工操作,170张病理切片中染色质量优101张(占59.4%),良49张(占28.8%),差20张(占11.8%),优良率为88.2%(150/170);②全自动免疫组化仪,170张病理切片中染色质量优等140张(占82.3%),良28张(占16.5%),差2张(占1.2%),优良率为98.8%(168/170);两组方法染色质量结果比较,差异有统计学意义(x2=15.746,P<0.05),见表2。
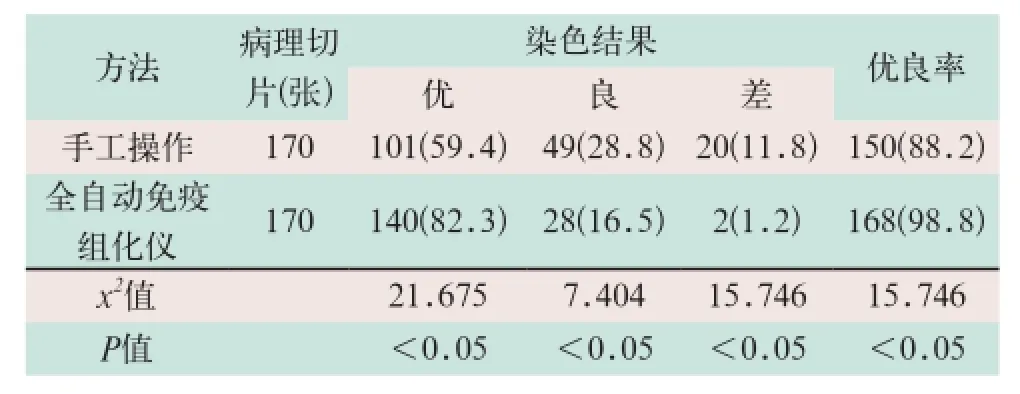
表2 手工与仪器两种染色方法的染色质量结果比较[张(%)]
2.3 室间病理质量控制中心评测结果
2012-2015年参加广东省及国家卫生计生委病理质量控制中心组织的室间质量控制评测,所有评测项目均由全自动免疫组化仪染色,按标准判读评估,质量控制中心反馈结果显示,总体平均判读符合率为97.9%,染色符合率为96.0%,整体符合率为93.9%,见表3。
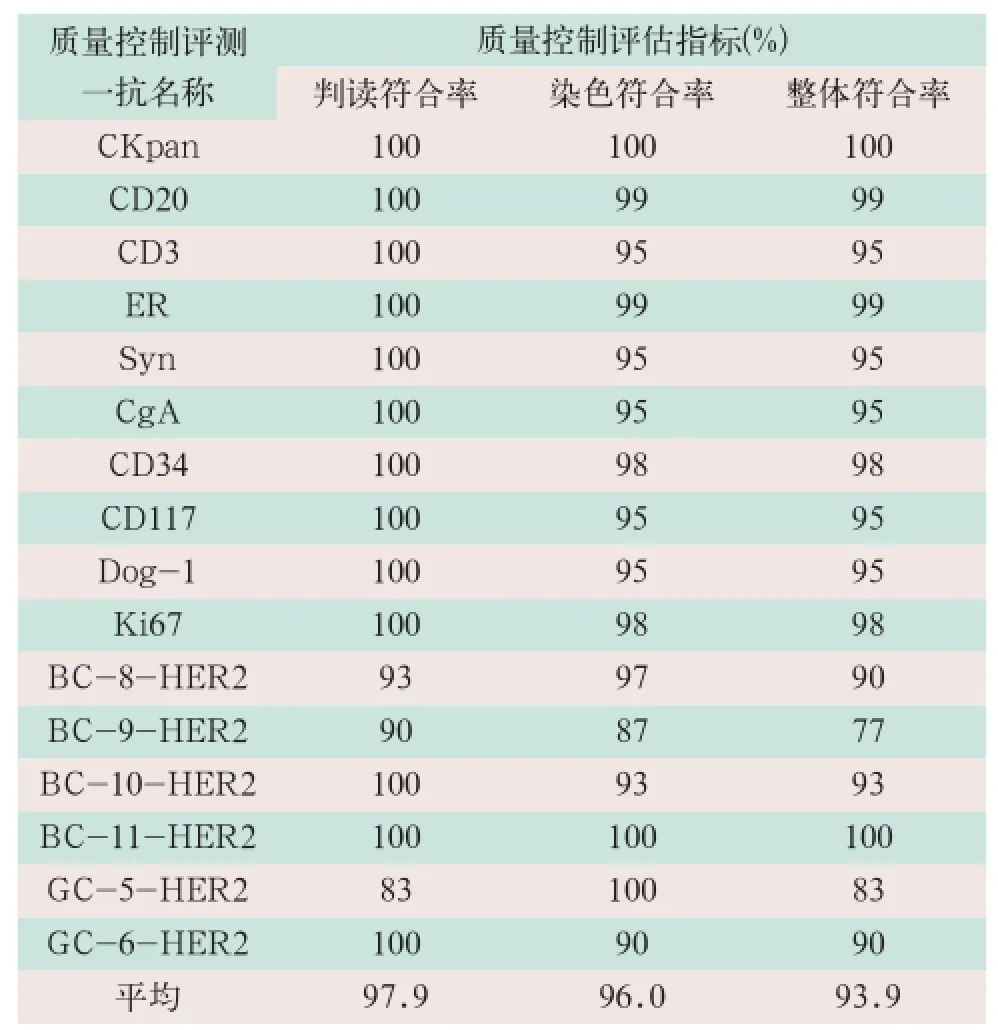
表3 2012-2015年参加的室间质量控制评测项目及各评估指标反馈结果
3 讨论
免疫组化检测是一种技术性很强的综合性技术,其步骤多,时间长,操作过程中难免会因个人手法差异、抗原修复、试剂滴加、切片冲洗以及环境温度与湿度等多重因素影响而产生人为的实验误差,影响染色结果的准确性与稳定性。为得到准确可靠的免疫组化结果,整个检测过程中进行标准化的质量控制显得尤为重要[5-6]。
本研究中,切片由5名技术人员在不同时间分批次同时完成手工和全自动免疫组化仪染色,其目的是最大化摸拟不定因素对于染色质量的影响。在两种染色方法质量结果比较中,结果为优的,手工操作占59.4%,全自动免疫组化仪占82.3%;结果为良的,手工操作占28.8%,全自动免疫组化仪占16.5%;结果为差的,手工操作占11.8%,全自动免疫组化仪占1.2%;总体染色优良率手工操作为88.2%,全自动免疫组化仪为98.8%;数据比较差异显著,有统计学意义。由病理质量控制中心反馈的质量控制评价结果显示,总体平均判读符合率为97.9%,染色符合率为96.0%,整体符合率为93.9%;因参加国家病理质量控制评价中心的HER2质量控制每轮需染30张切片,其中仅二次因组织掉片、苏木素过染和医生判读标准未能正确把握而造成符合率<90%未能通过室间质量控制评价。本研究结果表明,全自动免疫组化仪染色均匀,定位准确,背景干净,重复性好,为免疫组化染色标准化提供了有利条件[7-8]。同时,解决了外来干扰因素的影响,在节约人力、物力基础上,提高了实验结果的精准度和标准化。本研究与其他文献报道结论相近,即全自动免疫组化仪染色质量明显优于手工操作[9-14]。
日常实际操作仪器染色过程中为保证结果准确与稳定,需要注意以下细节:①粘附玻片的选择,尽量选用经过特殊处理带有正电荷的粘附玻片,便于试剂的弥散对组织的全覆盖,而本研究发现应用多聚赖胺酸、APES制成的涂胶片试剂会出现收缩,对较大组织不能全覆盖,易引起边缘效应或阴阳脸;②先脱蜡再行PTlink修复,尽管PTlink中的修复液具有脱蜡功能,但在应用过程中发现染色切片较多时靠后批次的切片脱蜡不彻底,易致染色不均,有非特异性背景,通过摸索发现,在PTlink修复前经二甲苯脱蜡预处理将较好的改善这一问题;③试剂量的选择与滴加,本机提供100 μl、150 μl及200 μl等多种选择,在应用中发现150 μl的量不论组织大小都足以覆盖全玻片,而100 μl太少,200 μl太多造成不必要的浪费增加成本,同时应尽量根据组织的捞片位置灵活设置试剂滴加区域;④清洗与保养,Dako Autostainer Link48染色仪软件上设置有每染完200张切片就会自动提示进行清洗,为保证染色正常进行,必须即时用配套的DAB-Away试剂清洗,同时要定时联系Dako厂商进行全面的系统性维护保养,对切片架进行水平校准;⑤废液的回收与处理,Dako Autostainer Link48具有废液回收系统,将有毒的DAB和无毒的Buffer液按不同的管道回收,分别按不同要求专业化处理,有利于环保和实验操作人员健康[15]。
4 结语
全自动免疫组化仪的应用不仅有利于免疫组化的标准化质量控制、保证染色结果的准确与稳定、为临床患者的病理诊断、治疗及预后判断提供准确依据,同时还有利于环保和健康。但必须结合实际,对于无法购置全自动免疫组化仪的实验室,在采用手工染色时必须严格执行操作规程,做好质量控制工作。
[1]虞杰,石伟强.全自动免疫组化仪的应用及影响其染色质量的因素探讨[J].泰州职业技术学院学报,2011,11(6):69-71.
[2]栗娜,黄虎.免疫组织化学染色质控及常见问题分析[J].中国组织化学与细胞化学杂志,2009,18(1):115-116.
[3]陈杰,郑杰,霍临明.重视免疫组织化学的质量控制和标准化[J].中华病理学杂志,2005,34(2):65-66.
[4]陈芳,李海.全自动免疫组织化学染色技术的应用[J].临床和实验医学杂志,2011,10(20):1613-1614.
[5]谭卫峰,刘庆猛,何平生.免疫组化质量控制的标准化管理[J].中国现代医生,2013,51(31):134-136,139.
[6]朱芮,徐丽娟,王常利,等.基于标准作业程序的病理标准化管理系统设计[J].中国医学装备,2015,12(4):25-27,28.
[7]杨月红,袁静萍,袁修学,等.自动免疫组化仪的使用体会[J].临床与实验病理学杂,2011,27(3):333-334.
[8]林蓁,田甜.提高全自动免疫组化仪制片质量的相关细节[J].临床与实验病理学学杂志,2012,28(6):700-701.
[9]覃思繁,韦常宏,罗元,等.全自动免疫组化染色平台在临床病理检查中的应用[J].中国癌症防治杂志,2015,7(4):294-297.
[10]齐彬,周平安,徐琼,等.全自动免疫组化染色质量控制的经验和体会[J].临床医药文献杂志,2014,1(7):1109,1114.
[11]谭卫峰,任丽芳,刘庆猛.全自动免疫组化染色中阳性对照方法的应用[J].现代实用医学,2013,25(11):1288-1289.
[12]周立娟,苏丹,张莉,等.全自动免疫组化仪检测ALK融合基因蛋白的应用体会[J].诊断病理学杂志,2015,22(6):378.
[13]陈艳,潘美华.全自动免疫组化仪与手工操作应用体会[J].临床与实验病理学杂志,2015,31(6):708-709.
[14]张雯静,陈洁,孔静萍.两种型号的自动免疫组化染色机的应用及体会[J].现代实用医学,2014,26(12):1572-1574.
[15]罗小平,胡维维,伍尚金.全自动免疫组化染色仪与人工操作的比较[J].医疗卫生装备,2007,28(4):59-60.
Objective: To discuss the application of immunohistochemistry autostainer in the quality control of standardized dyeing. Methods: 34 categories primary antibodies, such as cytokeratin pan (CKpan), estrogen Receptor (ER), synaptophysin (Syn), epidermal growth factor receptor (EGFR), C-erbB-2(HER2) and so on, and uniformly second antibody were used in the manual operation (dyed 170 pathological section) and immunohistochemistry autostainer (dyed 170 pathological section), respectively. And to statistic and compare the excellent rate of dyeing for the two methods, at the same time, retrospective analysis study was used to analyze the dyeing results of external quality control assessment. Results: Quality control of standardized dyeing by manual: 59.4% (101/170) were evaluated as excellent, 28.8% (49/170 ) were evaluated as good and 11.8% (20/170 ) were evaluated as poor; the overall excellent and good rate was 88.2% (150/170). Quality control of standardized dyeing by immunohistochemistry autostainer: 82.3% (140/170)were evaluated as excellent, 16.5% (28/170 ) were evaluated as good and 1.2% (2/170) as poor; the overall excellent and good rate was 98.8% (168/170). The difference between two groups was statistical significant (x2=15.746, P<0.05). The average interpretation coincidence rate of external quality control was 97.9%, and the dyeing coincidence rate was 96.0% and overall coincidence rate was 93.9%. Conclusion: Immunohistochemistry autostainer is highly standardized, with uniform staining, accurate positive results, clear background and good repeatability, without edge effect; and it can ensured accuracy and stability for dyeing result, which can provide more scientific, accurate and reliable evidences for clinical pathological diagnosis, judgment prognosis and guiding medication.
Clinical pathological diagnosis; Immunohistochemistry; Immunohistochemistry autostainer; Manual operation dyeing; Quality control.
1672-8270(2017)03-0036-04
R446.8
A
10.3969/J.ISSN.1672-8270.2017.03.009

2016-11-09
①广州军区广州总医院病理科 广东 广州 510010
*通讯作者:zw54177@126.com
Application of immunohistochemistry autostainer in the quality control of standardized dyeing/ PENG Da-yun, LAI Xu-wen, ZHANG Wei, et al//China Medical Equipment,2017,14(3):36-39.
[First-author’s address] Department of Pathology, General Hospital of Guangzhou Military Command of PLA, Guangzhou 510010, China.

